藏药格尔琼体外杀伤多房棘球蚴药效作用及活性部位的研究※
刘文磊,蒋巧艳,洛桑达哇,杨宝良,樊海宁,邓 勇*,汤 锋,3**
(1.青海大学附属医院肝胆胰外科,青海 西宁 810001;2.青海大学高原医学研究中心,青海 西宁 810001;3.青海省包虫病重点实验室,青海 西宁 810001)
藏药格尔琼体外杀伤多房棘球蚴药效作用及活性部位的研究※
刘文磊1,3,蒋巧艳2,洛桑达哇1,3,杨宝良1,3,樊海宁1,3,邓 勇1,3*,汤 锋2,3**
(1.青海大学附属医院肝胆胰外科,青海 西宁 810001;2.青海大学高原医学研究中心,青海 西宁 810001;3.青海省包虫病重点实验室,青海 西宁 810001)
目的 明确藏药组方格尔琼体外对抗多房棘球蚴药效学活性及其活性部位。方法 将格尔琼经醇提、萃取、凝胶柱层析、硅胶柱层析、液相制备等方法分离纯化得到24个不同部位的化合物,将所得化合物以不同的浓度在体外与原头节共培养,光镜下观察原头节死亡率及结构改变。结果 空白组原头节死亡率为13.67±0.577,格尔琼醇提物组为93.67±1.523(P<0.0000),阿苯达唑组为47.67±2.08(P<0.0000),且格尔琼醇提物组原头节死亡后形态与阿苯达唑组有明显差异。继而对格尔琼醇提物进行萃取分离,获得乙酸乙酯部位、正丁醇部位、石油醚部位三个部分,药效学实验发现乙酸乙酯部位组原头节死亡率为93.67±0.577(P<0.0000)。对乙酸乙酯部位进行凝胶柱层析分离,获得Fraction1、Fraction2、Fraction3、Fraction4、Fraction5五个部位,药效学实验发现Fraction3组原头节死亡率为97.33±1.528(P<0.0000)。对Fraction3进行硅胶柱层析分离,获得Fraction3.1、Fraction3.2、Fraction3.3、Fraction3.4、Fraction3.5、Fraction3.6、Fraction3.7、Fraction3.8八个部位,药物实验发现Fraction3.1组原头节死亡率为83.00±4.583(P<0.0000)。对Fraction3.1进行液相制备分离,获得Fraction3.1.1、Fraction3.1.2、Fraction3.1.3、Fraction3.1.4、Fraction3.1.5、Fraction3.1.6、Fraction3.1.7七个部位,药物实验发现Fraction3.1.2组原头节死亡率为83.33±3.06(P<0.0000)。结论 格尔琼相比阿苯达唑对体外多房棘球蚴具有较强的杀伤作用,其活性组分为大分子非极性化合物。
藏药 体外培养 多房棘球蚴 药效活性部位
泡型包虫病(Alveolar Echinococcosis,AE)又称多房棘球蚴病,是因多房棘球蚴(Echinococcosis Multilocularis,EM)感染引起的一种人畜共患寄生虫疾病,它可以向周围组织浸润生长并可能向远处转移[1],故有“虫癌”之称。该病早期无特殊临床症状,发现时多为晚期,该期的治疗手段主要为手术联合化疗,疗效不理想。目前世界卫生组织治疗泡型包虫病的推荐化疗药物为阿苯达唑,但其水溶性差,肠道不易吸收,因而生物利用度不高[2],且长期持续治疗易导致寄生虫出现耐药。本课题组近期研究结果显示,高原低氧环境影响阿苯达唑的体内代谢,低氧环境可影响阿苯达唑代谢关键酶CYP3A4活性,从而导致阿苯达唑有效成分阿苯达唑亚砜代谢减少[3]。因此寻找新的治疗泡型包虫病药物的研究,对于青海省三江源地区泡型包虫病的治疗具有十分重要的科学意义。
格尔琼为《金珠本草》所记载,由麝香、红花、丁香、牛黄、唐古特乌头等15种名贵药材组成,具有消炎、止痛、祛风、补肝益肾、解毒通淋等功效。藏医临床常用于肝萎症、肝热症的治疗。藏医发现格尔琼具有较好的治疗棘球蚴病的药效学作用,本研究通过有机溶剂提取、凝胶柱层析、硅胶柱层析、液相层析等方法明确藏药组方格尔琼体外对抗多房棘球蚴药效学活性及其活性部位。
1 材料与方法
1.1 材料
格尔琼(青海省藏医院),无水乙醇、甲醇(烟台双双化工),石油醚、正丁醇(天津红岩),乙酸乙酯(天津永大),RPMI-1640(Gibco),青霉素-链霉素混合溶液(Gibco)。
5810R型离心机(Eppendorf),RE-52型旋转蒸发器( 上海亚荣生化仪器厂),SHZ-IIID 型循环水真空泵(上海亚荣生化仪器厂),DHG-9070B鼓风干燥箱(上海朗轩实验设备有限公司),DK-2000-IIIL型电热恒温水浴锅(天津市泰斯特仪器有限公司),DRT-2N 型电热套(郑州大城科工贸有限公司),BT224S电子天平[赛多利斯科学仪器(北京)有限公司],BB150型培养箱(Thermo),Axio Vert.A1型光学显微镜(蔡司)。
1.2 方法
1.2.1 药物提取分离
取干燥的格尔琼粉末1 kg,加无水乙醇1 L回流提取3次,每次1 h,合并滤液,减压浓缩得浸膏。浸膏用水混悬,依次用等量石油醚、乙酸乙酯、正丁醇萃取3次[4],得到石油醚部位、乙酸乙酯部位、正丁醇部位,分别减压浓缩得浸膏。将乙酸乙酯部位10 g用甲醇溶解后进行硅胶柱层析,依次用二氯甲烷:甲醇=98:2、95:5、90:10、50:50、0:100洗脱5个柱体积,分别减压浓缩得浸膏(Fraction1-5)。将Fraction 3部位(100mg)用10 mL甲醇溶解,过凝胶柱(Sephadex LH-20),用甲醇洗脱至凝胶柱无颜色,收集滤液,以硅胶薄层色谱指导合并相同组分,共获取8组成分,分别减压浓缩得浸膏(Fraction3.1-8)。收集Fraction3.1组分药物浸膏,用1 mL甲醇溶解,以甲醇-水作流动相,洗脱程序为0~5 min, 5%;5~45 min,5%~75%;45~50 min,75%;50~51 min,75%~100%;平衡10 min。按照高效液相色谱图收集药物成分,分别为0~23、23~27、27~35、35~40、40~45、45~50 min,冲柱期7个组分,分别减压浓缩得浸膏(Fraction3.1.1-7)。
1.2.2 原头节的体外培养
从感染泡球蚴的沙鼠腹腔中,在无菌条件下采集含原头节的囊块,在PBS(含0.8×103U/mL青霉素和1mg/mL链霉素,pH7.2~7.4)中剪碎后,用四层纱布过滤,室温下沉淀数分钟,用PBS(含0.8×103U/mL青霉素和1mg/mL链霉素,pH7.2~7.4)清洗数次。镜下观察活原头节占95%以上,用RPMI-1640培养基(含0.8×103U/mL青霉素和1mg/mL链霉素,pH7.2~7.4)稀释至10%(体积),置培养箱(37℃,5%CO2)中培养。
1.2.3 药物活性测定
取格尔琼醇提物、石油醚部位、乙酸乙酯部位、正丁醇部位、Fraction1-5部位、Fraction3.1-8部位适量,用DMSO促溶,含10%体积原头节的RPMI-1640培养基分别稀释至200、20、20、20、1 mg/mL和200 μg/mL,使DMSO终浓度为0.1%[5],培养于6孔板中,每组3个复孔。取300 μg Fraction3.1部位制备液相,收集不同组分,减压浓缩后用甲醇溶解,置于6孔板中,待甲醇挥发后用DMSO助溶,加入3 mL10%体积的原头节悬液,使DMSO终浓度为0.1%[5],每组设置3个复孔,并设置3个DMSO浓度为0.1%的孔为空白对照,在培养箱(37℃,5%CO2)中培养144 h。用原头节溶液与0.4%台盼蓝溶液混合(9:1体积)染色,普通光镜下观察。判断原则:死亡原头节蓝染且无活动性,活头节拒染,不着色且有活动性。随机挑选视野计数100个原头节中着色原头节数目,以着色者占原头节的比例为原头节死亡率,共计数3次,计算平均死亡率[6]。
1.2.4 统计学分析
采用 SPSS 17.0软件进行统计学分析。结果以均数±标准差表示,组间均数比较采用单因素t检验,检验水准α=0.05。
2 结果
2.1 格尔琼醇提物组及其不同极性部位组的药效学实验
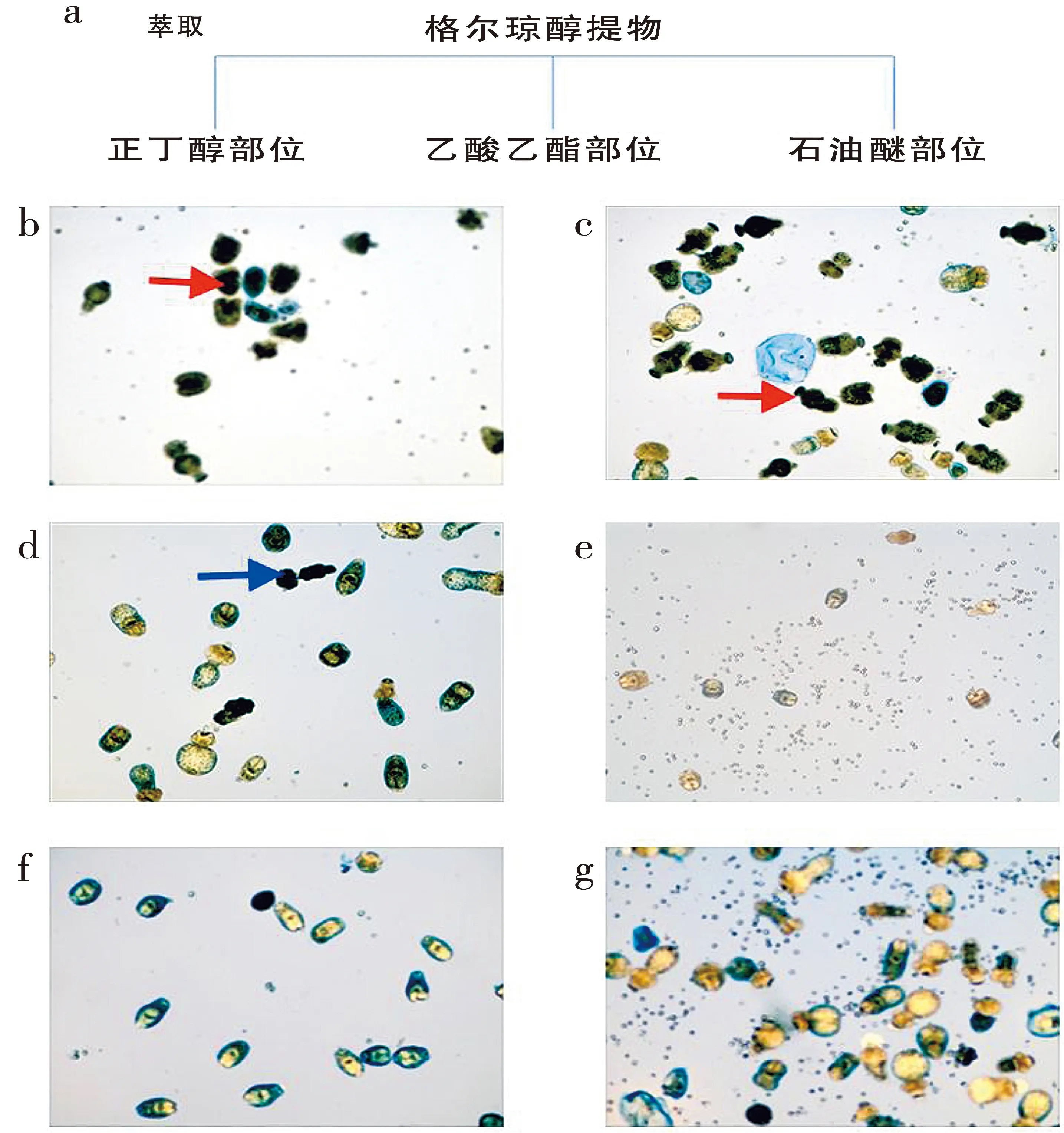
a:格尔琼醇提部位萃取图,b:格尔琼醇提组,c:乙酸乙酯部位组,d:阿苯达唑组,e:空白组,f:正丁醇部位组,g:石油醚部位组.
图中表示死亡原头节图中表示结构遭到破坏的原头节
图1 格尔琼醇提部位分离纯化步骤图及阿苯达唑组原头节、格尔琼醇提物组、醇提物的不同极性部位组结构图
Figure 1 Structure of protoscolextreated with albendazole,ethanol extraction and different polar partsof ethanol extraction
将格尔琼醇提物水溶后依次用相同体积的石油醚、乙酸乙酯、正丁醇极性萃取得石油醚部位、乙酸乙酯部位及正丁醇部位三个部位(图1a)。将10%体积的原头节分别与200 mg/mL格尔琼醇提物、20 mg/mL乙酸乙酯部位、20 mg/mL石油醚部位、20 mg/mL正丁醇部位及阿苯达唑(2μg/mL)共培养144 h。原头节溶液与0.4%台盼蓝溶液混合(9:1体积)染色,光镜下观察发现格尔琼醇提物组、乙酸乙酯部位组原头节多数被台盼蓝深染,深染原头节轮廓清晰,结构完整(图1b~c),阿苯达唑组原头节少数被台盼蓝深染(图1d)。格尔琼正丁醇部位组原头节、石油醚部位组原头节与空白组原头节结构无明显差异(图1e~f)。
培养后原头节台盼蓝染色,光镜下计数,空白组原头节死亡率为13.67±0.58,格尔琼醇提物组为93.67±1.53(P<0.0000 V.S.Con组)、乙酸乙酯部位组为93.67±0.58(P<0.0000 V.S.Con组)、阿苯达唑组为47.67±2.08(P<0.0000 V.S.Con组)、格尔琼石油醚部位组为13.67±2.52(P=0.7149V.S.Con组)、格尔琼正丁醇部位组为15.67±2.31(P=0.4512 V.S.Con组)(图2)。
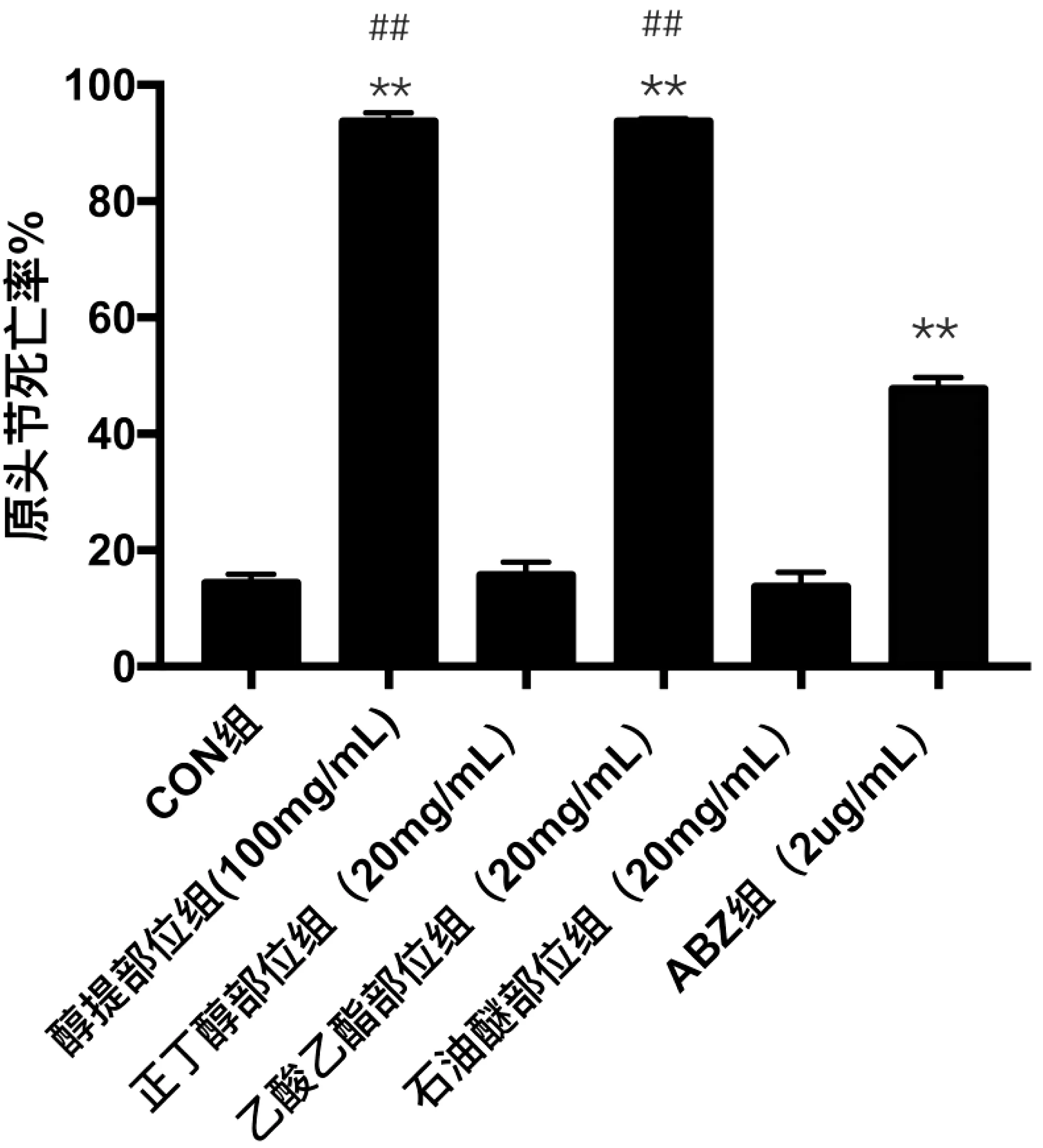
**:与空白组相比P<0.01,##:与阿苯达唑组相比P<0.01.
图2 阿苯达唑组、格尔琼醇提组及其不同极性部位组原头节死亡率图
Figure 2 Themortality rate of protoscolex treated with albendazole,ethanol extraction and different polar partsofethanol extraction
2.2 Fraction1-5的药效学实验
将乙酸乙酯部位经硅胶柱层析分离纯化后获得Fraction1-5(图3a),将10%体积的原头节分别与1 mg/mL Fraction1-5共培养144 h后用台盼蓝染色,光镜下观察发现Fraction3组原头节多数被台盼蓝深染,与格尔琼醇提物组原头节死亡后形态相似(图3d)。而其余部位组原头节形态与空白对照组原头节形态无明显差异(图3b、c、e、f)。
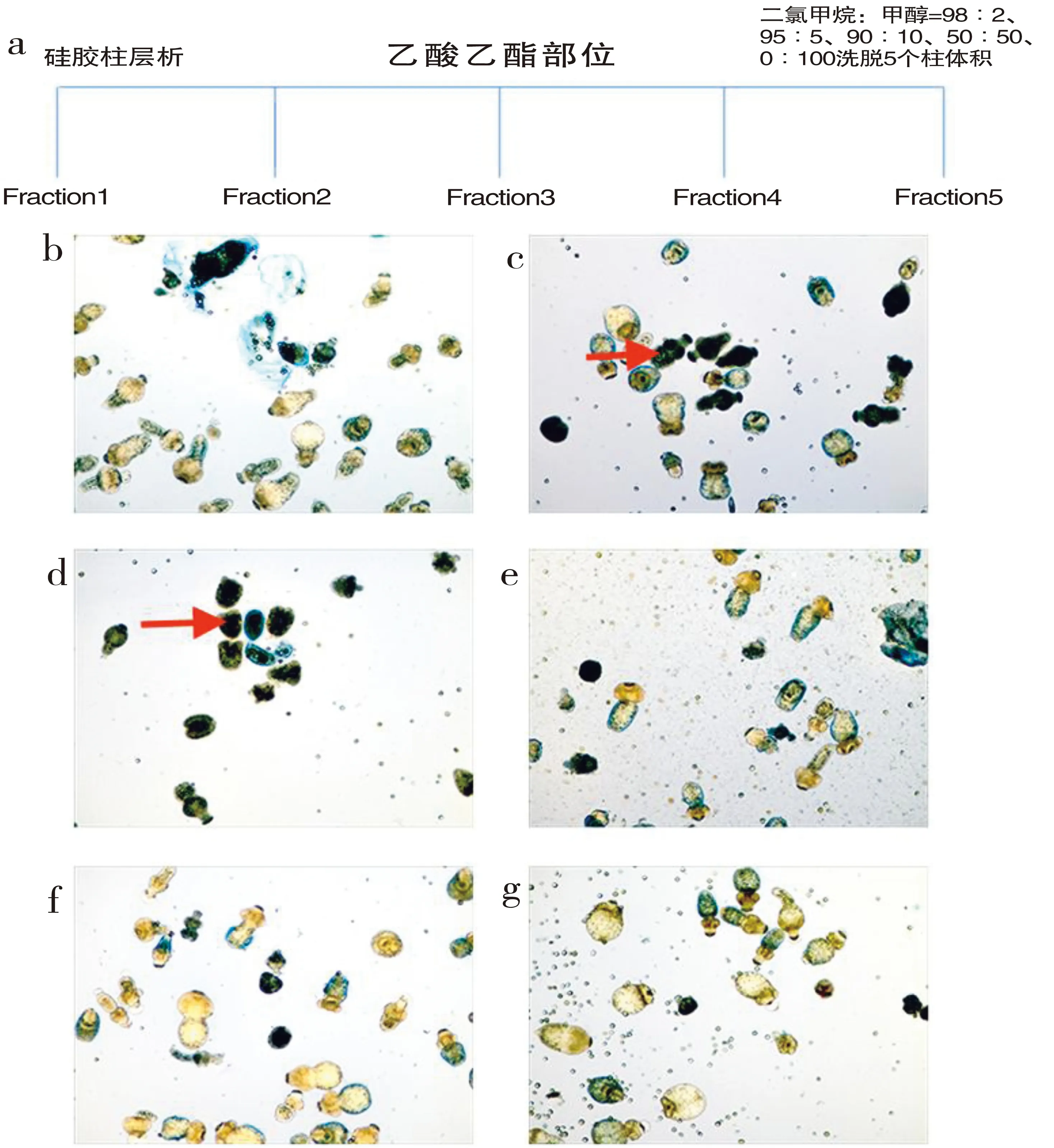
a:乙酸乙酯部位硅胶柱层析图,b:Fraction 1组,c:Fraction 2组,d:Fraction 3组,e:Fraction 4组,f:Fraction5组,g:control组.
图中代表死亡原头节
图3 Fraction1-5部位组原头节结构图
Figure 3 Structure of protoscolex treated withFraction1-5
将培养后原头节用台盼蓝染色,光镜下计数,空白组原头节死亡率为18.33±1.53,Fraction 3组为97.33±1.53(P=0.0001V.S.Con组),Fraction2组为35.33±1.53(P=0.0002 V.S.Con组),Fraction4组为26.67±5.13(P=0.0543 V.S.Con组),Fraction5组为26.00±2.65(P=0.0122 V.S.Con组);Fraction1组为18.33±1.53(P>0.999 V.S.Con组)(图4)。
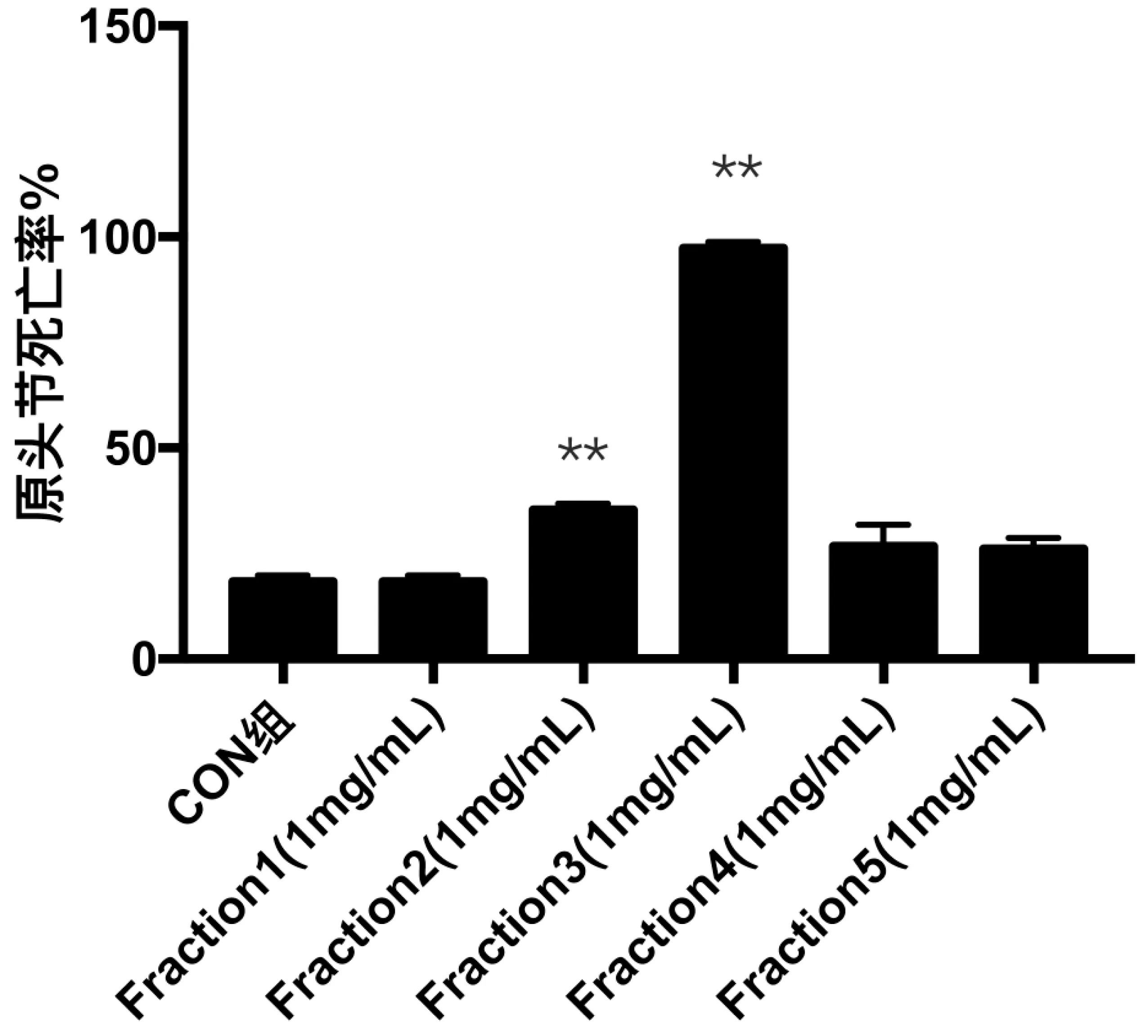
**:与空白组相比P<0.01.
图4 Fraction1-5部位组原头节死亡率图
Figure 4 Mortality rate of protoscolex treated with Fraction1-5
2.3 Fraction 3.1-8的药效学实验
将Fraction3进行凝胶柱层析分离纯化,并利用硅胶薄层色谱指导合并相同组分,得到Fraction3.1-8(图5a)。将10%体积的原头节分别与200 μg/mL Fraction3.1-8共培养144 h,用台盼蓝染色,光镜下观察发现Fraction3.1组原头节多数被台盼蓝深染,形态与格尔琼醇提物组原头节死亡后形态相似(图5b)。而其余部位组原头节形态与空白组原头节形态无明显差异(图5 c~h)。
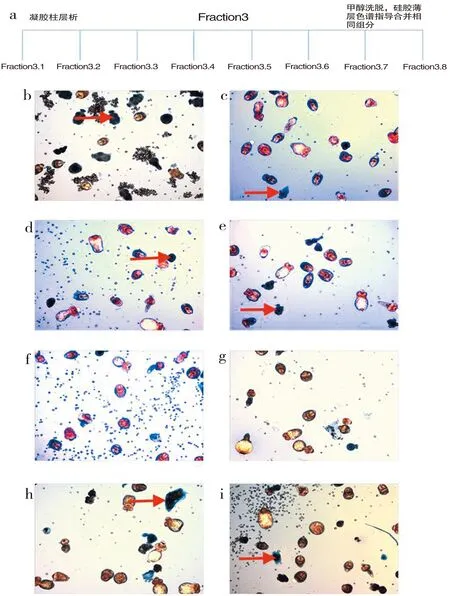
a:Fraction3部位凝胶柱层析图,b:Fraction3.1组,c:Fraction3.2组,d:Fraction3.3组,e:Fraction3.4组, f:Fraction3.5组,g:Fraction3.6组,h:Fraction3.7组,i:Fraction3.8组.
图中代表死亡原头节
图5 Fraction3.1-8组原头节结构图
Figure 5 Structure of protoscolex treated with Fraction3.1-8
培养后原头节台盼蓝染色,光镜下计数,空白组原头节死亡率为19.33±0.58,Fraction3.1组为83.00±4.589(P=0.0001V.S.Con组),Fraction3.3组为32.00±7.00(P=0.0354 V.S.Con组),Fraction3.4组为30.33±2.89(P=0.0029 V.S.Con组),Fraction3.5组为52.00±5.20(P=0.0004 V.S.Con组),Fraction3.2组为22.33±4.04(P=0.2720 V.S.Con组),Fraction3.6组为26.33±0.58(P=0.0001 V.S.Con组),Fraction3.7组为28.00±5.00(P=0.0406V.S.Con组),Fraction3.8组为23.67±2.89(P=0.0122V.S.Con组)(图6)。
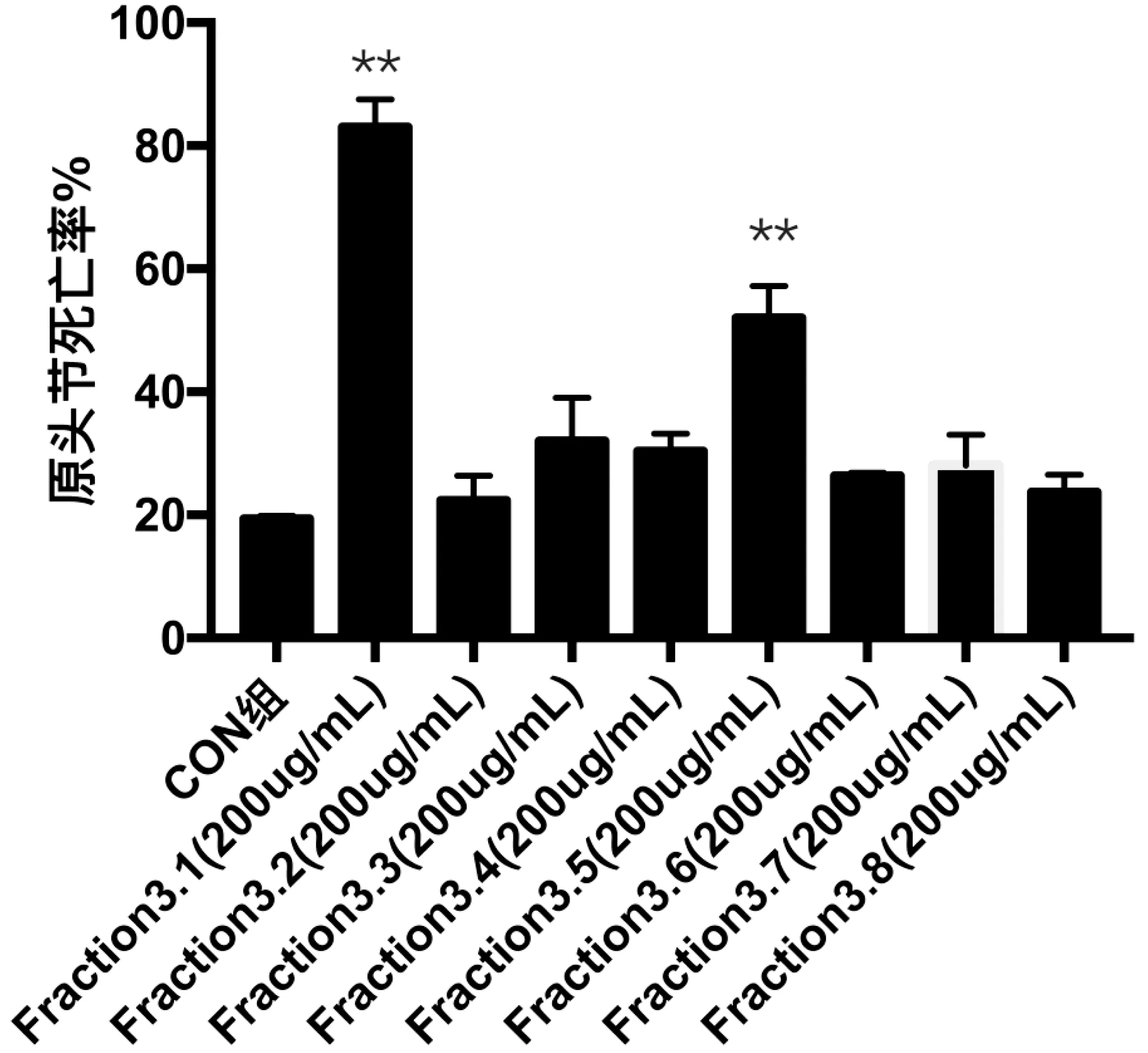
**:与空白组相比P<0.01.
图6 Fraction3.1-8组原头节死亡率图
Figure 6 Mortality rate of protoscolex treated with Fraction3.1-8
2.4 Fraction3.1.1-7的药效学实验
将Fraction3.1利用制备液相的方法进行分离,获得Fraction3.1.1-7(图7a),将10%体积的原头节分别与Fraction3.1.1-7共培养144 h,台盼蓝染色,光镜下观察发现Fraction3.1.2组原头节多数被台盼蓝深染,形态与格尔琼醇提物组原头节形态相似(图7c)。而其余部位组原头节形态与空白组原头节形态无明显差异(图7b、d、e、f、g、h)。
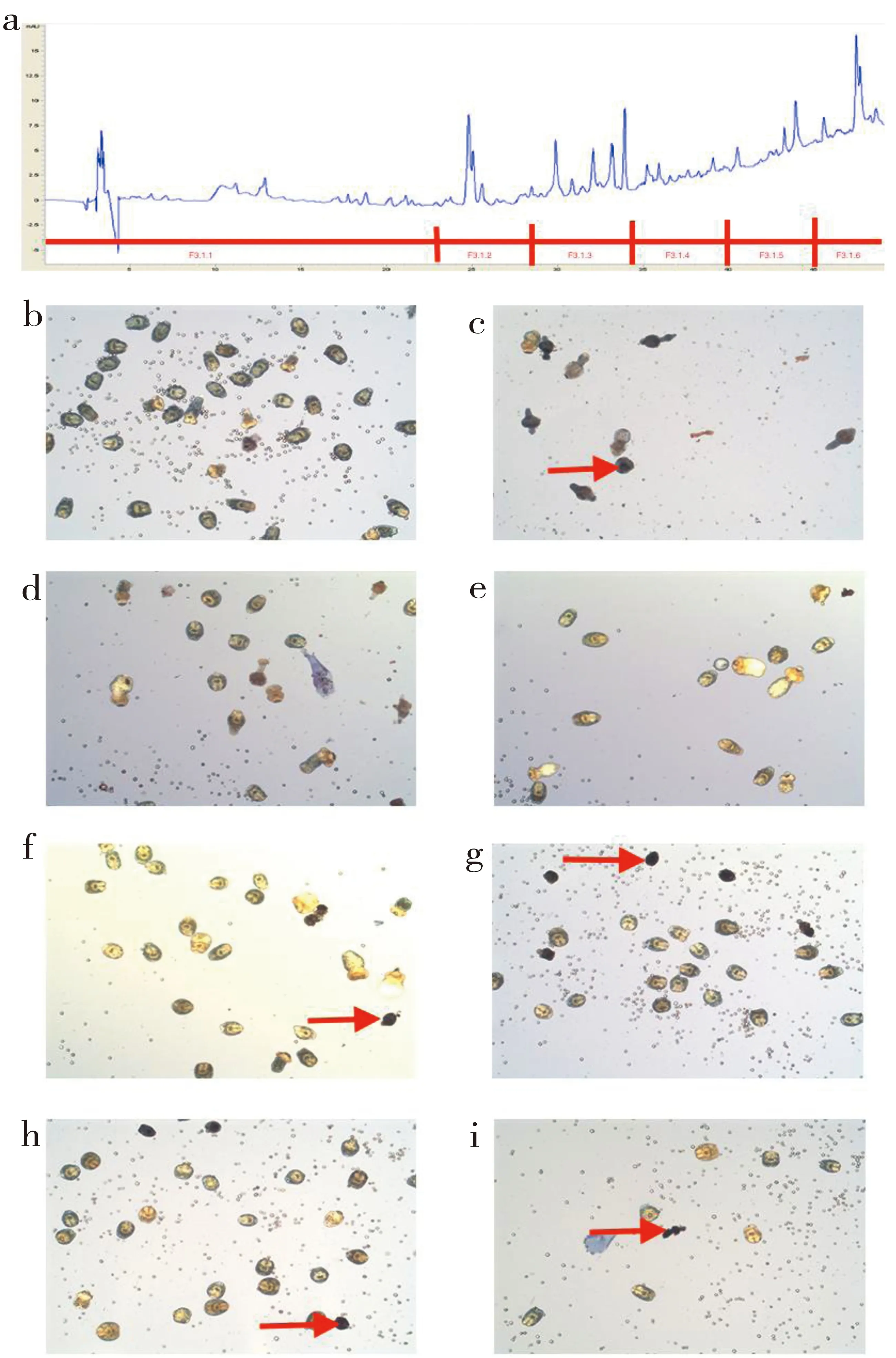
a:制备液相图,b:Fraction3.1.1组,c:Fraction3.1.2组,d:Fraction3.1.3组,e:Fraction3.1.4组,f:Fraction3.1.5组, g:Fraction3.1.6组,h:Fraction3.1.7组,i:control组.
图中表示死亡原头节
图7 Fraction3.1.1-7部位药物实验原头节结构图
Figure 7 Structure of protoscolex treated with Fraction3.1.1-7
培养后原头节台盼蓝染色,光镜下计数,空白组原头节死亡率为14.67±1.15,Fraction3.1.2组为83.33±3.05(P<0.0001V.S.Con组),Fraction3.1.3组为24.67±1.15(P=0.0004V.S.Con组),Fraction3.1.5组为25.33±1.15(P=0.0003V.S.Con组),Fraction3.1.6组为27.33±1.53(P=0.0003V.S.Con组),Fraction3.1.1组为17.33±1.53(P=0.0734V.S.Con组),Fraction3.1.4组为19.00±3.46(P=0.1090V.S.Con组),Fraction3.1.7组为15.33±1.15(P=0.5185V.S.Con组)(图8)。
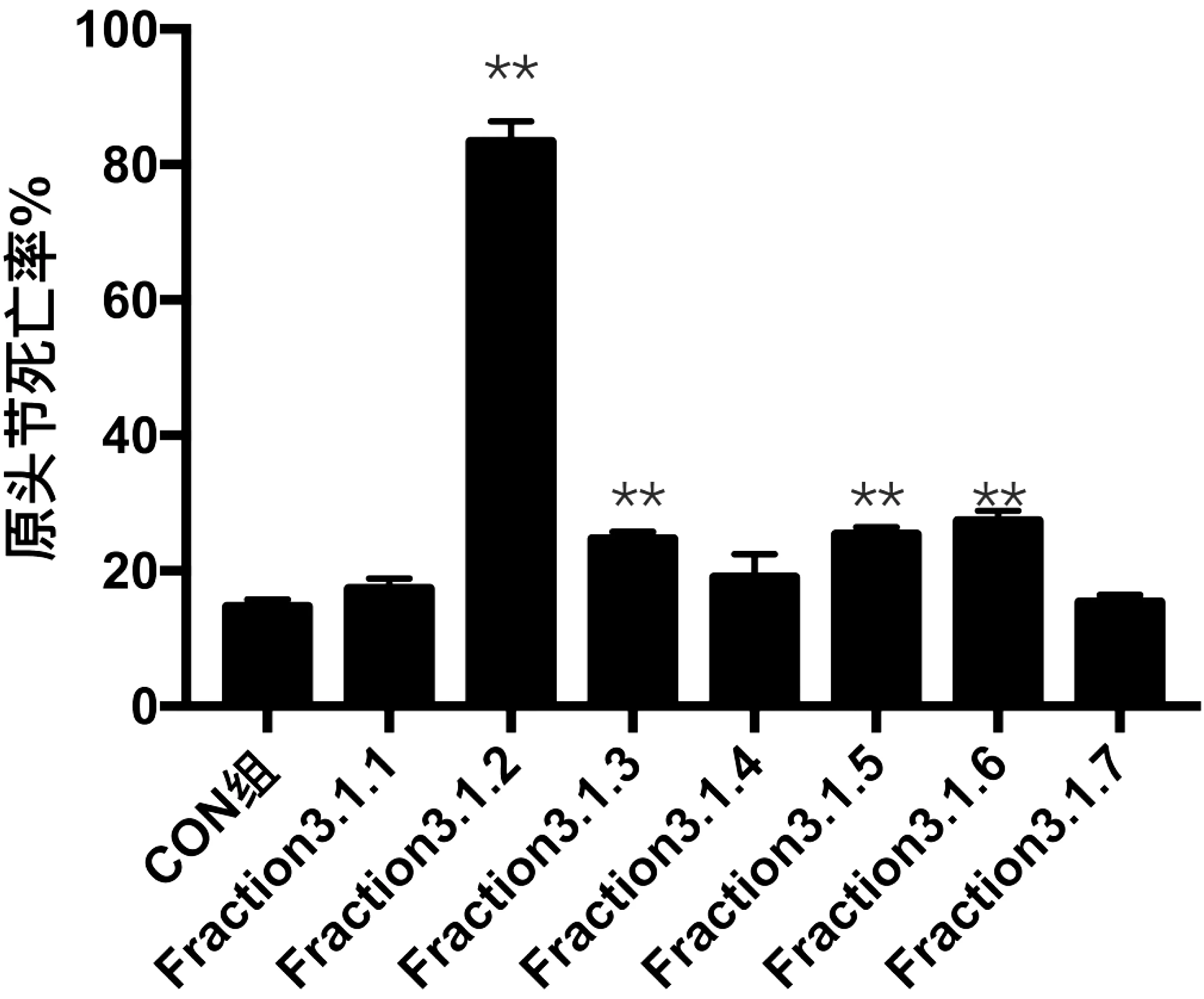
**:与空白组相比P<0.01.
图8 Fraction3.1.1-7部位药物实验原头节死亡率图
Figure 8 Mortality rate of protoscolex treated with Fraction3.1.1-7
3 讨论
体外培养模型是研究寄生虫与宿主之间相互作用机制必不可少的工具,为评估抗棘球蚴药物提供了实验材料[7]。体内泡球蚴生长分化受宿主-寄生虫之间相互作用等因素影响,不易进行实验研究,体外模型为分析和探讨药物对寄生虫的影响提供了可能,对寻找新的治疗棘球蚴病药物提供了方法和途径[8-12]。此外,体外培养比动物实验安全而且实验周期短[13]。本实验以体外培养的泡球蚴为材料进行体外药物活性部位筛选实验。实验中各组原头节死亡率间存在差异,可能的原因是:1.药物分离纯化过程中必定造成成分丢失,同时可能存在不同成分间的协同作用;2.不同实验组间药物成分不同,其中含有有效成分浓度可能不同,未达到杀灭原头节的最适浓度;3.不同实验组间原头节活性存在差异,本次实验原头节来源均为接种于沙鼠腹腔内的原头节,宿主间体质及免疫状态等内环境的不同均可能对原头节活性造成影响。
有研究证明[14],术前加用藏药占皎达色能够减少包虫病术后并发症,缓解临床症状,提高治愈率。陈钦铭[15]等证明,紫堇的提取液作用于细粒棘球蚴后可使棘球蚴生长发育受阻。康金风[16]等证明,骆驼蓬籽提取液可以明显抑制体内棘球蚴和泡球蚴的生长,包根书[17]等研究显示,砂生槐提取物有抑制小鼠体内棘球蚴生长的作用。格尔琼是藏医典《金珠本草》中记载的抗包虫药物,其中含有麝香、红花、丁香、牛黄、唐古特乌头、犀角、朱砂、紫檀香、大托叶云实、木香、诃子、毛诃子、余甘子、黑草乌、藏菖蒲等名贵中草药。丁香对流感病毒及痢疾杆菌有明显的抑制作用,同时丁香具有较强的杀虫作用[18]。麝香具有强氧化性,对各种细菌的生长具有明显的抑制作用,也能促进免疫器官胸腺和脾脏的发育,增强细胞免疫和体液免疫,促进肝脏中SOD的活性的作用[19]。红花能够提高小鼠的非特异性免疫和细胞免疫功能,增强单核细胞吞噬功能[20],同时具有保肝的生物活性[21]。牛黄有很好的保肝利胆的作用[22]。唐古特乌头藏医临床上主要用于黄疸型肝炎的治疗[23]。同时,诃子、毛诃子、余甘子、黑草乌均具有保肝、利胆的功效,犀角有解毒的功效。
藏医临床发现格尔琼具有较好的治疗棘球蚴病的药效学作用。本研究证实了藏药格尔琼体外杀伤多房棘球蚴药效作用并对其活性部位进行分离纯化,初步确定了格尔琼活性部位。
回流提取法所得到的提取液常为混合物,需进一步分离精制,因而在确定格尔琼醇提物对原头节有杀伤作用后,又进一步采用溶剂萃取法分离此部位。本实验采用石油醚、乙酸乙酯、正丁醇三部位分离法进行了部位分离,使其中化合物被分离成脂溶性成分、亲脂性单糖苷类和大分子苷元,以及多数苷类和有机酸等。对各提取部位药效学研究发现,乙酸乙酯部位化合物对体外原头节具有较强的杀伤作用,且其杀伤后原头节结构与格尔琼醇提物杀伤后原头节结构相似,对该部位进一步根据极性利用硅胶柱层析进行了分离,对各提取部位药效学研究发现,中等极性部位化合物对体外原头节具有较强的杀伤作用,进一步对该部位化合物根据分子量大小不同利用凝胶层析进行了分离,对各提取部位药效学研究发现,分子量大的化合物对体外原头节具有较强的杀伤作用,提示格尔琼中对体外原头节具有杀伤作用的化合物可能是大分子,属中等极性化合物。
格尔琼与阿苯达唑作用后的体外原头节结构改变不同,格尔琼作用后的原头节死亡后保存有完整的结构,而阿苯达唑作用后的原头节多皱缩,这提示两者对原头节杀伤作用的机制可能不同。目前的研究结果只能说明本实验条件下组分与阿苯达唑在体外对原头节均有杀伤作用,但其活性物质的具体成分,是否存在不同部位的协同作用及其作用机制仍待进一步阐明。
[1]Kawamura N,Kamiyama T,Sato N,et al.Long-term results of hepatectomy for patients with alveolar echinococcosis:a single-center experience[J].Journal of the American College of Surgeons,2011,212(5):804-812.
[2]Chai J,Jiao W,Sun D,et al.Clinical efficacy of albendazole emulsion in treatment of 212 cases of liver cystic hydatidosis[J].Chinese medical journal,2002,115(12):1809-1813.
[3]万陈飞.低氧条件下阿苯达唑药代动力学的研究[D].青海大学,2016.
[4]李静,王集会,潘少斌,等.忍冬(Lonicera japonic Thunb.)果实抑菌活性及化学成分研究[J].四川农业大学学报,2016,34(1):85-90.
[5]于春洋,商少华,张瑞妮,等.3种助溶剂对阿苯达唑和阿苯达唑亚砜体外抗包虫活性的影响[J].中国病原生物学杂志,2013,8(7):620-623.
[6]包永星,毛睿,齐洪志,等.X线照射泡球蚴原头节的体外实验研究[J].中国寄生虫学与寄生虫病杂志,2011,29(3):208-211.
[7]Zhang Y L,Wang T T,Zhou X T,et al.In vitro cultivation of Echinococcus multilocularis metacestodes and observation of their growth[J].Zhongguo ji sheng chong xue yu ji sheng chong bing za zhi=Chinese journal of parasitology & parasitic diseases,2007,25(2):93-96.
[8]Jura H,Bader A,Frosch M.In Vitro Activities of Benzimidazoles against Echinococcus multilocularis Metacestodes[J].Antimicrobial agents and chemotherapy,1998,42(5):1052-1056.
[9]Ingold K,Bigler P,Thormann W,et al.Efficacies of albendazole sulfoxide and albendazole sulfone against in vitro-cultivated Echinococcus multilocularis metacestodes[J].Antimicrobial Agents and Chemotherapy,1999,43(5):1052-1061.
[10]Reuter S,Merkle M,Brehm K,et al.Effect of amphotericin B on larval growth of Echinococcus multilocularis[J].Antimicrobial agents and chemotherapy,2003,47(2):620-625.
[11]Reuter S,Buck A,Grebe O,et al.Salvage treatment with amphotericin B in progressive human alveolar echinococcosis[J].Antimicrobial agents and chemotherapy,2003,47(11):3586-3591.
[12]Jura H,Bader A,Hartmann M,et al.Hepatic tissue culture model for study of host-parasite interactions in alveolar echinococcosis[J].Infection and immunity,1996,64(9):3484-3490.
[13]万玛侃卓,李先加.术前加用藏药占皎达色配合治疗肝包虫病,中国民族医药杂志,2001,1,19.
[14]李琼毅,陈根,包根书,等.泡球蚴组织的体外培养及在药物筛选中的应用[J].中国病原生物学杂志,2006,1(4):263-265.
[15]陈钦铭,叶于聪,许子俊,等.藏药紫堇对细粒棘球蚴作用的扫描电子显微镜观察[J].青海医药杂志,1985,75(2):1-3.
[16]康金风,杨文光.骆驼蓬籽治疗小鼠腹腔棘球蚴和泡球蚴的效果[J].新疆医学院学报,1993,16(3):178-181.
[17]包根书,史大中,马兴铭.砂生槐生物碱抗小鼠细粒棘球蚴作用的初步观察[J].中国寄生虫学与寄生虫病杂志,2005,23(6):471-472.
[18]郭梅珍.试探丁香与郁金的合用及单用[J].中医学报,2013,28(3):394-395.
[19]陈玉山,赵伟刚.麝鼠香抗衰老活性的研究[J].特产研究,2005,27(2):5-7.
[20]王晓菲,金鸣.红花抗炎作用机制研究进展[J].山西医药杂志,2007,36(1):51-53.
[21]扈晓佳,殷莎,袁婷婷,等.红花的化学成分及其药理活性研究进展[J].药学实践杂志,2013,31(3):161-168.
[22]薛小平,李东华,刘铮,等.活血化瘀中药对清热利胆中药利胆作用的增效研究[J].天津中医药,2006,23(1):70-72.
[23]张义智,常建晖,邵成雷,等.唐古特乌头研究进展[J].中国民族医药杂志,2012,18(1):70-73.
Study on the Pharmacodynamics and Active Site of Geerqiong killing Protoscolexin in vitro
LIU Wen-lei1,3,JIANG Qiao-yan2,LUOSANG Da-wa1,3,YANG Bao-liang1,3, FAN Hai-ning1,3,DENG Yong1,3*,TANG Feng2**
(1.Department of Hepatopancreatobiliary Surgery,Affiliated Hospital of Qinghai University,Qinghai,Xining 810001; 2.Research Center for High Altitude Medical Sciences,Qinghai University,Qinghai,Xining 810001; 3.Key Lab. for hydatid diseases of Qinghai Province,Xining,Qinghai 810001)
Objective To elucidate the pharmacodynamics and active site of Tibetan medicinal herbGeerqiong on the effect of killing protoscolexin vitro.Methods Twenty-six compounds were isolated and purified by alcohol extraction,gel column chromatography,silica gel column chromatography and preparative liquid phase.The protoscolex was treated with different concentrations of compounds in vitro.Observe the mortality and structural changes of the protoscolex under light microscope.Result The mortality rate of protoscolex in control group was 13.67±0.577 and ethanol extract group was 93.67±1.523(P<0.0000),ABZ group was 47.67±2.08(P<0.0000),respectively.The structure changes of protoscolex treated with ABZ and ethanol extract was significantly different.Three parts were obtained from the extraction of alcohol extract which named ethyl acetate part,n-butanol part and petroleum etherpart.We found that the mortality rate of protoscolex treated with ethyl acetate part was 93.67±0.577(P<0.0000).Fraction1,Fraction2,Fraction3,Fraction4,Fraction5 were obtained from the ethyl acetate site with gel column chromatography.The pharmaceutic active experiment found that the mortality rate of protoscolex treated with Fraction3 was 97.33±1.528(P<0.0000).(4)Fraction3.1,Fraction3.2,Fraction3.3,Fraction3.4,Fraction3.5,Fraction3.6,Fraction3.7,Fraction3.8 were obtained from Fraction3 with Silica gel column chromatography.The pharmaceutic active experiment found that the mortality rate of protoscolex treated with Fraction3.1 was 83.00±4.583(P<0.0000).(5)Fraction3.1.1,Fraction3.1.2,Fraction3.1.3,Fraction3.1.4,Fraction3.1.5,Fraction3.1.6,Fraction3.1.7 were obtained from Fraction3.1 with S liquid phase.The pharmaceutic active experiment found that the mortality rate of protoscolex treated with Fraction3.1 was 83.33±3.06(P<0.000).Conclusion Geerqiong has a stronger effect on protoscolex compared with albendazole in vitroand its active site is macro-molecular non-polar compound.
Tibetan medicinein In vitro Echinococcosis Multilocularis Pharmacodynamics active fraction
*:通信作者,主任医师、硕士生导师,E-mial:dengyong@medmail.com.cn;**:通信作者,博士,E-mial:leileitang1984@163.com 刘文磊(1988~),男,汉族,山东籍,青海大学附属医院肝胆胰二科在读研究生
R917
A
10.13452/j.cnki.jqmc.2017.01.011
2017-02-19
※:青海省重大科技专项(2016-SF-A5).

