1%La掺杂膨润土/纳米TiO2材料处理氰化贫液性能研究
曹 旭,王青龙,张亚莉,赵景刚,王晓亮,杨宝书,宫本奎,赵萍萍
(1.山东河西黄金集团有限公司,山东 招远 265402;2.山东理工大学 化学与工程学院,山东 淄博 255049)
1%La掺杂膨润土/纳米TiO2材料处理氰化贫液性能研究
曹 旭1,王青龙2,张亚莉2,赵景刚1,王晓亮1,杨宝书1,宫本奎2,赵萍萍2
(1.山东河西黄金集团有限公司,山东 招远 265402;2.山东理工大学 化学与工程学院,山东 淄博 255049)
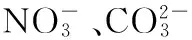
膨润土/纳米TiO2;氰化物;废水;光催化;吸附
用氰化物浸出金既经济又有效,但氰化物有剧毒。氰化浸金后产生大量废液,每处理1 t金精矿要外排4 m3左右的氰化废水,其中氰化物质量浓度在10~100 mg/L之间,有的甚至更高,而且还含有铜、锌、铁等重金属离子,重金属离子与氰化物形成重金属配合物成为有害污染物[1]。含重金属离子的氰化废水严重超出工业废水中氰化物排放标准(Ⅰ、Ⅱ级为0.5 mg/L,Ⅲ级为1 mg/L),对环境、特别是水体易造成安全隐患。
含氰废水处理方法有多种,主要分为净化法和再生法两大类。净化法是采用相关的化学试剂破坏氰化废水中的含氰络离子,降低氰含量,常用的主要有碱氯氧化法、SO2-空气氧化法、臭氧法、电解氧化法、微生物氧化法等[2-5]。再生法是将氰化物回收再利用及回收有价金属,主要有酸化法、离子交换法、吸附法、溶剂萃取法、膜分离法等[6-11]。但这些方法或多或少都存在一些问题,工业应用都受到限制。
用天然矿物对废水进行吸附处理在近年来得到广泛重视和研究,尤其是将硅藻土、沸石、膨润土等矿物精加工提纯后去除废水中的重金属离子和有机污染物的研究较多并取得了较多成果,有一些已用于各种废水的处理[12-14]。膨润土具有较大的比表面积和孔道结构,在水溶液中能吸附金属离子、有机化合物等,可以利用此性能处理废水,但应用中发现,有害物并没有得到有效去除,废水处理后产生的污泥还需处理,这限制了天然矿物在环境保护中的应用。自S.V.Frank等开拓性地将半导体材料用于光催化降解污染物取得突破性进展以来,光催化技术用于环境污染物的降解受到国内外学者的广泛关注[15-16]。在所研究的催化剂中,TiO2被认为效果最为理想。常用的TiO2光化学性能虽然较稳定,但其能带较大,需在紫外光下才能被激发,因此需要将其表面修饰或制成纳米材料。由于TiO2具有很强的亲水性,超细TiO2容易团聚,在处理废水时必须将其负载于一定的载体上才能使用。TiO2虽可负载于玻璃、陶瓷片、粉体上,但这样得到的产品限制了TiO2的作用面积和分散性[17-18]。TiO2也可负载于硅藻土、沸石、膨润土上,用于催化分解氨氮废水,但适用于黄金生产领域的富含重金属配合物的含氰废水的催化氰同时吸附重金属的材料尚未见报道。
试验研制了一种膨润土/TiO2材料,并对其加以改性后用于处理氰化贫液,以期为含氰废水的处理提供可供选择的新材料。
1 试验部分
1.1 试验原料
试验用膨润土取自于山东某工厂,为膨润土原土。氰化贫液pH=9,其组分见表1。

表1 氰化贫液主要物质组成 mg/L
1.2 试验方法
通过自然沉降法提纯膨润土。在电磁搅拌作用下,将膨润土与水以4∶1的比例混合,搅拌60 min后静置自然沉降24 h。取上层悬浊液在80 ℃下烘干,研磨使其通过200目筛后待用。
首先将20 mL钛酸丁酯、40 mL无水乙醇和1 mL浓硝酸依次加入到三口烧瓶中,剧烈搅拌30 min充分混合后得到混合物A;然后将一定量六水合硝酸镧溶于5 mL去离子水中,并加入0.5 mL浓硝酸,再将20 mL无水乙醇加入其中充分混匀,得到混合物B;将混合物B放入分液漏斗中,控制流量使其逐滴滴入到剧烈搅拌的混合物A中,滴加结束后,继续剧烈搅拌30 min,得到混合物C(溶胶-凝胶);然后,将5 g提纯后的膨润土加入混合物C中,剧烈搅拌60 min使形成悬浊液,最后将60 mL去离子水快速加入到上述悬浊液中,并剧烈搅拌5 h;将得到的液体倒入500 mL烧杯中,再在室温下陈化5 h后转入干燥箱中,在80 ℃下烘干,然后经粉碎研磨过200目筛,在不同温度下焙烧2 h,冷却至室温,备用。
室温下,将一定质量所制备的材料与氰化贫液混合后放入电磁振荡器上避光振荡,使其混合均匀;然后,对材料与废水组成的体系进行磁力搅拌,同时在其垂直上方保持150 W高压汞灯进行照射并不断向其中鼓入空气。
2 试验结果与讨论
2.1 催化吸附剂用量对氰化贫液处理效果的影响
分别将不同质量1%La-膨润土/TiO2催化吸附材料投加到含有150 mL氰化贫液中,在恒温振荡器上振荡3 h,之后移动到紫外光源下照射2 h,保持振荡并不断鼓入空气,最后取下,分别测定反应结束后溶液中氰、铜、锌质量浓度,计算氰分解率和铜、锌吸附率。试验结果如图1所示。
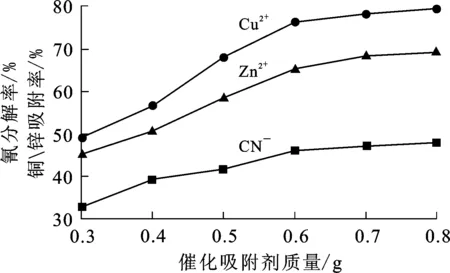
图1 催化吸附剂用量对氰分解率和铜、锌吸附率的影响
从图1看出:随催化吸附材料用量增加,氰分解率和铜、锌吸附率呈增大趋势;但催化吸附材料用量增加到0.6 g后,氰分解率增大幅度不大,约为61%,铜、锌吸附率增大幅度也不大。综合考虑,确定催化吸附材料最佳用量为0.6 g/150 mL,最佳液固体积质量比为1∶250。
2.2 催化吸附时间对氰化贫液处理效果的影响
将0.6 g复合催化吸附材料投加到150 mL氰化贫液中,在恒温振荡器上保持振荡3 h,然后放到紫外光源下照射,保持振荡并不断鼓入空气,每隔0.5 h取样1次,测定氰化贫液中氰、铜、锌质量浓度,计算氰分解率及铜、锌吸附率。试验结果如图2所示。
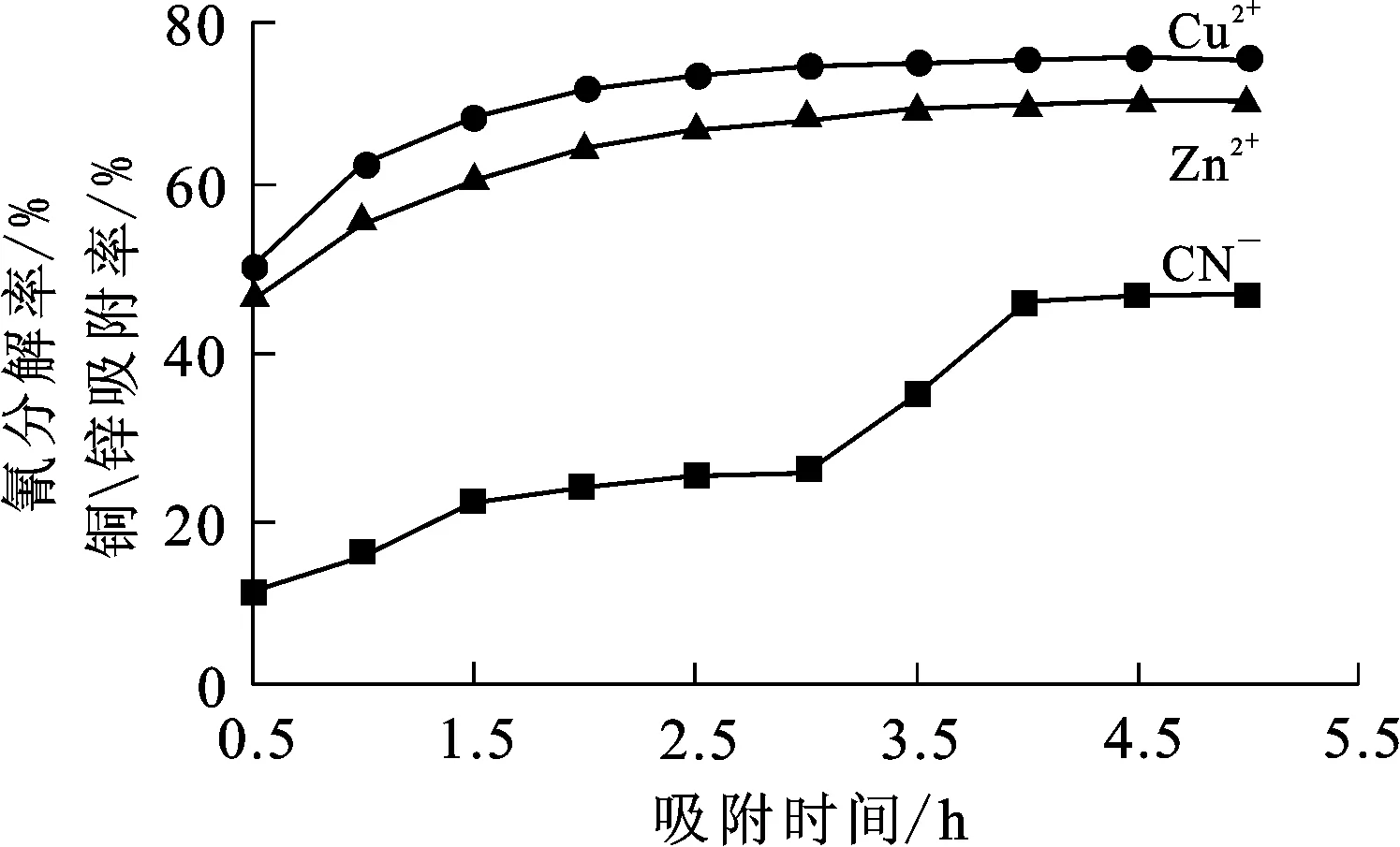
图2 催化吸附时间对氰分解率和铜、锌吸附率的影响
从图2看出:随催化吸附进行,铜、锌吸附量分别在2.5、3 h时达到稳定,吸附率分别为75.4%和70.3%;而氰分解率在催化吸附2 h后不再变化,因为氰此时没有高压汞灯照射,吸附只是在催化吸附材料表面进行;试验进行到3 h时,将体系移到高压汞灯下照射并不断鼓入空气,此时氰分解率明显升高;吸附4.5 h后,氰分解率几乎不再变化,约为61%。这说明紫外光源和不断鼓入的空气能够有效促进氰的分解,而铜、锌仅发生物理吸附并不受光源和空气氧化的影响,所以,先恒温振荡2 h,然后移到高压汞灯下照射2 h可以保证催化吸附材料对氰的有效分解及对铜、锌的有效吸附。
2.3 体系pH对氰化贫液处理效果的影响
取50 mL氰化贫液于100 mL锥形瓶中,调节其pH,于恒温振荡器上振荡60 min后,在不断鼓入空气和有紫外光源照射条件下再持续振荡6 h,然后分别测定氰化贫夜中氰、铜、锌质量浓度,计算铜、锌吸附率和氰分解率。试验结果如图3所示。
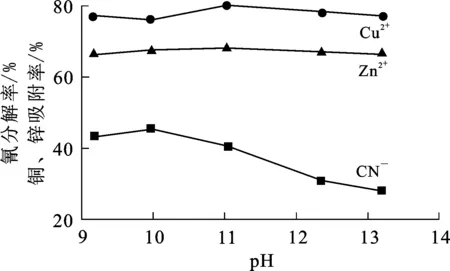
图3 体系pH对氰分解率和铜、锌吸附率的影响
从图3看出:体系pH在8~13范围内,铜吸附率先降低后升高,之后又降低,但总体变化不大,锌吸附率几乎没有变化,这说明在碱性条件下,体系pH对吸附材料吸附铜和锌影响不大;但随体系pH增大,氰分解率明显降低,这主要是因为碱性增强抑制了氰根离子电离,使氰化配合物不容易产生氰根离子,严重影响氰根分解,同时也说明光催化分解作用的对象主要是氰根离子而不是复杂的铜氰配合物或锌氰配合物。
2.4 温度对氰化贫液处理效果的影响
分别将一定质量催化吸附材料投加到一定量氰化贫液中,在不同温度下恒温振荡2 h,光催化吸附2 h。试验结果如图4所示。可以看出:温度从20 ℃升高到25 ℃时,铜吸附率明显升高,锌吸附率和氰分解率升高幅度不大;温度继续升高,氰分解率和铜、锌吸附率均无明显变化。鉴于温度过高会加速水分蒸发,增大氰的挥发,不安全,所以吸附温度保持在25 ℃即可。
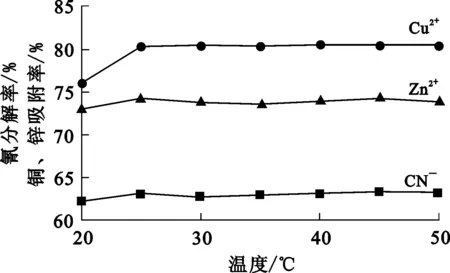
图4 温度对氰分解率和铜、锌吸附率的影响
3 改性膨润土/纳米TiO2对氰化贫液的光催化吸附机制
3.1 氰化贫液中氰、铜、锌的存在形式
溶液pH不同,氰、铜、锌在溶液中的存在形式也不同:pH小于5时,溶液中存在较多游离的金属离子,氰的主要存在形式是HCN分子;pH在5~7之间时,锌、铜主要以铜氰配合离子和锌氰配合离子形式存在,且存在少量HCN分子和游离CN-;pH大于7后,溶液中CN-增多,而HCN减少,直到pH达10左右,溶液中存在大量游离CN-,而在碱性环境中,铜、锌主要以配合物离子形式存在。氰化贫液pH=10时,溶液中各离子之间存在如下化学平衡:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
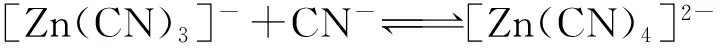
(8)
光催化过程其实是一个化学平衡移动的过程。氰化贫液中存在大量CN-,当大量游离CN-被催化分解时,平衡被打破,更多的氰被分解。
3.2 CN-催化分解机制
(9)
(10)
(11)
(12)
(13)
(14)
(15)
(16)
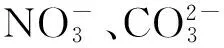
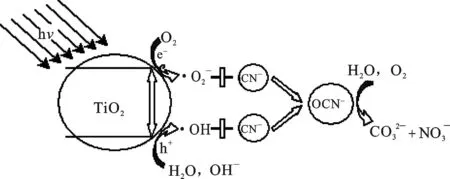
图5 1%La-膨润土/TiO2光催化降解氰机制
4 结论
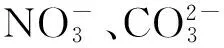
[1] 台明青,唐红雨,李祎,等.金矿废水和尾矿中氰化物的处理研究进展[J].中国资源综合利用,2007,25(2) :22-25.
[2] 陈光辉,张永胜,孙玉刚,等.树脂交换法处理氰化贫液试验研究[J].黄金科学技术,2011,19(2):74-77.
[3] SHI T H,WANG Z C,LIU Y,et al.Removal of hexavalent chromium from aqueous solutions by D301,D314 and D354 anion-exchange resins[J].Journal of Hazardous Materials,2009,161(2):900-906.
[4] 薛文平,薛福德,姜莉莉,等.含氰废水处理方法的进展与评述[J].黄金,2008,29(4):45-50.
[5] WHITE D M.Biological treatment of cyanide containing wastewater[J].Water Res,2000,34(7):2015-2019.
[6] XIE F,DREISINGER D.Recovery of copper cyanide from waste cyanide solution by LIX 7950[J].Minerals Engineering,2009,22(2):190-195.
[7] DAI X,BREUER P L,JEFFREY M I.Comparison of activated carbon and ion-exchange resins in recovering copper from cyanide leach solutions[J].Hydrometallurgy,2010,101(1):48-57.
[8] BOTZ M M,MUDDER T I,AKCIL A U.Cyanide treatment:physical,chemical and biological process[J].Developments in Mineral Processing,2005,15(6):672-702.
[9] HAN B B,SHENM Z S,WICKRAMASINGHE S R.Cyanide removal from industrial waster waters using gas membranes[J].Journal of Membrane Science,2005,257(1/2):171-181.
[10] DAI X,BREUER P L.Cyanide and copper cyanide recovery by activated carbon[J].Minerals Engineering,2009,22(5):469-476.
[11] MEENAKSHI S,VISWANATHAN N.Identification of selective ion-exchange resin for fluoride sorption[J].Journal of Colloid and Interface Science,2007,308(2):438 450.
[12] ZHANG H,YU X,CHEN L,et al.Investigation of radionuclide 63 Ni(Ⅱ) sorption on zsm-5 zeolite[J].Journal of Radio Analytical and Nuclear Chemistry,2010,286(1):249-258.
[13] 张亚莉,杨静,于先进,等.二氧化硅/二氧化钛催化吸附材料的制备及处理含氰废水研究[J].湿法冶金,2014,33(4):313-316.
[14] 张利华,周珉,瞿贤,等.活性污泥处理含氰废水毒性及降解机制研究[J].湿法冶金,2015,34(2):149-153.
[15] NIITSOO O,SARKAR S K,PEJOUX C,et al.Chemical bath deposited CdS/CdSe-sensitized porous TiO2solar cells[J].Journal of Photochemistry Photobiology A:Chemistry,2006,181(2):306-313.
[16] ROBEL I,KUNO M,KAMAT P V.Size-dependent electron injection from excited Cd-Se quantum dots into TiO2nanoparticles[J].Journal of American Chemical Society,2007,129(14):4136-4137.
[17] 陈士夫,赵梦月,陶跃武,等.玻璃纤维附载TiO2光催化降解有机磷农药[J].环境科学,1996,17(4):33-35.
[18] 颜秀茹,宋宽秀,霍明亮,等.TiO2/SiO2的制备及其光催化降解敌敌畏[J].应用化学,1999,16(4):94-96.
Study on Properties of 1%La Doped Bentonite/Nano TiO2in Treating Cyanide Waste Water
CAO Xu1,WANG Qinglong2,ZHANG Yali2,ZHAO Jinggang1,WANG Xiaoliang1,YANG Baoshu1,GONG Benkui2,ZHAO Pingping2
(1.ShandongHexiGoldCorporationLimitedCompany,Zhaoyuan265402,China;2.DepartmentofChemicalEngineering,ShandongUniversityofTechnology,Zibo255049,China)

bentonite/nano-TiO2;cyanide;waste water;photocatalysis;adsorption
2016-06-06
山东省自然科学基金资助项目(ZR2013EEM005)。
曹旭(1982-),男,山东招远人,本科,工程师,主要研究方向为矿山生产技术。
张亚莉(1974-),女,河北安国人,博士研究生,副教授,主要研究方向为稀贵金属冶金。
X703
A
1009-2617(2017)01-0061-04
10.13355/j.cnki.sfyj.2017.01.014

