上皮干细胞参与肿瘤恶变的机制
张诗惠胡 琼谢富安洪笑迁刘宽灿,
上皮干细胞参与肿瘤恶变的机制
张诗惠1胡 琼2谢富安3洪笑迁2刘宽灿2,3
上皮干细胞是一类具有自我更新能力和多向分化潜能的细胞,在维持上皮稳定中起到关键作用。随着研究不断深入,发现上皮干细胞可作为上皮肿瘤发生的起始细胞,上皮干细胞恶变不仅受干细胞微环境影响,它还与多条信号通路失调及基因突变相关。但上皮干细胞如何恶变为肿瘤的具体机制依旧不清楚。本文就上皮干细胞和肿瘤干细胞两者的联系以及上皮干细胞恶变为肿瘤的作用机制进行阐述。
上皮细胞; 肿瘤干细胞; 机制
上皮干细胞存在于肠[1]、乳腺[2]、前列腺[3]、食管[4]、皮肤[5]以及卵巢[6]等多个上皮组织中,这些干细胞是保持上皮稳态所必需,并贯穿整个生命进程。近年来,肿瘤干细胞作为肿瘤中具有干细胞特性的一类细胞,在肿瘤发生发展以及治疗抗性中发挥重要作用,并已成为研究热点。同时,作为与肿瘤干细胞特性相似的上皮干细胞,其与肿瘤干细胞的关系和在肿瘤发生中的作用不断被揭示。随着各种技术包括谱系示踪技术以及3D类器官培养[7]的应用,对上皮干细胞的研究越来越深入。
一、上皮干细胞与肿瘤干细胞
(一)正常干细胞与肿瘤干细胞特性
正常干细胞,是具有自我更新和多向分化能力的一类细胞,经不对称分裂可形成两个完全不同的子细胞,一个与干细胞性质相同,可继续自我更新;另一个子细胞经过一系列细胞分裂分化步骤以形成不同的分化细胞群[8]。干细胞分裂较慢,这有利于对特定的外界信号做出反应,决定细胞命运,同时可减少干细胞内基因突变的风险。在小鼠中发现,通过模拟生理应激以诱导造血干细胞静息状态改变,可导致DNA损伤[9]。
肿瘤干细胞是肿瘤细胞中的亚群,拥有干细胞属性,同样具有自我更新和分化能力[10]。目前,已从多个肿瘤中分离出具有干细胞属性的亚细胞群,这些细胞表达干细胞标志物,同时具有恶性侵袭迁移的能力。肿瘤干细胞不仅是肿瘤细胞的潜在来源,还是肿瘤恶变、复发和化放疗抗性的可能原因。
(二)上皮干细胞与肿瘤干细胞关系
多年来的研究证实正常干细胞和肿瘤干细胞之间具有较高的相似性,拥有一些共同特征:具有无限增殖、自我更新的能力;表达相似的分子标志物(表1);涉及多个相同的干细胞调节信号通路,如WNT、NOTCH等。此外,有证据表明干细胞拥有更易恶变的可能性。比如在肠上皮中,肠分化细胞一般4 ~ 5 d可脱落,但肠干细胞可长期存在,远远长于已分化后代,使突变发生可能性增加。自我更新能力可能是一个癌前病变因子,肿瘤内逐渐增多的细胞要求其必须具备自我更新能力的细胞,干细胞本身具备自我更新能力,因而正常上皮干细胞转换为肿瘤干细胞可能要比已分化的细胞转换更容易更快,而已分化细胞则可能需要特异的突变以获得相同的自我更新能力[5]。之前发现,皮肤癌中包含具有干细胞表型的一类细胞,这部分细胞的表型和功能与皮肤干细胞类似,具有高效的肿瘤起始能力,而且皮肤癌干细胞的维持依赖β-catenin信号[11]。
细胞不对称分裂缺陷与肿瘤形成密切相关,这可能也是正常干细胞转换为肿瘤干细胞的机制之一。细胞极性对干细胞分裂(对称或不对称)以及在干细胞粘附和静息状态维持的调控上具有特别重要的意义[31]。细胞极性蛋白(包括PAR、CRB、SCRIB复合物)功能活性或表达缺失,与肿瘤发生发展的晚期阶段密切相关,但是,这些蛋白在Hippo和LKB1-AMPK通路以及细胞增殖中同样具有关键作用,说明这些极性蛋白与肿瘤形成的早期阶段相关。如极性蛋白的失调能引起细胞分裂的定向错误和成人上皮干细胞自我更新能力的提高。一旦细胞极性遭到破坏,生长抑制信号可能对细胞无法发挥作用,甚至可能导致细胞逃避分化、衰老或凋亡[32]。在有丝分裂过程中,细胞极性机制也参与上皮干细胞定向分裂的控制,许多调控上皮细胞极性的基因也调节干细胞中的纺锤体定位和分裂对称性[33]。乳腺干细胞中的肿瘤抑制基因P53突变,可提高干细胞对称分裂频率,从而增加肿瘤发生的易感性,P53调节乳房干细胞分裂中的极性,并认为P53缺失会促进细胞的对称分裂,从而促进肿瘤起始[34]。因此,细胞极性蛋白表达或功能活性改变,可能促进干细胞的对称分裂和分化逃避,从而赋予该干细胞肿瘤特性。
二、上皮干细胞与肿瘤发生
上皮干细胞在维持各类上皮组织的组织稳态上起至关重要的作用。上皮干细胞异质性变化与上皮肿瘤发生发展紧密联系,上皮干细胞的增殖分化异常、功能性质改变等均会引发上皮异常,进一步起始上皮肿瘤的发生。上皮干细胞依赖的微环境、信号通路以及其他因素等对上皮干细胞的稳定具有重要调控作用。因此,一旦这些因素改变而导致上皮干细胞增殖失控,都可能促使上皮干细胞恶变为肿瘤的起始细胞,诱导肿瘤的发生(图1)。
(一)微环境与上皮干细胞恶变
干细胞静息、迁移、增殖和分化四种可能的细胞命运取决于微环境,即干细胞niche[31]。干细胞niche对干细胞的调控是一个复杂网络,干细胞需要来自niche的信号来调节自身细胞命运。在肠隐窝中,潘氏细胞可产生一系列支持肠干细胞的微环境信号,包括上皮生长因子(EGF),WNT3和NOTCH配体等[35]。不同的微环境可通过赋予干细胞不同的增殖能力和分子标志,从而影响干细胞行为[36]。微环境包括营养、免疫、炎症、细胞因子等,我们主要集中于营养和炎症对上皮干细胞恶变的关系分析。
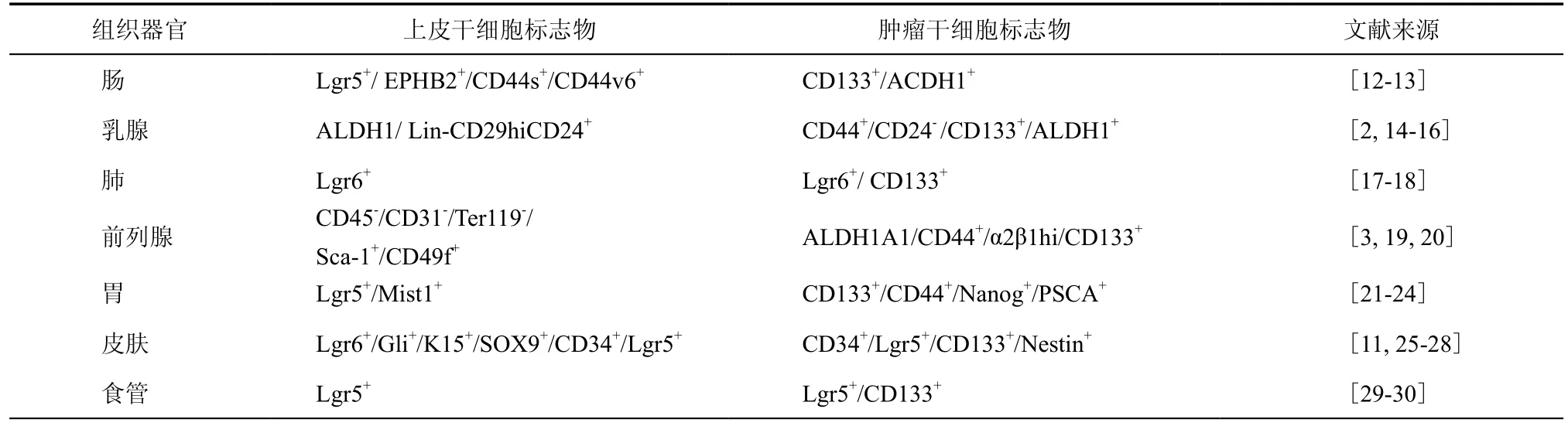
表1 上皮组织器官中上皮干细胞和肿瘤干细胞标志物
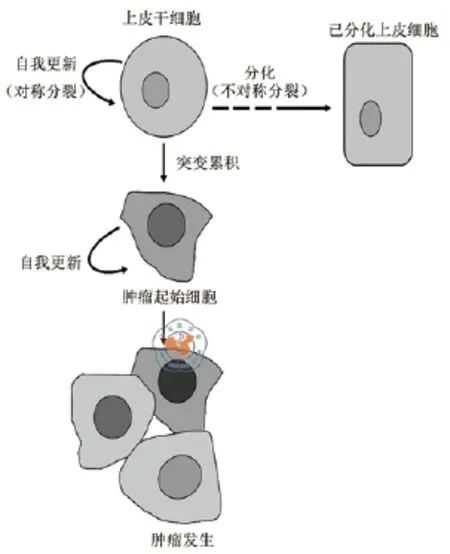
图1 上皮干细胞与肿瘤发生
1.干细胞微环境中的营养机制与肿瘤发生:干细胞niche的营养机制可调节肠干细胞池的大小和活性。研究表明,卡路里限制可活化肠干细胞niche中潘氏细胞mTOR复合体1(mechanistic target of rapamycin complex 1,mTORC1)的表达,mTORC1活化能够消除niche中的肠干细胞扩增能力,从而缩减Lgr5+干细胞池的大小[37]。高脂肪饮食引起的肥胖可扩大LGR5+肠干细胞的数量和功能,研究表明,高脂肪饮食可诱导肠干细胞和祖细胞表达过氧化物酶增殖活化受体PPAR-δ(peroxisome proliferator-actived receptor delta)信号,该信号活化可赋予祖细胞团的类器官起始能力。但在肿瘤抑制基因APC缺失的情况下,增强的PPAR-δ信号可促使这些祖细胞在体内形成肿瘤。进一步研究发现,高脂饮食并没有改变干细胞标志基因Lgr5的表达,而是诱发肠干细胞和祖细胞中一系列β-catenin靶基因如Bmp4、JAG1、JAG2和Edn3的表达,这些β-catenin靶基因常在肠肿瘤形成中失调,预示着外在因素比如高脂饮食可能通过促进干细胞分裂,增加癌症风险[38]。
2.炎症与上皮干细胞恶变:炎症与肿瘤发生密切相关,炎症可引起干细胞微环境改变,诱导上皮干细胞恶变。我们前期研究结果表明,Sox2过量表达的食管上皮干细胞能与炎症激活形成的磷酸化Stat3协同使干细胞恶变,导致鳞癌的发生[39]。伤口愈合过程中参与调控干细胞行为的信号通路(如WNT和Hedgehog)也参与肿瘤的形成。研究表明,肿瘤形成和伤口修复均依赖于上皮细胞、间充质细胞和骨髓来源细胞之间的相互联系。两者依赖的分子机制相似,然而组织损伤修复是一个自限过程,肿瘤形成则被认为是所参与信号通路的持续活化[40]。在组织损伤和感染中,JNK可通过AP-1活化刺激肠干细胞增殖,AP-1也可被EGF家族生长因子所活化。此外,JNK促进诱导Upd家族成员,该家族成员能够活化肠干细胞的JAK-STAT信号,JAK-STAT信号还可诱导生长因子表达,直接刺激肠干细胞的增殖[41]。促炎性细胞因子IL-6、IL-8在肿瘤微环境中大量存在,具有肿瘤起始、转移、血管形成,促进肿瘤生长和增殖的作用,IL-8可活化JAK/STAT3途径,该通路促进肿瘤起始和进程[42]。炎症性WNT信号能够活化肠干细胞增殖相关的下游分子,促进肠干细胞的增殖。Sonic hedgehog信号失调与基底细胞癌发展相关,在小鼠中,Hedgehog通路可被不同方法活化,包括Ptch1缺失,Gli1或Gli2过表达,或者Smo突变活化。当这些基因表达被扰乱后,可引起基底细胞癌样损伤形成[43-46]。
(二)干细胞中基因突变及信号通路异常与肿瘤发生
肠干细胞中的APC基因具有肿瘤抑制功能,APC缺失可改变Wnt信号转导并最终影响细胞增殖和极性[47]。研究表明APC基因突变可诱导癌症的发生,而在非干细胞中该突变却不起作用[48],说明干细胞中DNA突变,可能是肿瘤发生的起始事件。作为一个抗凋亡基因,Bcl-2特异性表达于肠干细胞中,在APC缺失时,可减缓上皮细胞凋亡,在肠转化中起关键作用[49]。此外,Mist1是胃体部静息干细胞的标志物,在Mist1+干细胞中,Kras和Apc双重突变或Notch活化可导致粘膜肠样异常增生,因此这些Mist1+干细胞可能是肠样癌症的细胞来源[21]。同样,在敲除小鼠胃Lgr5+干细胞中的Smad4和PTEN基因后,在胃窦发现微腺瘤及腺瘤可快速发展为侵袭性肠样胃癌。相反,已分化细胞中敲除Smad4和PTEN基因则不会起始肿瘤生长。因此,胃Lgr5+干细胞可通过基因突变起始癌症发生,并可能作为癌增殖细胞促进恶性进程[22]。
多个信号通路在上皮干细胞和肿瘤细胞自我更新中具有关键作用(图2)。WNT和TGF-β通路具有诱导和保持干细胞状态的作用,它们不仅是正常干细胞调节所必需,而且通常在肿瘤形成中发生失调[50]。阻断细胞增殖的重要通路能够促进前列腺基底干/祖细胞的分化,通过使用GSEA和IPA揭示了基底细胞中的重要信号通路,包括TGF-β、 NOTCH、WNT/TCF、IGF、FGF、STAT3/IL-6等。通过使用信号通路特异性抑制剂后,基底细胞对FGFR、IGF1R和STAT3信号通路的抑制剂具有高敏感性,这些通路具有调节基底干(祖)细胞活性的作用。FGFR3、NOTCH1和CTNNB1沉默也显著减少了基底细胞的克隆和球体形成,抑制了基底细胞增殖,并且分别提高了AR、KLK3和KRT18的mRNA水平,表明增殖信号的抑制可促进前列腺基底干/祖细胞的分化[51]。
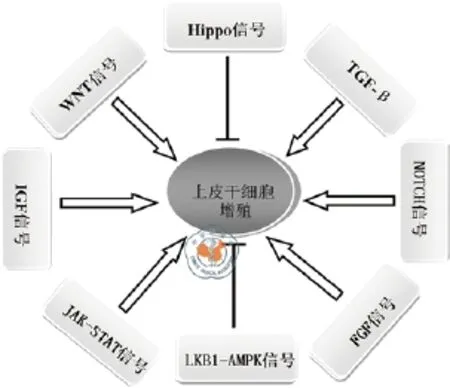
图2 参与上皮干细胞增殖的主要信号通路
此外,多个研究证实microRNA也参与干细胞的调控,它们通过对靶mRNA翻译抑制来调控干细胞的自我更新、细胞周期以及分化等多个功能。如miR-200c可调节干细胞因子Bmi1和Klf4,miR-200c的缺失或下调,导致CD44high/ CD24low干样细胞的增长[52]。△Np63a高表达于乳腺干细胞,它是不同上皮结构保持自我更新能力所必须的,miR203在小鼠乳腺腔上皮分化中被活化,而且可靶向调节△Np63a和△Np63b。异常表达miRNA203可抑制△Np63a表达,破坏上皮干细胞相关的活性,抑制增殖和克隆形成。因此,miR203可通过抑制△Np63a介导乳腺干细胞丧失自我更新能力,并可能通过调节EMT和肿瘤干细胞数量的减少使其具有抗肿瘤活性。而ZEB1可抑制miR203表达从而提高△Np63a的蛋白水平[53]。还有研究表明,miR-30a-5p对CD133+Huh7及CD133 ~ +MHCC97L肝癌干细胞的侵袭和迁移具有明显的抑制效果,有望成为靶向治疗肝癌的有效手段[54-55]。
三、讨论
肿瘤发生是个极其复杂的过程,涉及多个基因及信号通路改变,由内外多种因素共同促进其发生。干细胞在微环境改变、DNA损伤积累等作用下,其内部的基因突变引起增殖异常,最终导致肿瘤发生,但控制这些细胞干性的分子机制依尚不清楚。对非致瘤性的克隆培养后进行基因组范围的表达分析,发现EpCAM和CD44分别为上皮和间充质细胞的标志,有趣的是,这两种标志物在包括前列腺、胰腺和结肠的多个组织中被联合用于监测肿瘤干细胞,说明E/M(epithelial/mesenchymal)中间状态可能是肿瘤起始细胞更为普遍的存在状态,上皮和间充质的过渡在获得干细胞特性中起重要作用,干细胞可能保持在E/M中间状态[56-58]。研究发现,CD44+/MyD88+上皮卵巢癌干细胞产生的间充质细胞具有迁移和致瘤能力,在体内发生EMT形成具有转移能力的间充质球体形成细胞(MSFCS),MSFCS不仅能在小鼠的腹腔,还可在卵巢形成肿瘤,CD44+/MyD88+上皮卵巢癌干细胞可能通过产生MSFCS成为卵巢癌转移的来源。EMT能够诱导乳腺上皮细胞或者乳腺上皮癌细胞进入干样阶段,但是,上皮干细胞或上皮肿瘤干细胞是否能经历EMT尚不清楚[59]。
肿瘤干细胞显示了更高的迁移力、侵袭力和肿瘤形成能力以及更强的治疗抗性。在鳞状细胞癌中已发现上皮肿瘤干细胞亚群,能表达干细胞标志,而且与肿瘤细胞相比,这些肿瘤干细胞能够形成高度血管化和侵袭性的肿瘤[60],因此消除干细胞群体将是阻止肿瘤形成、复发的重要策略。携带缺氧诱导因子-1α-siRNA的叶酸靶向化的磁性纳米复合物,可通过抑制细胞内HIF-1α表达,进而降低cyclin D1表达水平影响细胞周期并抑制CD133+Hep3B肝癌干细胞的增殖[61]。在肿瘤治疗中,部分干细胞可依旧存活,而被忽略的这部分干细胞往往是导致肿瘤复发的关键,挖掘正常干细胞和肿瘤干细胞之间的不同标记物,将对肿瘤的治疗和预防复发具有重大意义。c-Myc是Wnt/Tcf4的靶基因,内源c-Myc在皮肤稳态和TPA诱导的增生中并非必不可少,该基因缺失的上皮可抑制RAS驱动的肿瘤形成,但是一旦在另外P21Cip1缺失(即c-Myc和P21Cip1双缺失)的情况下,它重新获得了DMBA/TPA诱导的肿瘤发生敏感性[62],因为c-Myc-P21Cip1和c-Myc-CDK4信号途径对皮肤的稳态并非必需的,因而这两个信号途径可作为治疗皮肤肿瘤的理想靶标。值得注意的是,c-Myc对肠隐窝祖细胞提供必要的生物合成能力是必须的[63]。表达于肠干细胞的抗凋亡基因Bcl-2,其过表达在肠转化中起到关键作用,但在组织平衡再生中却无足轻重,因此也可作为化疗和治疗的理想靶标[22]。发掘各类组织中上皮细胞或正常干细胞与肿瘤干细胞标记的区别,可为今后的治疗提供新的思路。
1 Barker N.Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration[J].Nat Rev Mol Cell Biol, 2014, 15(1):19-33.
2 Shackleton M, Vaillant F, Simpson KJ, et al.Generation of a functional mammary gland from a single stem cell[J].Nature, 2006, 439(772):84-88.
3 Lawson DA, Xin L, Lukacs RU, et al.Isolation and functional characterization of murine prostate stem cells[J].Proc Natl Acad Sci U S A, 2007, 104(1):181-186.
4 Deward AD, Cramer J, Lagasse E.Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population[J].Cell Rep, 2014, 9(2):701-711.
5 Phesse TJ, Clarke AR.Normal stem cells in cancer prone epithelial tissues[J].Br J Cancer, 2009, 100(2):221-227.
6 Ng A, Barker N.Ovary and fimbrial stem cells: biology, niche and cancer origins[J].Nat Rev Mol Cell Biol, 2015, 16(10):625-638.
7 Kessler M, Hoffmann K, Brinkmann V, et al.The notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids[J].Nat Commun, 2015, 6:8989-8999.
8 Smalley M, Ashworth A.Stem cells and breast cancer: A field in Transit[J].Nat Rev Cancer, 2003, 3(11):832-844.
9 Walter D, Lier A, Geiselhart A, et al.Exit from dormancy provokes DNA-damage-induced attrition in haematopoietic stem cells[J].Nature, 2015, 520(7548):549-552.
10 李红,臧隽章,冯振卿,等.肿瘤细胞与骨髓源性细胞融合对肿瘤转移的影响及机制[J].医学研究生学报, 29(6):658-662.
11 Malanchi I, Peinado H, Kassen D, et al.Cutaneous cancer stem cell maintenance is dependent on beta-catenin signalling[J].Nature, 2008, 452(7187):U12-650.
12 Jardé T, Kass L, Staples M, et al.ERBB3 Positively Correlates with Intestinal Stem Cell Markers but Marks a Distinct Non Proliferative CellPopulation in Colorectal Cancer[J].PLoS One, 2015, 10(9):e0138336- e0138351.
13 Swindall AF, Londoño-Joshi AI, Schultz MJ, et al.ST6Gal-I protein expression is upregulated in human epithelial tumors and correlates with stem cell markers in normal tissues and colon cancer cell lines[J].Cancer Res, 2013, 73(7):2368-2378.
14 Chekhun SV, Zadvorny TV, Tymovska YO, et al.CD44+/CD24-markers of cancer stem cells in patients with breast cancer of different molecular subtypes[J].Exp Oncol, 2015, 37(1):58-63.
15 Mansour SF, Atwa MM.Clinicopathological significance of CD133 and ALDH1 cancer stem cell marker expression in invasive ductal breast carcinoma[J].Asian Pac J Cancer Prev, 2015, 16(17):7491-7496.
16 Heerma van Voss MR, van der Groep P, Bart J, et al.Expression of the stem cell marker ALDH1 in the normal breast of BRCA1 mutation carriers[J].Breast Cancer Res Treat, 2010, 123(2):611-612.
17 Guinot A, Oeztuerk-Winder F, Ventura JJ.miR-17-92/p38 alpha dysregulation enhances Wnt signaling and selects Lgr6(+) cancer stemlike cells during lung adenocarcinoma progression[J].Cancer Res, 2016, 76(13):4012-4022.
18 Kobayashi I, Takahashi F, Nurwidya F, et al.Oct4 plays a crucial role in the maintenance of gefitinib-resistant lung cancer stem cells[J].Biochem Biophys Res Commun, 2016, 473(1):125-132.
19 Li T, Su Y, Mei Y, et al.ALDH1A1 is a marker for malignant prostate stem cells and predictor of prostate cancer patients' outcome[J].Lab Invest, 2010, 90(2):234-244.
20 Collins AT, Berry PA, Hyde C, et al.Prospective identification of tumorigenic prostate cancer stem cells[J].Cancer Res, 2005, 65(23):10946-10951.
21 Hayakawa Y, Ariyama H, Stancikova J, et al.Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche[J].Cancer Cell, 2015, 28(6):800-814.
22 Li XB, Yang G, Zhu L, et al.Gastric Lgr5(+) stem cells are the cellular origin of invasive intestinal-type gastric cancer in mice[J].Cell Res, 2016, 26(7):838-849.
23 Zhang XW, Hua RX, Wang XF, et al.Identification of stem-like cells and clinical significance of candidate stem cell markers in gastric cancer[J].Oncotarget, 2016, 7(9):9815-9831.
24 Zhao XZ, Wang F, Hou MX.Expression of stem cell markers nanog and PSCA in gastric cancer and its significance[J].Oncol Lett, 2016, 11(1, A):442-448.
25 Snippert HJ, Haegebarth A, Kasper M, et al.Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin[J].Science, 2010, 327(5971):1385-1389.
26 Brownell I, Guevara E, Bai CB, et al.Nerve-Derived sonic hedgehog defines a niche for hair follicle stem cells capable of becoming epidermal stem cells[J].Cell Stem Cell, 2011, 8(5):552-565.
27 Liu S, Gong Z, Chen M, et al.Lgr5-positive cells are cancer stem cells in skin squamous cell carcinoma[J].Tumour Biol, 2014, 35(11):11605-11612.
28 Sabet MN, Rakhshan A, Erfani E, et al.Co-Expression of putative cancer stem cell markers, CD133 and nestin, in skin tumors[J].Asian Pac J Cancer Prev, 2014, 15(19):8161-8169.
29 Von Rahden BH, Kircher S, Lazariotou M, et al.LgR5 expression and cancer stem cell hypothesis:Clue to define the true origin of esophageal adenocarcinomas with and without Barrett's esophagus[J].J Exp Clin Cancer Res, 2011, 30:23-33.
30 Tomizawa Y, Wu TT, Wang KK.Epithelial mesenchymal transition and cancer stem cells in esophageal adenocarcinoma originating from Barrett's esophagus[J].Oncol Lett, 2012, 3(5):1059-1063.
31 Florian MC, Geiger H.Concise review: polarity in stem cells, disease, and aging[J].Stem Cells, 2010, 28(9):1623-1629.
32 Martin-Belmonte F, Perez-Moreno M.Epithelial cell polarity, stem cells and cancer[J].Nat Rev Cancer, 2012, 12(1):23-38.
33 Knoblich JA.Asymmetric cell division: recent developments and their implications for tumour biology[J].Nat Rev Mol Cell Biol, 2010, 11(12):849-860.
34 Cicalese A, Bonizzi G, Pasi CE, et al.The tumor suppressor p53 regulates polarity of Self-Renewing divisions in mammary stem cells[J].Cell, 2009, 138(6):1083-1095.
35 Sato T, Van Es JH, Snippert HJ, et al.Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J].Nature, 2011, 469(7330):415-418.
36 Goodell MA, Nguyen H, Shroyer N.Somatic stem cell heterogeneity:diversity in the blood, skin and intestinal stem cell compartments[J].Nat Rev Mol Cell Biol, 2015, 16(5):299-309.
37 Yilmaz ÖH, Katajisto P, Lamming DW, et al.mTORC1 in the paneth cell niche couples intestinal stem-cell function to calorie intake[J].Nature, 2012, 486(744):490-495.
38 Beyaz S, Mana MD, Roper J, et al.High-fat diet enhances stemness and tumorigenicity of intestinal progenitors[J].Nature, 2016, 531(7592):53-58.
39 Liu KC, Jiang M, Lu Y, et al.Sox2 cooperates with Inflammation-Mediated Stat3 activation in the malignant transformation of foregut basal progenitor cells[J].Cell Stem Cell, 2013, 12(3):304-315.
40 Arwert EN, Hoste E, Watt FM.Epithelial stem cells, wound healing and cancer[J].Nat Rev Cancer, 2012, 12(3):170-180.
41 Ayyaz A, Jasper H.Intestinal inflammation and stem cell homeostasis in aging Drosophila melanogaster[J].Front Cell Infect Microbiol, 2013, 3:98-105.
42 Waldner MJ, Foersch S, Neurath MF.Interleukin-6-A key regulator of colorectal cancer development[J].Int J Biol Sci, 2012, 8(9):1248-1253.43 Grachtchouk M, Rong M, Yu S, et al.Basal cell carcinomas in mice overexpressing Gli2 in skin[J].Nat Genet, 2000, 24(3):216-217.
44 Youssef KK, Van Keymeulen A, Lapouge G, et al.Identification of the cell lineage at the origin of basal cell carcinoma[J].Nat Cell Biol, 2010, 12(3):299-U111.
45 Wong SY, Reiter JF.Wounding mobilizes hair follicle stem cells to form tumors[J].Proc Natl Acad Sci U S A, 2011, 108(10):4093-4098.
46 Cordero JB, Stefanatos RK, Scopelliti A, et al.Inducible progenitorderived Wingless regulates adult midgut regeneration in Drosophila[J].EMBO J, 2012, 31(19):3901-3917.
47 Thenappan A, Li Y, Shetty K, et al.New therapeutics targeting colon cancer stem cells[J].Curr Colorectal Cancer Rep, 2009, 5(4):209-220.
48 Barker N, Ridgway RA, Van Es JH, et al.Crypt stem cells as the cellsof-origin of intestinal cancer[J].Nature, 2009, 457(7229):608-U119.
49 Van Der Heijden M, Zimberlin CD, Nicholson AM, et al.Bcl-2 is a critical mediator of intestinal transformation[J].Nat Commun, 2016, 7:10916-10926.
50 Scheel C, Eaton EN, Li SH, et al.Paracrine and autocrine signals induce and maintain mesenchymal and stem cell states in the breast[J].Cell, 2011, 145(6):926-940.
51 Zhang D, Park D, Zhong Y, et al.Stem cell and neurogenic geneexpression profiles Link prostate basal cells to aggressive prostate cancer[J].Nat Commun, 2016,7: 10798-10812.
52 Chang CJ, Chao CH, Xia WY, et al.p53 regulates epithelialmesenchymal transition and stem cell properties through modulating miRNAs[J].Nat Cell Biol, 2011, 13(3):317-U296.
53 Decastro AJ, Dunphy KA, Hutchinson J, et al.MiR203 mediates subversion of stem cell properties during mammary epithelial differentiation via repression of DeltaNP63alpha and promotes mesenchymal-to-epithelial transition[J].Cell Death Dis, 2013,4:e514-e523.
54 刁竞芳, 莫嘉强, 赵祥, 等.miR-30a-5p对人肝癌干细胞增殖和凋亡的影响[J].中华细胞与干细胞杂志(电子版), 2016, 6(1):31-35.
55 刁竞芳, 莫嘉强, 赵祥, 等.miR-30a-5p对CD133+Huh7人肝癌干细胞侵袭和迁移能力的影响[J].中华细胞与干细胞杂志(电子版), 2016, 6(3):167-173.
56 Visvader JE, Lindeman GJ.Cancer stem cells in solid tumours:accumulating evidence and unresolved questions[J].Nat Rev Cancer, 2008, 8(10):755-768.
57 Strauss R, Sova P, Liu Y, et al.Epithelial phenotype confers resistance of ovarian cancer cells to oncolytic adenoviruses[J].Cancer Res, 2009, 69(12):5115-5125.
58 Marhaba R, Klingbeil P, Nuebel T, et al.CD44 and EpCAM: Cancer-Initiating cell markers[J].Curr Mol Med, 2008, 8(8):784-804.
59 Yin G, Alvero AB, Craveiro V, et al.Constitutive proteasomal degradation of TWIST-1 in epithelial-ovarian cancer stem cells impacts differentiation and metastatic potential[J].Oncogene, 2013, 32(1):39-49.
60 Grun D, Adhikary G, Eckert RL.VEGF-A acts via neuropilin-1 to enhance epidermal cancer stem cell survival and formation of aggressive and highly vascularized tumors[J].Oncogene, 2016, 35(33):4379-4387.
61 彭穗, 王晶, 彭振维, 等.携带缺氧诱导因子-1α-siRNA的叶酸靶向化的磁性纳米复合物抑制肝癌干细胞增殖的实验研究[J].中华细胞与干细胞杂志(电子版), 2016, 6(1):42-46.
62 Oskarsson T, Essers MA, Dubois N, et al.Skin epidermis lacking the c-Myc gene is resistant to Ras-driven tumorigenesis but can reacquire sensitivity upon additional loss of the p21Cip1 gene[J].Genes Dev, 2006, 20(15):2024-2029.
63 Muncan V, Sansom OJ, Tertoolen L, et al.Rapid loss of intestinal crypts upon conditional deletion of the Wnt/Tcf-4 target gene c-Myc[J].Mol Cell Biol, 2006, 26(22):8418-8426.
Involvement of epithelial stem cells in malignant transformation and mechanisms
Zhang Shihui1, Hu Qiong2, Xie Fuan3, Hong Xiaoqian2, Liu Kuancan2,3.1Undergraduate School, Zhongnan University, Changsha 410012, China;2Department of Laboratory Medicine, Dongfang Hospital, Xiamen University, Fuzhou 350025, China;3Institute for Laboratory Medicine, Fuzhou General Hospital, Fuzhou 350025, China
Corresponding author: Liu Kuancan, Email:liukuancan@163.com
Epithelial stem cells, which have the ability of self-renewal and multiple differentiation, play a crucial role in maintaining epithelial tissue homeostasis.Recently, many studies have showed that epithelial stem cells may be the tumour-initiating cells.The transformation of epithelial stem cell is not only affected by the microenvironment, but also promoted by dysregulation of signal pathways and gene mutations.However, the mechanism how epithelial stem cells transform and become tumor cells remains unclear.Here we review the relationships between epithelial stem cells and cancer stem cells and the mechanism of transformation of epithelial stem cells.
Epithelial cells; Neoplastic stem cells; Mechanisms
2016-10-31)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.02.009
国家自然科学基金(81302068);国家863青年科学家专题(2014AA020541);福建省国际合作重点项目(2017I0014)
410083 长沙,中南大学本科生院1;350025 福州,厦门大学附属东方医院检验科2;350025 福州总医院全军临床检验医学研究所3
刘宽灿,Email:liukuancan@163.com
张诗惠,胡 琼,谢富安,等.上皮干细胞参与肿瘤恶变的机制[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):112-116.

