伏立康唑治疗播散性马尔尼菲蓝状菌病临床分析
魏金瑛 欧阳沿音 蔡双启 梁浩 曹存巍
(1.广西医科大学第一附属医院皮肤性病科 广西艾滋病防治研究重点实验室,南宁 530021;2.广西壮族自治区皮肤病医院,南宁 530003;3.广西医科大学第一附属医院呼吸疾病研究所,南宁 530021;4.广西医科大学公共卫生学院&生命科学研究院,南宁 530021)
·论著·
伏立康唑治疗播散性马尔尼菲蓝状菌病临床分析
魏金瑛1欧阳沿音2蔡双启3梁浩4曹存巍1
(1.广西医科大学第一附属医院皮肤性病科 广西艾滋病防治研究重点实验室,南宁 530021;2.广西壮族自治区皮肤病医院,南宁 530003;3.广西医科大学第一附属医院呼吸疾病研究所,南宁 530021;4.广西医科大学公共卫生学院&生命科学研究院,南宁 530021)
目的 采用回顾性分析的方法探讨伏立康唑治疗播散性马尔尼菲蓝状菌病 (PSM)的临床疗效及安全性。方法 收集2010年1月~2015年6月期间,诊断为PSM且使用伏立康唑作为初始抗真菌治疗的患者资料。伏立康唑近期疗效及安全性分别于治疗16周或治疗结束时予以评估,远期疗效及安全性则于治疗结束后6个月,12个月后予以评估。结果 共有17例患者采用伏立康唑进行初始治疗,3例患者未能完成疗程,在完成治疗的14例患者中,10例病情得到完全控制,3例部分控制,1例无效。在治疗结束6个月后随访的11例患者中,8例治愈,3例复发;治疗结束12月后访视的8例患者病情均无复发。所有患者在治疗期间及治疗结束后均未发生明显的毒副作用。结论 提示伏立康唑治疗播散性PSM具有较好的近期及远期临床疗效及安全性,可作为PSM治疗的一种新方法。
伏立康唑;马尔尼菲蓝状菌病;疗效;安全性
马尔尼菲蓝状菌病 (Penicilliosis marneffei,PSM)是由温度依赖的双相真菌马尔尼菲蓝状菌感染所致的机会性、致命性真菌病,在东南亚及我国广西、广东有区域性流行[1-3],是流行区HIV感染者最易合并的机会性真菌感染之一,该病主要引起全身播散性感染,如得不到有效治疗病死率很高[4-7]。然而,目前对于PSM的治疗方法仍非常有限,其中临床上运用最广泛的是两性霉素B初始治疗而后转为伊曲康唑二期预防治疗的方案,临床研究提示该方法对PSM合并AIDS的患者具有较好的疗效[8]。但两性霉素B在临床应用过程中极易出现肝肾毒性、顽固性低钾、骨髓抑制等副作用,导致部分患者因不能耐受而放弃治疗[9],因此,有必要探讨其他安全有效的新的替代治疗方案。伏立康唑是一种三唑类抗真菌药物,在针对马尔尼菲蓝状菌的体外药敏实验中发现该药的MIC值明显低于两性霉素B、伊曲康唑等常用抗真菌药物[10-13],但临床应用报道并不多见。本文通过回顾2010~2015年间在我院使用伏立康唑进行初始治疗的PSM患者的临床资料,评估伏立康唑近期及远期临床疗效及安全性,探讨伏立康唑作为一种替代方案治疗播散性PSM的可行性。
1 对象与方法
1.1 病例选择
收集2010年1月~2015年6月期间,广西医科大学第一附属医院诊断为PSM且使用伏立康唑作为初始抗真菌治疗药物的患者资料。这些患者均通过培养或者组织病理证实感染马尔尼菲蓝状菌。收集资料包括人口学信息、临床表现、合并症、实验室检查及抗真菌药物的体外药敏实验结果 (CLSI法)[14]。
1.2 伏立康唑治疗方法
所有患者均接受伏立康唑作为初始抗真菌治疗,首日给予6 mg/kg,1次/12 h,而后给予4 mg/kg,1次/12 h静脉治疗最少3 d,再改口服伏立康唑200 mg,2次/d。对于体重低于40 kg的患者治疗剂量减半,对于儿童患者则按照6~8 mg·kg-1·d-1[15]。在完成初始治疗后,临床医师根据患者情况选择伏立康唑进一步治疗或者转为伊曲康唑二期预防治疗。伊曲康唑用量成人为200 mg,2次/d,儿童为5 mg·kg-1·d-1[16]。
1.3 疗效评估
近期临床疗效的评估为伏立康唑治疗结束时 (end of therapy,EOT),或者在治疗第16周 (对于将长期使用伏立康唑治疗的患者)。评估内容包括患者临床症状改善程度、真菌培养结果、影像学及血液检查结果。疗效评估分为:①治疗好转:临床症状及体征完全缓解,真菌培养结果阴性,影像学及血液检查结果好转。②治疗部分好转:临床症状及体征部分缓解,真菌培养结果阴性,影像学及血液检查结果好转。③ 治疗失败:临床症状无好转或患者病情恶化死亡。远期随访在EOT后6个月及12个月进行,疗效评估分为治愈 (临床症状完全消除,真菌培养结果阴性,影像学及血液检查结果无异常),稳定 (症状没有改善也无恶化,真菌培养结果阴性,影像学及血液检查结果好转),复发 (临床症状再次出现,真菌培养阳性,影像学及血清学检查异常)。
1.4 安全性评估
评估治疗期间及治疗后患者出现的所有不良反应事件。检查患者伏立康唑治疗前,治疗1周后以及治疗结束时的血尿常规、肝肾功能、电解质。对于随访患者也在每次访视时检查相关项目。
2 结 果
2.1 人口学资料及临床特点
研究期间共收集了112例马尔尼菲蓝状菌病例,其中17例患者接受静脉伏立康唑作为初始治疗,包括2例HIV感染者。17例中男性11例,女性6例,年龄1~69岁 (平均35.93岁),其中3岁以下儿童5例。成人中农民6例,工人1例,个体户1例,其余为退休或没有固定工作者。他们的临床表现主要为发热 (13人)、贫血 (10人)、浅表淋巴结肿大 (8人)、皮疹 (7人)、呼吸系统症状 (7人)、消瘦 (4人)、消化系统症状 (4人)、骨损害 (4人)、肝脾肿大 (1人)。不常见的是,1例首发症状为上颚部疼痛性肿物;1例主诉则为头痛;因支气管扩张症行肺叶切除术后出现感染症状1例。部分患者在入院时存在既往史。包括高血压及糖尿病2例;肺结核1例,发病前结核病得到控制;肺部感染病史1例;先天性巨结肠1例,已手术治愈。除了马尔尼菲蓝状菌感染,部分患者入院时同时存在其他病原菌感染。合并口腔念珠菌感染4例,巨细胞病毒1例,非结核分枝杆菌感染1例 (见表1)。
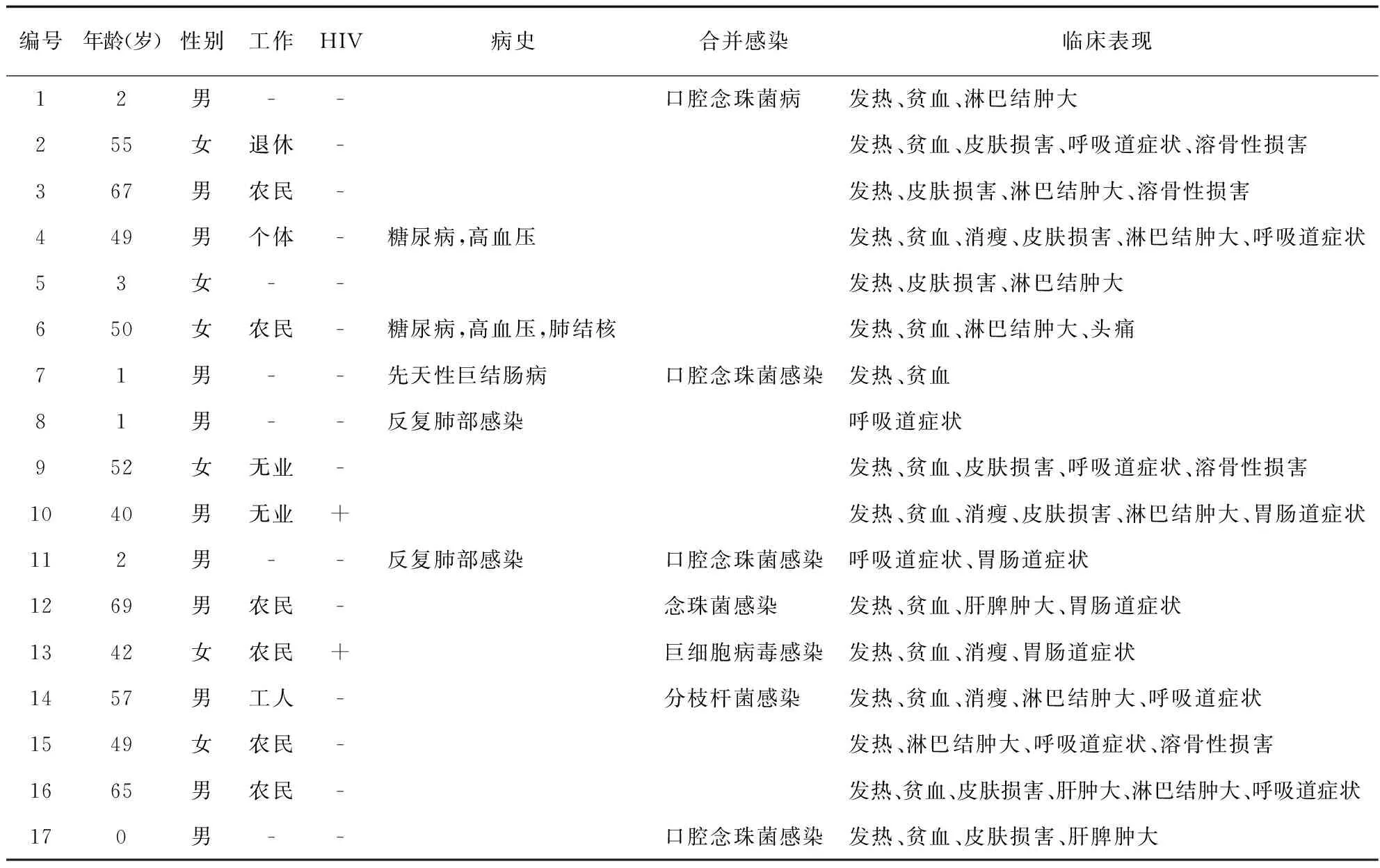
表1 患者基本信息及临床表现
2.2 实验室检查
其中2例HIV阳性,其他均为阴性。除去2例HIV阳性患者,大多数患者存在低的血红蛋白和红细胞计数 (13/15,86.67%),平均值分别为84.03 g/L (范围44.80~116.60 g/L)和3.25×109/L (范围1.95~4.44×109/L);还存在一个白细胞计数增高的现象 (11/15,73.33%),平均值为15.74×109/L (范围0.97~32.79×109/L)。在白细胞分类中,以中性粒细胞增高最为明显。所有患者中,2例出现血小板减少,5例血小板增多。除1例患者ALT异常,其余患者的肝功能、肾功能等生化指标均未见明显异常。在免疫功能方面,所有的HIV阴性患者均未见明显异常;2例HIV患者,均存在低T细胞计数,他们的CD4细胞计数分别为5个/单位和17个/单位。
2.3 临床分离株的体外抗真菌药敏试验
来自患者的17株马尔尼菲蓝状菌体外药敏试验结果显示伏立康唑、两性霉素B、氟康唑及伊曲康唑的MIC范围分别为:0.007 8~0.015 mg/L,1~2 mg/L,0.06~4 mg/L,0.003 9~0.03 mg/L。体外药敏结果显示伏立康唑MIC值明显低于两性霉素B及其他两种唑类药物。
2.4 伏立康唑临床疗效分析
所有患者均通过静脉使用伏立康唑作为初始抗真菌治疗,其中3例患者因经济原因放弃治疗,其余采用静脉治疗的患者平均住院静脉性治疗时间为16.8 d (9~33 d),治疗中位数为14 d。在完成伏立康唑静脉用药后,11例患者继续接受伏立康唑口服治疗,平均用药时间为29.6 d (3~90周),治疗中位数为20周。2例患者分别接受伊曲康唑14或54周的二期预防治疗,1例患者口服伏立康唑16周后转为伊曲康唑二期预防治疗36周。在治疗第16周后进行的近期疗效评估中,10例 (10/14)患者病情得到完全控制,3例病情部分控制,1例治疗无效死亡。在治疗结束6个月后随访的11例患者中,8例治愈,3例复发;治疗结束12个月后访视的8例患者病情均无复发。所有患者在治疗期间及治疗结束后均未发生明显的毒副作用 (见表2)。

表2 治疗方法及疗效评估
注:*.患者因缺乏足够经济支持或其他个人原因而不能完成伏立康唑静脉注射疗程;**.患者有复发的临床症状及体征,但真菌培养结果为阴性;***.在调查截至时患者治疗结束后的时间尚未达到6个月或1 a
3 讨 论
伏立康唑是第二代三唑类抗真菌药物,通过抑制真菌中由细胞色素P450介导的14α-甾醇去甲基化,干扰细胞膜的形成和真菌生长。伏立康唑抗菌谱广,对念珠菌属、新生隐球菌、曲霉属、镰刀霉属和荚膜组织胞浆菌等致病真菌均有较好抗菌活性[17-18]。尤其是在治疗曲霉病时,伏立康唑被美国感染病学会 (IDSA)推荐做为经验性治疗一线方案。此外它还有生物利用度高、安全性好等特点[13]。在治疗PSM方面,Espinel等[17]的实验表明,在体外,伏立康唑的MIC值为0.004~0.25 mg/L,两性霉素B的MIC值为0.125~0.20 mg/L,证明伏立康唑有优于两性霉素B及伊曲康唑的作用。
在本研究中患者都表现为播散性感染,均接受静脉使用伏立康唑治疗,虽然经典的两性霉素B加伊曲康唑治疗方案中,推荐的急性期治疗时间为2周,但临床工作中根据患者病情、合并感染的情况等不同,在治疗时间上存在很大差异。因此,我们认为在治疗时间上应根据患者病情的不同进行调整,必要时应适当延长急性期治疗用药时间。本研究中除个别患者因经济和个人原因终止疗程未能好转,其余患者病情好转率达到了80% (10/14),说明伏立康唑在播散性PSM患者初始的治疗效果是值得肯定的。在3例复发的患者中2例是口服伏立康唑继续治疗,1例直接开始口服伊曲康唑进行二期预防治疗,均在停药后复发。事实上,其中1例复发患者在服用伏立康唑4个月后停药,并再次出现发热及呼吸道症状,查血液仍为阳性,完成9 d的静脉使用伏立康唑治疗后,继续口服伏立康唑12个月后改用伊曲康唑开始二期预防,至今未再出现病情复发。因此我们认为足量、足疗程治疗对减少病情复发是必要的[19]。当然这需要一个大样本的研究加以证实。
伏立康唑另一个优势是其易透过血脑屏障,能有效作用于中枢系统感染,这是两性霉素B及其他抗真菌药无法比拟的。其中1例以头痛为主诉入院的患者,在使用常规降颅压治疗后头痛症状并未得到改善。患者头颅MRI提示存在颅脑内占位,结合病情,我们考虑PSM累及中枢可能性大。事实上,在我们使用伏立康唑之后,患者头痛症状迅速得到了改善,而再次复查头颅MRI,其占位病灶较前明显缩小。
Supparatpinyo等[20-21]对11例合并AIDS的PSM患者使用伏立康唑作为初始治疗方案进行了分析,证明伏立康唑在治疗HIV阳性的PSM患者是有效的。美国在2013年公布的AIDS机会性感染的预防和治疗指南,把伏立康唑作为PSM的替代治疗药物之一。HIV阳性的PSM患者,骨髓和肝脏等器官常受累,易合并其他机会性感染,例如结核、巨细胞病毒、耶氏肺孢子虫等。我们在临床治疗合并AIDS的患者的过程中,通常会使用一些药物去治疗或预防这些疾病,若同时使用两性霉素B治疗,则更容易出现骨髓抑制等不良反应。在治疗HIV阳性的患者9时,首先使用的是两性霉素B并予复方新诺明预防耶氏肺孢子虫感染,5 d后患者出现血小板进行性下降,停用复方新诺明后患者血小板仍未见升高。停用两性霉素B改伏立康唑治疗后患者血小板得到了回升。这说明,在治疗合并其他机会性感染的HIV阳性PSM患者,以及发病时就出现骨髓或肝脏受累的患者时,伏立康唑可以作为代替两性霉素B的很好选择。在PSM病情得到控制后,该患者随即开始了高效抗逆转录治疗,我们随访至2015年4月,仍未出现病情复发。这说明及时开始抗逆转录病毒治疗可能会减少合并AIDS的PSM患者复发几率。在开始高效抗逆转录病毒治疗后,当患者免疫得到重建后,可以缩短二期预防用药时间。
伏立康唑在治疗过程中最常见的副作用为感觉异常、视觉障碍、皮疹、一过性肝功能异常等,其中以视觉障碍最为常见,达30%,但多为轻度,罕见有导致停药者。本研究中,除2例患者外,其余患者在使用伏立康唑过程中均未出现上述情况。患者1在开始使用伏立康唑治疗前转氨酶数值升高,但治疗后转氨酶并未进一步增高,在完成治疗后可降至正常。患者7在静脉使用伏立康唑过程中曾出现转氨酶增高,但不排除与其他抗生素等药物相关,故在护肝及严格监控转氨酶的情况下我们并未停止伏立康唑的使用,在继续使用的过程中转氨酶未进一步增高,且在患者临床表现明显好转之后,转氨酶亦有所下降。在后续的口服治疗过程中,并未再出现这样的情况。因此,我们认为伏立康唑在临床使用过程中的安全性是可靠的。
在本研究中,4例不满3岁的患儿在使用伏立康唑治疗后均取得了较好的效果,除了有效性,儿童用药方面我们更多关注其安全性。在静脉使用伏立康唑过程中,虽然有2个患儿在治疗前期出现转氨酶异常,但这种情况未进一步加重,在临床症状缓解后,他们的转氨酶也恢复正常。其余患儿均未出现不良反应相关不适主诉。在后来长期口服治疗的过程中,所有患儿均未出现不良反应。说明伏立康唑在作为儿童PSM患者的急性期用药,其安全性也是值得肯定的。
综上所述,通过收集我院17例诊断为PSM并使用伏立康唑作为急性期治疗的患者临床资料,证实伏立康唑在治疗PSM,无论对成人,还是儿童均显示有效且安全性好。在静脉使用伏立康唑之后,并延长口服伏立康唑的治疗时间,或是口服伊曲康唑进行一个足够长时间的二期预防治疗,将会减少PSM复发几率。在HIV感染的患者中,伏立康唑也能作为一个很好的替代治疗。
[1] Ustianowski AP,Sieu TP,Day JN.Penicilliummarneffeiinfection in HIV[J].Curr Opin Infect Dis,2008,21(1):31-36.
[2] 赵国庆,冉玉平,向耘.中国大陆马尔尼菲青霉病的临床表现及流行病学特征的系统评价[J].中国真菌学杂志,2007,2(2):68-72.
[3] Deng Z,Ribas JL,Gibson DW,et al.Infections caused byPenicilliummarneffeiin China and Southeast Asia:review of eighteen published cases and report of four more Chinese cases[J].Rev Infect Dis,1988,10(3):640-652.
[4] Kawila R,Chaiwarith R,Supparatpinyo K.Clinical and laboratory characteristics of penicilliosis marneffei among patients with and without HIV infection in Northern Thailand:a retrospective study[J].BMC Infect Dis,2013,13(1):464-468.
[5] Duong TA.Infection due toPenicilliummarneffei,an emerging pathogen:review of 155 reported cases[J].Clin Infect Dis,1996,23(1):125-130.
[6] Vanittanakom N,Sirisanthana T.Penicilliummarneffeiinfection in patients infected with human immunodeficiency virus[J].Curr Top Med Mycol,1997,8(1-2):35-42.
[7] Xi L,Lu C,Zhou X,et al.Fifteen cases of penicilliosis in Guangdong,China[J].Mycopathologia,2004,158(2):151-155.
[8] Sirisanthana T,Nelson KE.Amphotericin B and itraconazole for treatment of disseminatedPenicilliummarneffeiinfection in Human Immunodeficiency Virus-infected patients[J].Clin Infect Dis,1998,26(5):1107-1110.
[9] Walsh TJ,Pappas P,Winston DJ,et al.Voriconazole compared with liposomal amphotericin B for empirical antifungal therapy in patients with neutropenia and persistent fever[J].N Engl J Med,2002,346(4):225-234.
[10] Zmeili OS,Soubani AO.Pulmonary aspergillosis:a clinical update[J].QJM,2007,100(6):317-334.
[11] Greer ND.Voriconazole:the newest triazole antifungal agent[J].Proc,2003,16(2):241-248.
[12] Guideline for prevention and treatment of opportunistic infections in HIV-infected adults and adolescent[EB/OL].(2005-12-12)http://aidsinfo.nih.gov/guidelines on 12/12/2015.
[13] Liu D,Liang L,Chen J.Invitroantifungal drug susceptibilities ofPenicilliummarneffei,from China[J].J Infect Chemother,2013,19(4):776-778.
[14] Mo D,Li X,Wei L,et al.Invitrointeractions of calcineurin inhibitors with conventional antifungal agents against the yeast form ofPenicilliummarneffei[J].Mycopathologia,2014,178(3):217-220.
[15] Doby EH,Jr BD,Blaschke AJ,et al.Therapeutic monitoring of voriconazole in children less than 3 years of age:a case report and summary of voriconazole concentrations for 10 children[J].Pediatr Infect Dis J,2012,31(6):632-635.
[16] Döring M,Eikemeier M,Cabanillas Stanchi KM,et al.Antifungal prophylaxis with posaconazole vs.fluconazole or itraconazole in pediatric patients with neutropenia[J].Eur J Clin Microbiol Infect Dis,2015,34(6):1189-1200.
[17] Espinel-Ingroff A,Boyle K,Sheehan DJ.Invitroantifungal activities of voriconazole and reference agents as determined by NCCLS methods:review of the literature[J].Mycopathologia,2001,150(3):101-115.
[18] 李梦,廖万清.侵袭性真菌感染治疗新进展[J].中国真菌学杂志,2012,7(1):47-51.
[19] Perfect JR,Marr KA,Walsh TJ,et al.Voriconazole treatment for less-common,emerging,or refractory fungal infections[J].CID,2003,36(9):1122-1131.
[20] Supparatpinyo K,Schlamm HT.Voriconazole as therapy for systemicPenicilliummarneffeiinfections in AIDS patients[J].Am J Trop Med Hyg,2007,77(2):350-353.
[21] Supparatpinyo K,Nelson KE,Merz WG,et al.Response to antifungal therapy by human immunodeficiency virus-infected patients with disseminatedPenicilliummarneffeiinfections andinvitrosusceptibilities of isolates from clinical specimens[J].Antimicrob Agents Chemother,1993,37(11):2407-2411.
[本文编辑] 王 飞
Administration of voriconazole in disseminated penicilliosis marneffei:a retrospective study
WEI Jin-ying1,OUYANG Yan-yin2,CAI Shuang-qi3,LIANG Hao4,CAO Cun-wei1
(1.DepartmentofDermatologyandVenereology,TheFirstAffiliatedhospitalofGuangxiMedicalUniversity,GuangxiKeyLaboratoryofAIDSPreventionandTreatment,Nanning530021,China;2.DepartmentofDermatology,GuangxiInstituteofDermatology,Nanning530003,China;3.DepartmentofRespiratory,TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China;4.GuangxiKeyLaboratoryofAIDSPreventionandTreatment,SchoolofPublicHealth&LifeSciencesInstitute,GuangxiMedicalUniversity,Nanning530021,China)
Objective The aim of this retrospective study is to evaluate the efficacy and safety of voriconazole in the treatment of Penicilliosis marneffei (PSM)patients with or without HIV infection in clinical setting.Methods The disseminated PSM patients who
intravenous voriconazole (6 mg/kg every 12 hours for the first 24 hours and then 4 mg/kg every 12 hours afterwards) as primary antifungal treatment were enrolled.The following duration of antifungal treatment varied at the discretion of investigators according to the response of the patients.Primary response was evaluated at Week 16 or at the end of treatment (EOT).Follow-up evaluations were performed at 6 months and 1 year after EOT.Results A total of seventeen patients enrolled in this study,three patients were not evaluable because the treatment discontinued prematurely.Among the remaining fourteen patients,thirteen had satisfied response to treatment,ten patients had complete response and three patients had partial response at Week 16.Only one patient was evaluated as failure.Follow-up assessments in eleven patients showed eight patients were cured and the remaining three patients relapsed at 6 months after EOT.Eight patients were assessed 1 year later,none of them relapsed.No adverse events associated to voriconazole were recorded during the treatment.Conclusion The results from our study suggest that voriconazole is an effective,well-tolerated therapeutic option for disseminatedP.marneffeiinfection.
voriconazole;disseminated penicilliosis marneffei;efficacy;safety
92-97]
国家自然科学基金 (81571971,81271804)
魏金瑛,女 (汉族),硕士研究生在读.E-mail:13807725746@163.com
曹存巍,E-mail:caocunwei@yeah.net
R 519.8
A
1673-3827(2017)12-0092-06
2016-12-08

