脑脊液 (1,3)-β-D-葡聚糖在颅内真菌感染诊治的价值
王兴 杨柳 贺曦 张敏
(重庆市急救医疗中心神经内科,重庆 400014)
·论著·
脑脊液 (1,3)-β-D-葡聚糖在颅内真菌感染诊治的价值
王兴 杨柳 贺曦 张敏
(重庆市急救医疗中心神经内科,重庆 400014)
目的 评估脑脊液中 (1,3)-β-D-葡聚糖 (BDG)含量测定对颅内真菌感染的辅助诊断价值,以及动态监测对病情变化的监测价值。方法 选取已确诊的真菌性脑膜炎10例作为观察组,平行设立非真菌感染对照组,使用MB-80微生物快速动态监测系统对观察组与对照组的患者进行脑脊液BDG含量测定,并动态监测BDG变化与临床病情转归的相关性。结果 颅内真菌感染患者脑脊液BDG明显增高,与对照组差异具有统计学意义 (P<0.05)。随着患者病情改善,脑脊液BDG浓度随着治疗时间的延长逐渐下降。结论 脑脊液中BDG定量测定是颅内真菌感染早期诊断敏感性指标,具有辅助诊断价值;BDG水平与疗效疗程相关。
(1,3)-β-D-葡聚糖;真菌性颅内感染;MB-80微生物快速动态监测系统
颅内感染是神经内科常见疾病,明确颅内感染的病原体是及时准确合理治疗的基础。过去真菌性脑膜脑炎常见于自身免疫缺陷的患者,其患病人数明显少于病毒及细菌性感染,因此对颅内真菌感染的研究较少。近年来特别是在2012年美国出现应用被激素污染的药物注射后爆发颅内真菌感染后,对颅内真菌感染的研究日渐增多[1]。美国疾病防治中心 (CDC)用聚合酶链反应 (PCR)检测脑脊液或脑组织中真菌DNA进行诊断,但结果表明特异性为100%,敏感性仅28%[2]。因此迫切需要一种灵敏度更高,同时具有较高特异度的快速检测手段。
(1,3)-β-D-葡聚糖 (BDG)是真菌细胞壁上的一种葡萄糖聚合物。检测人血清中BDG已被FDA (the US Food and Drug Administration)认可有助于真菌感染的诊断[3-4]。其对真菌感染诊断的敏感性、特异性、阳性预测值均很高。但检测脑脊液中BDG,对颅内真菌感染的诊断及其动态监测对疗效评价的价值鲜有报道。本文将探索检测脑脊液中BDG对颅内真菌感染的诊断意义,并为抗真菌药物治疗疗效判断提供初步依据。
1 资料与方法
1.1 资料
一般资料 通过分析重庆市第四人民医院2013年1月~2015年1月间收治的,脑脊液培养诊断明确的除外隐球菌及结合菌的颅内真菌感染10例患者作为观察组 (具体方法:将患者脑脊液标本加入bact/alert培养液 (biomerieux公司提供)28℃下培养;报阳性后涂片镜检:若革兰染色镜下见酵母样菌落,接种于沙氏培养基28℃培养,7 d后出现酵母样菌落,再接种于念珠菌显色琼脂培养基 (重庆庞通医疗器械有限公司),28℃培养24~48 h观察结果,根据产品说明书判断菌种;若念珠菌显色培养基不能鉴定的菌种再用API-20C AUX酵母菌鉴定系统来鉴定到种的水平。沙氏培养基生长为非酵母类真菌,依据菌落生长特点,镜下菌丝、孢子特征进行菌种鉴定)。其中,男6例,女4例;年龄20~72岁,平均48.5±16.9岁。选取临床确诊的细菌性脑膜炎患者10例,病毒性脑炎10例,其他非颅内感染患者10例作为对照组。年龄18~76岁,平均45.7±20.6岁。
纳入标准 确诊颅内真菌感染:脑脊液真菌培养出现1次以上阳性结果,结合临床表现诊断为颅内真菌感染[1,3]。
排除标准 ①脑脊液培养前接受抗真菌药物治疗。②使用磺胺类药物、阿莫西林克拉维酸钾、丙种球蛋白或某些肿瘤药物及使用含葡聚糖成分的纱布等。③高度怀疑隐球菌及结合菌感染的患者[1-2,5]。
标本采集 ①治疗前送检脑脊液标本检测BDG,标本采集遵循无菌原则。②抗真菌治疗1周及4周后复查BDG质量浓度。
主要仪器 MB-80微生物快速动态检测系统,T02智能恒温仪。
1.2 方法
样本制作 取待测脑脊液0.2 mL,3 000 r/min,离心60 s,取上清液按1∶9加入样品处理液中预混,70℃恒温10 min放入冰水浴制成待测样本。取0.2 mL加入反应剂,溶解后转入标准玻璃反应管,插入MB-80微生物快速动态检测系统中进行反应,反应结束后自动计算出BDG的质量浓度[6]。
统计学方法 应用统计软件spss19.0进行统计学分析,各组BDG原始数据经K-S检验符合正态分布,结果以均数±标准差表示,组间比较采用独立样本t检验。真菌感染组质量浓度前后变化采用重复测量的单因素方差分析。
2 结 果
2.1 真菌感染与非感染组脑脊液BDG含量对比 (见表1)
方差齐次与不齐t均<0.01,两组数据差异具有显著性。提示真菌感染组脑脊液BDG显著高于非感染组,差异具有统计学意义。
2.2 细菌感染组、病毒感染组及非感染组脑脊液BDG差异不具有统计学意义 (见表2)
表1 真菌组与非感染组脑脊液BDG含量比较 (pg/mL)
Tab.1 The comparison of BDG content between fungal infection group and no infection group
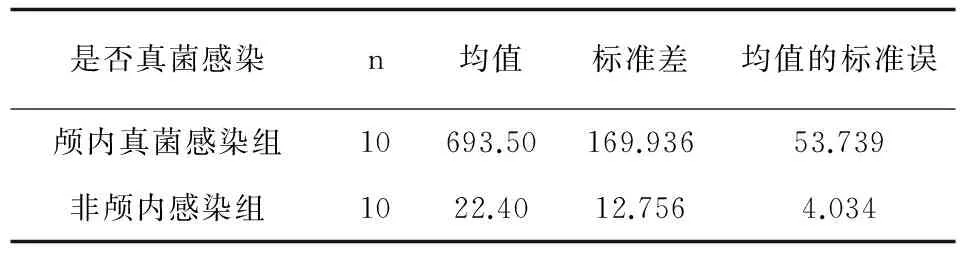
是否真菌感染n均值标准差均值的标准误颅内真菌感染组10693.50169.93653.739非颅内感染组1022.4012.7564.034
表2 细菌组、病毒组及非感染组脑脊液BDG含量 (pg/mL)
Tab.2 The comparison of BDG content among bacterial、virus and no infection groups

病毒感染组细菌感染组非感染组26.5±16.6826.5±16.3322.4±12.7
2.3 对颅内真菌感染患者BDG值的随访监测 (见表3)
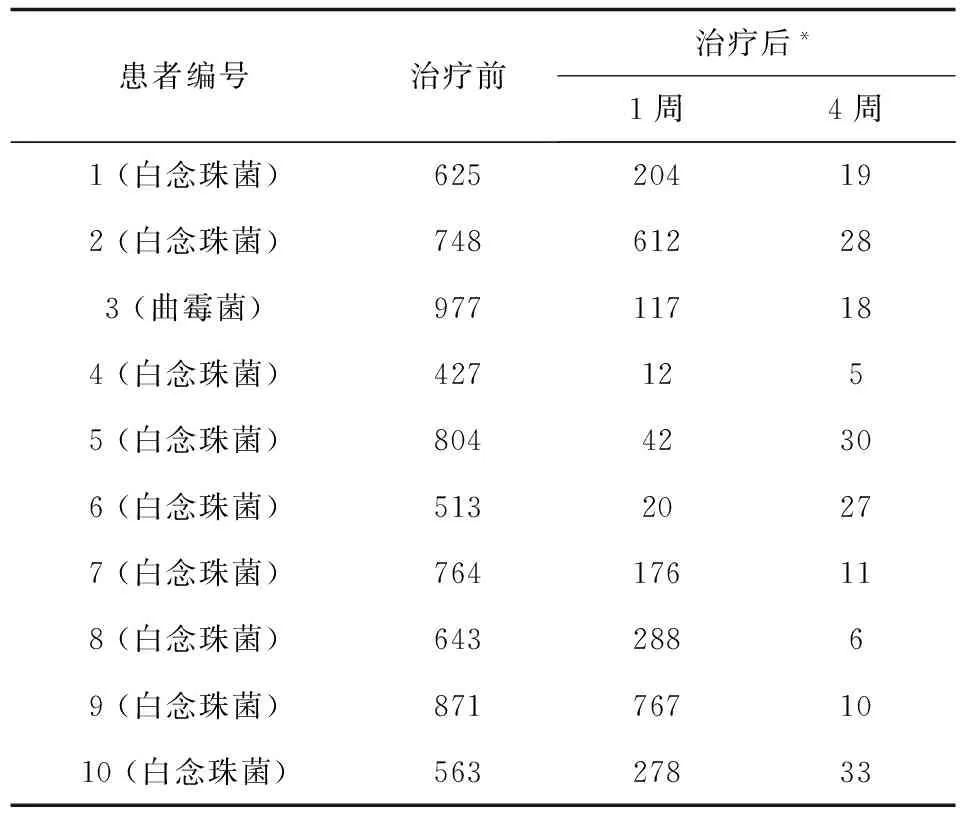
表3 颅内真菌感染BDG定量监测 (pg/mL)
注:*.我科本次入组患者白念珠菌感染者选用氟康唑,曲霉菌感染者选用伏立康唑 (根据药敏选择)
重复测量BDG的球形度检验 (Mauchly 的球形度检验b)P=0.424>0.05,满足了协方差矩阵球形性检验,不需要对结果进行校正。
应用spss19.0进行重复测量BDG质量浓度单因素方差分析P<0.01,提示不同时间点BDG差别具有统计学意义,表示BDG质量浓度随着病情改善,治疗时间延长,呈逐渐下降趋势,且差异有统计学意义。
2.4 脑脊液常规生化与BDG的关系
同时我们检测脑积液细胞数发现,脑脊液白细胞计数与BDG变化并不绝对一致;10例患者脑脊液糖、氯化物、蛋白与BDG浓度未呈现相关性。
3 讨 论
3.1 脑脊液BDG检测用于颅内真菌感染的诊断
BDG既往被认为特征性地存在于大多数真菌上 (除结合菌和隐球菌外),虽最近有文献报道隐球菌感染者测量血及脑脊液BDG也有阳性者,但多为重症患者,其敏感度及特异度均不高,且尚不能排除是否存在合并感染等可能性,故本次试验未纳入隐球菌感染者[7]。
由于人体细胞不存在这种多聚糖,因此它可以作为真菌抗原的特异性标志,当真菌进入人体血液或组织后,因人体不具备应用分解BDG的酶,BDG在经过吞噬细胞的吞噬、消化或生长代谢的过程中自然脱落,从而进人宿主血液或其他体液中,因此我们可以从血液、脑脊液等体液中对其进行检测并定量。目前,血液BDG检测已广泛应用于深部真菌感染的诊断,有文献报道血浆中BDG质量浓度检测的敏感性、特异性、阳性预测值和阴性预测值分别为87.5%、89.6%、70.0%和96.3%[8]。而在这些侵袭性真菌感染病例中,各研究都包括有颅内感染以及其他脏器真菌感染,而我们想更好地对颅内真菌感染定位诊断,并对其疗效进行监测[1,9-11]。
本研究有限病例脑脊液BDG测定结果显示,颅内真菌感染患者,脑脊液BDG明显增高,与对照组差异有统计学意义,可用于颅内真菌感染的辅助快速诊断。若扩大样本含量,进行灵敏度及特异度测定,是否可进行诊断阈值的确定,有待我们进一步的试验证明。目前我们有限的数据表明,用脑脊液BDG进行颅内真菌感染的诊断可能较PCR更敏感,较脑脊液培养更快速。
3.2 血BDG测定与脑脊液BDG测定
本研究中并没有就血中BDG浓度与脑脊液BDG浓度进行相关性分析,虽然在我们测量脑脊液BDG时也同样测定血BDG浓度。对于真菌感染患者血BDG浓度同脑脊液BDG浓度一样均明显升高,但是血中BDG浓度增高不能确定为颅内真菌感染,也可以是其他脏器深部真菌感染[1,9-11]。而我们更期待明确脑脊液BDG质量浓度范围,从而对颅内真菌感染进行诊断及预后判断。
3.3 应用BDG进行真菌感染诊断的局限性
不能鉴别真菌的种类是BDG最大的局限性。因此其无法替代涂片镜检及真菌培养等传统检测方法。
3.4 脑脊液BDG测定用于疾病监测及转归预测
侵袭性真菌病抗真菌治疗过程中,检测脑脊液BDG质量浓度逐渐下降,治疗后与治疗前差异存在统计学意义,提示脑脊液BDG质量浓度与疗效疗程相关,是否预示脑脊液BDG下降的水平可能作为对疗效的监测指标,BDG浓度是否可以作为停用抗真菌药的指标之一值得研究。但在本研究中,我们所选取的患者均为临床症状缓解患者,因此病情恶化的患者是否存在脑脊液BDG的持续增高,或者复发患者是否存在脑脊液BDG的变化,有待多中心大样本研究数据证实。
[1] Mikulska M,Furfaro E,Del Bono V,et al.(1-3)-β-D-Glucan in cerebrospinal fluid is useful for the diagnosis of central nervous system fungal infections[J].Clin Infect Dis,2013,56(10):1511-1512.
[2] Gade L,Scheel CM,Pham CD,et al.Detection of fungal DNA in human body fluids and tissues during a multistate outbreak of fungal meningitis and other infections[J].Eukaryot Cell,2013,12(5):677-683.
[3] Alexander BD,Smith PB,Davis RD,et al.The (1,3)-β-D-glucan test as an aid to early diagnosis of invasive fungal infections following lung transplantation[J].J Clin Microbiol,2010,48(11):4083-4088.
[4] Ahmad S,Khan ZU,Theyyathel AM.Diagnostic value of DNA,(1-3)-β-d-glucan,and galactomannan detection in serum and bronchoalveolar lavage of mice experimentally infected withAspergillusterreus[J].Diag Microbiol Infect Dis,2007,59(2):165-171.
[5] Karageorgopoulos DE,Vouloumanou EK,Ntziora F,et al.(1-3)-β-D-Glucan assay for the diagnosis of invasive fungal infections:a meta-analysis[J].Clin Infect Dis,2011,52( 6):750-770.
[6] 刘春玉,王红,任爱民,等.血浆( 1-3)--D-葡聚糖诊断深部真菌感染的临床研究[J].中国真菌学杂志,2012,7(4):207-210.
[7] Joshua R,David RB,Nathan CB.(1,3)-β-D-glucan in cryptococcal meningitis[J].The lancet infectious diseases,2015,15(10):1136-1137.
[8] Pazos C,Ponton J,Del Palacio A.Contribution of (1,3)-β-D-glucan chromogenie assay to diagnosis and therapeutic monitoring of invasivea spergillosis in neutropenic adult patients:a comparison with serial screening for circulating galactomannan[J].J Clin blicrobiol,2005,43(1):299-305.
[9] Litvintseva AP,Lindsley MD,Gade L,et al.Utility of (1-3)-β-D-glucan testing for diagnostics and monitoring response to treatment during the multistate outbreak of fungal meningitis and other infections[J].Clin Infect Dis,2014,58(5):622-630.
[10] Lyons JL,Roos KL,Marr KA,et al.Cerebrospinal fluid (1,3)-β-D-glucan detection as an aid for diagnosis of iatrogenic fungal meningitis[J].J Clin Microbiol,2013,51(4):1285-1287.
[11] Petraitiene R,Petraitis V,Hope WW,et al.Cerebrospinal fluid and plasma (1,3)-β-D-glucan as surrogate markers for detection and monitoring of therapeutic response in experimental hematogenousCandidameningoencephalitis[J].Antimicrob Agents Chemother,2008,52(11),4121-4129.
[本文编辑] 施 慧
Clinical values of (1,3)-β-D-glucan in cerebrospinal fluid of patients with fungal meningitis
WANG Xing,YANG Liu,HE Xi,ZHANG Min
(ChongQingEmergencyMedicalCenter,ChongQingTheFourthHospital,Chongqing400014)
Objective To evaluate the utility of (1,3)-β-D-glucan (BDG)as an assist diagnostic tool for patients infected with fungal meningoencephalitis.To investigate the change of BDG level following the administration of antifungal drug in fungal meningoencephalitis patients,evaluate the monitor value of BDG in cerebrospinal fluid (CSF) for fungal meningoencephalitis.Methods BDG concentrations of 10 cerebrospinal fluid (CSF) specimens from confirmed cases of fungal meningoencephalitis,and 30 negative control CSF specimens were tested.And we also assessed whether BDG levels correlate with clinical status by using incident samples from 10 patients with serially collected CSF.Results The level of BDG in CSF was obviously rise in those confirmed cases of fungal meningoencephalitis,the data had a statistically significant difference (P<0.05).Patients with serially collected CSF displayed that patients with a decline in CSF BDG had clinical improvement.Conclusions Our data suggest that measuring BDG in CSF is a highly sensitive test for diagnosis of fungal meningoencephalitis.Analysis of BDG levels in serially collected CSF demonstrated that BDG may correlate with clinical response and course of treatment.Routine measurement of BDG in CSF may provide useful adjunctive data for the clinical management of patients with meningoencephalitis.
(1-3)-β-D-Glucan;fungal meningoencephalitis;MB-80rapid microbial monitoring system
86-88]
重庆市卫生局医学科研计划项目 (2013-2-101)
王兴,女 (汉族),硕士,主治医师.E-mail:383998294@qq.com
杨柳,E-mail:wxfx.2005@163.com
R 446.5
A
1673-3827(2017)12-0086-03
2016-09-25

