芒果苷协同氟康唑抗耐药白念珠菌作用研究
董怀怀 王元花 廖泽彬 姜远英 曹颖瑛
(中国人民解放军第二军医大学药学院新药研究中心,上海 200433)
·论著·
芒果苷协同氟康唑抗耐药白念珠菌作用研究
董怀怀 王元花 廖泽彬 姜远英 曹颖瑛
(中国人民解放军第二军医大学药学院新药研究中心,上海 200433)
目的 研究芒果苷与氟康唑合用对唑类耐药白念珠菌协同抗真菌的作用和机制。方法 采用棋盘式微量稀释法测试芒果苷协同氟康唑对22株耐药白念珠菌的最小抑菌浓度MIC80;时间-杀菌曲线探究两药联用对4株耐药白念珠菌生长的抑制作用;药物生长抑制实验实验探究不同浓度芒果苷和不同浓度氟康唑协同抗耐药白念珠菌药效;通过实时定量RT-PCR检测两药联用时耐药基因CDR1、CDR2、MDR1表达水平。结果 芒果苷联合氟康唑可产生协同抗唑类白念珠菌作用,协同指数 (FICI)<0.5;两药合用对白念珠菌生长可产生抑制作用;两药合用降低耐药基因CDR1表达水平。结论 芒果苷与氟康唑合用可产生协同抗唑类耐药白念珠菌作用。
耐药白念珠菌;芒果苷;氟康唑
近年来,由于抗生素和免疫抑制剂的广泛使用,免疫缺陷患者 (艾滋病患者、器官移植患者和放、化疗癌症患者)不断增多,深部真菌感染发生率逐年增加,尤其白念珠菌 (Candidaalbicans)感染最为常见[1]。白念珠菌作为一种条件致病真菌,会引起人类浅表性和系统性感染,导致阴道炎、菌血症等疾病。氟康唑等唑类药物是临床上治疗和预防白念珠菌感染的常用药物,但随着药物长期使用,耐药现象非常普遍[2]。目前对白念珠菌耐药性机制研究包括细胞膜通透性降低、外排泵转运增强、药物靶点基因变异或过度表达、生物被膜的形成等[3-6]。为解决真菌耐药难题,小檗碱、黄芩素和光甘草定等抗真菌药物增效剂研究受到广泛关注[7-9]。
芒果苷 (mangiferin)是一种双苯吡酮类黄酮类化合物,结构见图1。研究表明,芒果苷具有抗炎、抗病毒、抗肿瘤、抗氧化、抗细菌等多方面药理活性,但对于芒果苷抗耐药白念珠菌药理作用尚未有报导[10-12]。本实验通过测试22株临床耐药白念珠菌MIC80、药物生长抑制实验实验、杀菌曲线和RT-PCR研究芒果苷协同氟康唑抗耐药白念珠菌的作用机制,为临床治疗耐药白念珠菌感染提供新思路、提供安全有效的给药方案。
1 材料和方法
1.1 材料
菌株 临床耐药白念珠菌 (Candidaalbicans,C.albicans)22株,由第二军医大学附属上海市长海医院真菌室提供,并且经形态学和生化学鉴定。
药物 氟康唑 (fluconazole,FLC,批号F8929)和芒果苷 (mangiferin,MG,批号M3547)从sigma公司购买,二甲亚砜 (Dimethyl sulfoxide,DMSO)购自国药化学试剂有限公司。氟康唑和芒果苷分别用二甲亚砜溶解,配制使用。
培养基 YPD液体培养基 (2%葡萄糖,2%蛋白胨,1%酵母浸膏)。SDA固体培养基 (4%葡萄糖,2%琼脂,1%蛋白胨)。RPMI1640培养基 (3.45%吗啡啉丙磺酸,1%RPMI1640,0.2%NaHCO3,NaOH调节pH至7.0,0.22 μm微孔滤膜过滤除菌,与4℃保存[13])。
仪器 HZQ-F160恒温振荡培养箱 (江苏太仓市实验设备厂),Eppendorf 5417高速冷冻离心机 (Eppendorf),SW-CT-IF型超净化工作台 (苏州安泰空气技术有限公司),96孔细胞培养板 (Becton,Dickinson and Company)。
1.2 方法
菌株培养 从SDA固体培养基上挑取单克隆菌株与YPD液体培养基,30℃,200 r/min活化培养16 h后用于后续实验。
棋盘式微量稀释法 药物最小抑菌浓度MIC80测定:取16 h活化后菌液,用新鲜的RPMI1640培养基稀释重悬,用血细胞计数板调整菌液浓度至1×103~5×103CFU/mL。按照CLSI推荐RPMI1640培养基倍比稀释法[14-15],在24、48 h分别测定药物MIC80值(与空白对照组相比,以OD600下降80%以上的最低药物浓度为MIC80值)。
协同药效判定 采用联合抑菌分数考察协同药效,联合抑菌分数分别为每种药物合用时抑菌时所需最低抑菌浓度(MIC)分别除以单用时MIC商的和,FICI≤0.5时两药的相互作用确定为协同作用[16]。
生长抑制实验 将过夜培养16h后菌液PBS漂洗两次,再用RPMI1640培养基重悬,血细胞计数板计数,调整菌浓度至5×103,稀释菌液分装与高压灭菌玻璃管中。各组加入单用及联用药物,30℃,200 r/min恒温培养箱培养48h后拍照,用血球计数板记录各组单克隆菌数目[9]。
杀菌曲线实验 将过夜菌液用PBS漂洗两次后再用RPMI1640培养基重悬,血细胞计数板计数,调整菌浓度至1×103~5×103CFU/mL,分别加入单用及合用药物。在0、12、24、36、48 h从不同稀释倍数的菌液中各取适量,均匀涂铺于含SDA固体培养基表面。平皿于30℃真菌培养箱中培养48 h后计数菌落数目,以log10 CFU/mL对时间作曲线。
提取总RNA及Real-Time PCR 白念珠菌耐药菌103于YPD液体培养基中培养至对数生长期 (OD600=0.5),分别加入氟康唑 (4 μg/mL)、芒果苷 (32 μg/mL)、氟康唑芒果苷合用 (8 μg/mL氟康唑+32 μg/mL芒果苷),30℃,200 r/min培养12 h后,参照北京天恩泽公司试剂盒提取RNA。314 nm处检测RNA浓度,并检测OD260/OD280和OD260/OD230数值,考察RNA提取的质量,然后各组取相同量RNA反转录为cDNA。实时定量PCR (Real Time PCR)循环参数如下:95℃ (变性)5 s,55℃ 30 s (退火),72℃ 1 min (延伸),重复45个循环。以18S rRNA为内参,用2-ΔΔCt法分析基因表达水平差异。本实验选取所用引物见表1。

表1 本实验RT-PCR引物序列
注:F.正向引物,R.反向引物
1.3 统计分析
本实验所有结果均进行3次独立重复,采用GraphPad Prism 5分析及作图,数据以均数±标准差表示。
2 结 果
2.1 芒果苷协同氟康唑MIC80
应用棋盘式微量稀释法,检测芒果苷和氟康唑合用对22株临床耐药菌的最低抑菌浓度。结果显示:两个药物单用MIC80>64 μg/mL,4~8 μg/mL芒果苷联用可以降低氟康唑的最低抑菌浓度至1~4 μg/mL (见表2)。部分协同指数 (fractional inhibitory concentration index,FICI,分别为每种药物合用时抑菌时所需最低抑菌浓度MIC与单用时MIC的比值,FICI≤0.5时两药的相互作用确定为协同作用,且FICI数值越小,协同作用越强)小于0.2 (见表2),说明芒果苷与氟康唑具有明显的协同抗菌药效。
表2 芒果苷协同氟康唑抗临床耐药白念珠菌MIC80
Tab.2 MIC80of the combination of mangiferin and fluconazole against fluconazole-resistantC.albicansby microdilution assay

菌株MIC80单独(μg/mL)MIC80结合24h(μg/mL)FLCMGFLCMGFICI综合指数MIC80结合48h(μg/mL)FLCMGFICI综合指数模式18#>64>64440.13480.19协同25#>64>64240.09440.13协同J18>64>64440.13440.13协同J28>64>64180.14280.16协同J38>64>64180.14280.16协同7>64>64280.16280.16协同17>64>64180.14280.16协同18>64>64240.09440.13协同032>64>64480.19480.19协同100>64>64180.14280.16协同103>64>64180.14180.14协同162>64>64140.08240.09协同215>64>64240.09440.13协同271>64>64180.14280.16协同305>64>64240.09280.16协同385>64>64140.19140.19协同502>64>64140.08180.14协同557>64>64240.09280.16协同842>64>64280.16280.16协同876>64>64180.14280.16协同901>64>64280.16480.19协同940>64>64180.14280.16协同
注:MG.芒果苷,FLC.氟康唑
2.2 生长抑制实验
生长抑制实验进一步研究氟康唑和芒果苷不同浓度下合用对耐药白念珠菌的抑制作用,将实验室前期经过形态学和生化学鉴定的103耐药菌株为研究对象,药物作用48 h后通过拍照记录各组菌液浑浊情况和对各组细胞浓度计数反应药物对菌的抑制作用。由图2a分析可看出,空白组2~4 μg/mL氟康唑和4~64 μg/mL芒果苷单用组溶液浑浊,表明两个药物单用不能抑制103耐药菌的生长。而1 μg/mL氟康唑与8 μg/mL芒果苷合用组,溶液显澄清,说明该浓度药物明显抑制了103菌的生长,这与棋盘式铺板实验MIC80数据相符合 (见表2)。对各组细胞分别计数统计分析可以得出,氟康唑和芒果苷单独加入后,耐药菌103最终都生长至108左右,与空白组相比没有明显差异。当氟康唑与不同浓度芒果苷联用后,菌的生长受到了明显抑制。并且随药物浓度增加,菌生长抑制作用更加明显,呈现一定量效关系 (见图2b)。
2.3 时间-杀菌曲线
时间-杀菌曲线可以反应各时间点药物的抑菌或杀菌作用,本实验采用时间-杀菌曲线研究芒果苷和氟康唑联用对四株临床耐药白念珠菌103、385、876、940抑制作用。菌液起始浓度参照棋盘式稀释法1~5×103CFU/mL,倍比稀释涂板分析0、12、24、36、48 h两药联用的作用。结果表明:32 μg/mL芒果苷 (MG)对四株耐药白念珠菌未显示抑制作用,这与棋盘式结果相符 (芒果苷单用MIC80>64 μg/mL);8 μg/mL氟康唑 (FLC)前期对菌生长有一定抑制作用,在48 h后差异不明显;32 μg/mL芒果苷 (MG)与8 μg/mL氟康唑 (FLC)联用后,24 h就可显示差异,作用36、48 h与单用组和空白组相比差异更加明显 (见图3)。
2.4 芒果苷和氟康唑联用对耐药基因表达影响
白念珠菌103经氟康唑、芒果苷及两药联合作用10 h后,采用实时定量RT-PCR测定白念珠菌耐药基因CDR1、CDR2、MDR1的mRNA表达水平。结果显示,两药联用组耐药基因表达水平明显低于氟康唑单用组,氟康唑单用组CDR2、MDR1明显上调2.5倍左右。在联用组基因表达水平中,CDR1下调最为明显,CDR2、MDR2较氟康唑单用组下调1~1.5倍 (见图4)。
3 讨 论
目前,应用于临床的抗真菌药物数量有限,主要包括唑类抗真菌药物,如氟康唑;多烯类抗生素,


Fig.1 Structure of mangiferin Fig.2 Growth condition of fluconazole-resistantCandidaalbicans103 treated with different concentrations of fluconazole (FLC) and mangiferin (MG).Fluconazole-resistantCandidaalbicans103 were suspended to 5×103CFU/mL in glass tubes.Different concentrations of fluconazole (16,8,4,2,1 μg/mL) and mangiferin (64,32,16,8,4 μg/mL) alone or the combiantion were added into tubes.After incubation at 30℃,200 r/min for 48 h,pictures were taken.Colony were determined by Hemocytometer Measurement (a.Pictures of growth condition ofCandidaalbicans103 after 48 h incubation,b.Number ofCandidaalbicansin each tube detemined by Hemocytometer Measurement).Each experimental condition was independently repeated three times (MG.mangiferin,FLC.fluconazole)
如两性霉素B;棘白菌素类抗真菌药物,如卡泊芬净;丙烯胺类,如特比萘芬。其中,氟康唑由于溶解
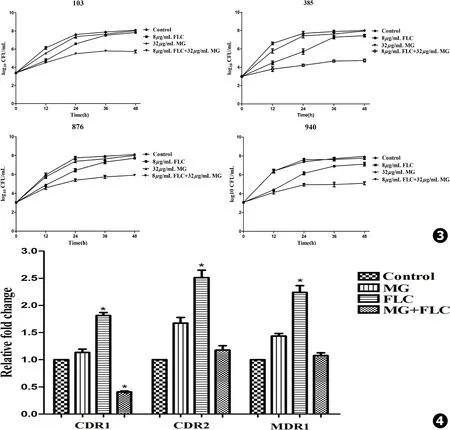

Fig.3 Time-kill curves of 8 μg/mL fluconazole and 32 μg/mL mangiferin against fluconazole-resistantCandidaalbicans103,385,876 and 940.Each experimental condition was independently repeated for three times (MG.mangiferin,FLC.fluconazole) Fig.4 Effects of 32 μg/mL mangiferin in combination with 8 μg/mL fluconazole on the expression of CDR1,CDR2,MDR1 inCandidaalbicans.Each experimental condition was independently repeated for three times (MG.mangiferin,FLC.fluconazole)
性好、不良反应较少、生物利用度高等优点,受到广泛应用。但由于多次重复给药和长期治疗,导致耐药性越来越普遍。而且,对氟康唑耐药的临床菌株通常对其他唑类药物 (如伏立康唑、酮康唑、伊曲康唑等)能够产生交叉耐药现象。其中,白念珠菌 (Candidaalbicans)是临床最常见的条件致病性真菌,能够引起皮肤感染、黏膜感染以及侵入性深部真菌感染等多种疾病。近年来,国内外文献报道白念珠菌对氟康唑的耐药性不断增强,成为临床上治疗失败的主要原因。
研究表明白念珠菌耐药的主要机制包括药物靶点基因 (Erg11)突变或高度表达、细胞对药物外排能力增强、形成生物被膜。其中,对药物外排能力增强,减少抗真菌药物胞内积累,是白念珠菌对唑类药物最主要的耐药机制。药物外排转运蛋白主要包括ABC转运蛋白 (ATP-biding cassette)和易化扩散载体超家族蛋白 (major facilitator superfamily),但只有Cdr1p、Cdr2p、Mdr1p与白念珠菌耐药性相关。
芒果苷作为一种从植物中提取的天然化合物,资源丰富,毒副作用低,具有抗炎、抗病毒、抗肿瘤、抗氧化、免疫调节等多方面药理作用。此外,近年来研究发现芒果苷具有抑制病原微生物作用,例如芒果苷可以协同红霉素抗痤疮丙酸杆菌及金黄色葡萄球菌,芒果苷泡腾片体外可以抑制铜绿假单胞菌、大肠埃希菌生长,但对于抗耐药白念珠菌作用未有研究报道。
本研究发现,芒果苷作为一种抗真菌增效剂,可以恢复耐药菌对药物的敏感性,降低氟康唑MIC80至1~4 μg/mL。药物敏感实验分析对比药物作用48 h后菌液浑浊度、涂板计数每个药物浓度作用48 h后菌的克隆数目进一步确认了两药合用对耐药白念珠菌的抑制作用。随机选取103、385、876、940四株耐药菌进行杀菌曲线实验,结果表明32 μg/mL芒果苷和8 μg/mL氟康唑联用可明显抑制菌的生长,并表明两药联用对耐药白念珠菌抑制作用的普遍性。
白念珠菌的主要耐药蛋白包括Cdr1p、Cdr2p、Mdr1p,Cdr1p蛋白是最先从白念珠菌中表达的ABC转运蛋白[17],直接参与白念珠菌对氮唑类药物耐药性的产生[18],大量研究发现Cdr1p蛋白的高表达是临床耐药白念珠菌耐药的主要机制[19-20]。本实验通过实时定量RT-PCR分析耐药基因表达水平,结果显示氟康唑处理组CDR1、CDR2、MDR1基因表达水平升高,这可能与白念珠菌103在药物刺激下外排泵能力增强有关;相对8 μg/mL氟康唑处理组,联合用药组耐药基因CDR1、CDR2、MDR1基因表达水平明显下调,CDR1下调幅度最大。结果提示 芒果苷协同氟康唑抗耐药白念珠菌分子机制可能是由于Cdr1p、Cdr2p、Mdr1p耐药蛋白转运功能受到抑制,从而恢复了菌株对氟康唑的敏感性。其中,联合用药处理组CDR1基因表达水平下调最明显,表明MG与FLC协同抗耐药白念珠菌的主要分子机制与Cdr1p蛋白转运功能受到抑制有关。
综上所述,本次研究首次报道了芒果苷具有协同氟康唑抗耐药白念珠菌作用。通过对多株耐药菌测试MIC80,生长抑制实验和杀菌曲线证实了两药联用抗耐药白念珠菌作用的普遍性。应用RT-PCR提示两药合用机制与耐药基因CDR1、CDR2、MDR1表达水平下调及外排泵能力减弱有关。芒果苷毒副作用低,提取方便,芒果苷和氟康唑联用抗耐药白念珠菌可以为临床耐药菌治疗提供安全、有效的新思路和新方案。
[1] Crunkhorn S.Fungal infection:Protecting fromCandidaalbicans[J].Nat Rev Drug Discov,2016,15(9):604.
[2] Liao X,Qiu H,Li R,et al.Risk factors for fluconazole-resistant invasive candidiasis in intensive care unit patients:An analysis from the China Survey of Candidiasis study[J].J Crit Care,2015,30(5):1154.
[3] White T C,Holleman S,Dy F,et al.Resistance mechanisms in clinical isolates ofCandidaalbicans[J].Antimicrob Agents Chemother,2002,46(6):1704-1713.
[4] Xu Y,Sheng F,Zhao J,et al.ERG11 mutations and expression of resistance genes in fluconazole-resistantCandidaalbicansisolates[J].Arch Microbiol,2015,197(9):1087-1093.
[5] Nobile CJ,Johnson AD.CandidaalbicansBiofilms and Human Disease[J].Annu Rev Microbiol,2015,69(1):71-92.
[6] Mane A,Vidhate P,Kusro C,et al.Molecular mechanisms associated with Fluconazole resistance in clinicalCandidaalbicansisolates from India[J].Mycoses,2016,59(2):93-100.
[7] Li DD.Fluconazole assists berberine to kill fluconazole-resistantCandidaalbicans[J].Antimicrob Agents Chemother,2013,57(12):6016-6027.
[8] Cao YY,Daib BD,Yan W,et al.Invitroactivity of baicalein againstCandidaalbicansbiofilms[J].Int J Antimicrob Agents,2008,32(1):73-77.
[9] Liu W,Li LP,Zhang JD,et al.Synergistic antifungal effect of glabridin and fluconazole[J].Plos One,2014,9(7):e103442-e103442.
[10] Morais TC,Arruda BR,de Sousa Magalhães H,et al.Mangiferin ameliorates the intestinal inflammatory response and the impaired gastrointestinal motility in mouse model of postoperative ileus[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(5):531-538.
[11] Bhatia HS,Candelario-Jalil E,Oliveira A,et al.Mangiferin inhibits cyclooxygenase-2 expression and prostaglandin E 2,production in activated rat microglial cells[J].Arch Biochem Biophys,2008,477(2):253-258.
[12] Stoilova I,Ho L.Antimicrobial and antioxidant activity of the polyphenol mangiferin[J].Herba Polonica,2005,48(211):33-40.
[13] Kuykendall RJ,Lockhart SR.Microbroth dilution susceptibility testing ofCandidaspecies[J].Methods Mol Biol,2016,1356:173-181.
[14] Rex J H.Reference method for broth dilution antifungal susceptibility testing of yeasts:Third informational supplement[M].Clinical and Laboratory Standards Institute,2008.
[15] Perea S,Gonzalez G,Fothergill AW,et al.Invitroactivities of terbinafine in combination with fluconazole,itraconazole,voriconazole,and posaconazole against clinical isolates ofCandidaglabratawith decreased susceptibility to azoles[J].J Clin Microbiol,2002,40(5):1831-1833.
[16] Gil-Lamaignere C,Müller FM.Differential effects of the combination of caspofungin and terbinafine againstCandidaalbicans,Candidadubliniensis,andCandidakefyr[J].Int J Antimicrob Agents,2004,23(5):520-523.
[17] Prasad R,De Wergifosse P,Goffeau A,et al.Molecular cloning and characterization of a novel gene ofCandidaalbicans,cdr1,conferring multiple resistance to drugs and antifungals[J].Curr Genet,1995,27(4):320-329.
[18] Krishnamurthy S,Gupta V,Snehlata P,et al.Characterisation of human steroid hormone transport mediated by Cdr1p,a multidrug transporter ofCandidaalbicans,belonging to the ATP binding cassette super family[J].FEMS Microbiol Lett,1998,158(1):69-74.
[19] Sanglard D,Ischer F,Calabrese D,et al.The ATP binding cassette transporter geneCgCDR1 fromCandidaglabratais involved in the resistance of clinical isolates to azole antifungal agents[J].Antimicrob Agents Chemother,1999,43(11):2753-2765.
[20] Manoharlal R,Gaur NS,Morschhauser J,et al.Transcriptional activation and increased mRNA stability contribute to overexpression ofCDR1 in azole-resistantCandidaalbicans[J].Antimicrob Agents Chemother,2008,52(4):1481-1492.
Synergistic effect of mangiferin in combination with fluconazole against fluconazole-resistantCandidaalbicans
DONG Huai-huai,WANG Yuan-hua,LIAO Ze-bin,JIANG Yuan-ying,CAO Ying-ying
(NewDrugRearchandDevelopmentCenter,SchoolofPharmacy,SecondMilitaryMedicalUniversity,Shanghai200433,China)
Objective To explore the synergistic effect of mangiferin in combination with fluconazole against fluconazole-resistantCandidaalbicans.Methods The minimal inhibitory concentrations (MIC80) of 22 fluconazole-resistantCandidaalbicansstrains by mangiferin in combination with fluconazole were determined by checkerboard microdilution assay.Time-kill curves and cell growth test were used to investigate the synergistic effect onCandidaalbciansgrowth process.The expression of CDR1,CDR2,MDR1 were measured by Real time RT-PCR.Results Mangiferin in combination with fluconazole could inhibit the growth ofCandidaalbicansobviously (FICI<0.5).Mangiferin and fluconazole-treated cells expressed lower level of CDR1 mRNA than the cells grown in the presence of fluconazole or mangiferin alone.Conclusions Mangiferin possessed a synergistic effect with fluconazole against fluconazole-resistantCandidaalbcians.
fluconazole-resistantCandidaalbicans;mangiferin;fluconazole
78-82]
国家973项目 (2013CB531602);国家自然科学基金 (81271798,81671991)
董怀怀,男 (汉族),硕士研究生在读.E-mail:13917511681@163.com
姜远英,E-mail:13761571578@163.com;曹颖瑛,E-mail:caoyingying608@163.com
R 379.4
A
1673-3827(2017)12-0078-05
2016-10-15 [本文编辑] 卫凤莲

