万古霉素2种不同静脉给药方案的疗效及肾毒性的分析
李雪,赵文静,臧宝赫,张玉凤
[1.徐州医科大学(江苏省麻醉学重点实验室),江苏 徐州 221004;2.徐州医科大学附属医院 重症医学科,江苏 徐州 221006]
万古霉素2种不同静脉给药方案的疗效及肾毒性的分析
李雪1,赵文静2,臧宝赫1,张玉凤1
[1.徐州医科大学(江苏省麻醉学重点实验室),江苏 徐州 221004;2.徐州医科大学附属医院 重症医学科,江苏 徐州 221006]
目的 评价万古霉素用于治疗重症监护室患者时2种不同给药方法的疗效及安全性。方法选择徐州医科大学附属医院重症医学科2014年1月-2016年3月接受万古霉素治疗的患者,共分为两组:0.5 g、8 h/次组30例(A组),治疗时间3~14 d;1.0 g、12 h/次组30例(B组),治疗时间3~18 d。收集各组患者的年龄、性别、血清肌酐(Scr)浓度、白细胞计数、中性粒细胞百分比、血清中万古霉素浓度、万古霉素治疗持续时间等数据。对两组患者的疗效及安全性进行比较,并且评价肾毒性的相关因素。结果A组谷浓度达标率(10~20μg/m l)达36.7%,B组达16.7%,差异无统计学意义(P=0.080)。A组临床有效率为73.3%,B组为66.7%,两组比较差异无统计学意义(P=0.573)。A组峰值浓度达标率(25~40μg/m l)达36.7%,B组达56.7%,差异无统计学意义(P=0.121)。但是B组的峰值浓度高于A组的峰值浓度[(23.69±10.20)vs(32.29±10.25),P=0.002]。入组的60例患者中共有11例出现肾毒性(A组1例,B组10例),差异有统计学意义(P=0.003)。结论万古霉素的2种静脉用药方法用于治疗重症监护室敏感菌群感染患者时达到的临床疗效差异无统计学意义。B组所达到的峰值浓度高于A组,且肾毒性的发生率也增高,临床上应密切监测患者血药浓度变化,警惕肾毒性的发生。
万古霉素;重症患者;静脉给药;临床疗效;肾毒性
万古霉素是东方链球菌和土壤丝菌属的三环多肽类抗生素。主要治疗耐甲氧西林金黄色葡萄球菌(包括凝固酶阳性及凝固酶阴性葡萄球菌),梭状芽孢杆菌,肠球菌等引起的感染。对疑有G+球菌感染时,在重症监医学科(intensive care unite,ICU)病房万古霉素可作为首选[1]。其抗菌机制主要为抑制细菌细胞壁的合成而杀灭细菌。近年来,随着耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)检出率的增高,万古霉素也越来越多的被用于临床。由于其治疗窗较窄(有效浓度接近中毒浓度),药代动力学个体差异较大,且治疗过程中还可能发生肾毒性、耳毒性、血小板减少等副作用[2-4],使得万古霉素的合理用药引起人们的广泛关注。本研究的目的是比较0.5 g、8 h/次与1.0 g、12 h/次这2种用药方法的疗效及安全性。
1 资料与方法
1.1 病例入组标准和排除标准
1.1.1 入组标准 ①体重指数范围18~25 kg/m2;②肾功能正常(血肌酐范围44~133μmol/L);③存在感染,病原学检测结果为革兰阳性菌(MRSA,肠球菌,腐生葡萄球菌等),药敏试验提示对万古霉素敏感。
1.1.2 排除标准 ①年龄<18岁的患者;②对万古霉素过敏或不耐受的患者;③用药前已存在肾功能不全的患者(血肌酐>133μmol/L);④使用万古霉素<48 h未达到血药稳态浓度患者。
1.2 研究对象
选择2014年1月-2016年3月徐州医科大学附属医院重症监护室的住院患者60例。将患者随机分为两组。A组30例,其中男性20例,女性10例;平均年龄(57±14)岁;合并高血压者5例,合并心脏病者3例。B组30例,其中男性26例,女性4例;平均年龄(51±20)岁;合并高血压者6例,合并心脏病者2例。两组患者在性别、年龄、Scr、基础疾病等方面比较,差异无统计学意义。见表1。根据痰液、血液、尿液及分泌物等的细菌学检查结果,诊断或拟诊为MRSA、溶血性葡萄球菌、粪/屎肠球菌、表皮葡萄球菌等的患者给予万古霉素治疗。这些菌群的化验结果均提示最低抑菌浓度(minimum inhibitory concentration,MIC)≤2,故认为均为敏感菌群。从疾病分布看,肺部感染39例(19 vs 20),血流感染16例(9 vs7),颅内感染3例(1 vs 2),胸腔感染2例(1 vs1)。可见两组患者均为肺部感染所占比例较高,考虑与重症监护室病种比例特殊有关。本研究符合医院伦理学标准,并经医院伦理委员会批准,取得患者或家属知情同意。
1.3 万古霉素给药方案
A组以注射用万古霉素(稳可信,日本Eli Lilly Japan k.k.Seishin Laboratories公司),规格为500mg/瓶。使用时用0.9%的生理盐水或5%葡萄糖配制,0.5 g,8 h/次,静脉输注时间为1~2 h。B组则以注射用万古霉素1.0 g,12 h/次,输注时间为1~2 h。
1.4 联合用药情况
A组单独使用万古霉素2例,联用1种抗生素的22例,联用2种抗生素的6例;B组分别为1例、22例、7例。联用的抗生素有美罗培南、氨曲南、头孢地嗪、氟康唑、卡泊芬净及亚胺培南等。其中1例联用环丙沙星,但是并没有发生肾毒性。
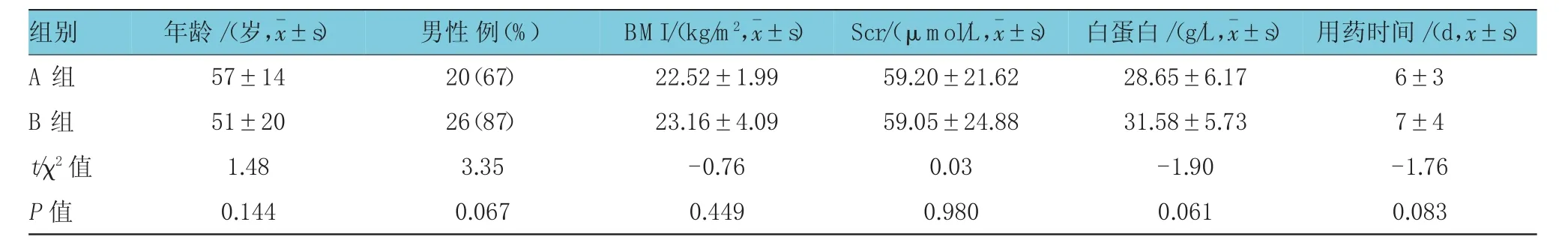
表1 两组患者的基本特征 (n=30)
1.5 检测指标及方法
记录患者用药前的病原学(痰液、血液、分泌物等)检查结果。A组和B组均分别于用药前(0),用药后第1、2、4、7 d的05∶00~05∶30留取血液标本,送至医院检验科,记录白细胞计数及中性粒细胞百分比等,并且记录这5 d患者的最高体温。待血药浓度达到稳态后(用药达48 h)送检患者的血液标本,检查血药浓度(谷浓度采血时间为给药前,峰值浓度为给药后30~60min)。
1.5.1 疗效评价 疗效标准参照卫生部1993年颁布的《抗菌药物研究指导原则》,按照治愈和无效进行评价。①治愈:症状、体征、实验室检查及病原学检查4项均恢复正常;②显效:病情明显好转,但上述4项有1项未完全恢复正常;③进步:用药后病情有所好转,但不够明显;④用药72 h后病情无明显进步或有加重者。其中治愈、显效及进步统称为临床有效。
1.5.2 安全性评价 肾毒性判断:应用万古霉素后若连续出现2次甚至2次以上的血肌酐升高(增加44.2μmol/L,或者比基线升高≥50%,以较高者为准),并且没有其他原因可以解释时,可以认为是万古霉素引起的肾毒性。
系统由控制中心AT89S52单片机元件模块,GSM移动通信模块,传感器模块(此处包括红外传感器和烟雾传感器模块),报警模块,按键输入模块,数码管显示模块以及遥控撤防模块等六部分模块组成。系统组成如图2所示。
1.6 统计学方法
使用SPSS13.0统计软件分析数据,计量资料以均数±标准差(±s)表示,采用两独立样本t检验,计数资料用率表示,采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血药浓度
A组谷浓度为(9.78±5.36)μg/ml,B组为(9.83±8.21)μg/ml,差异无统计学意义(P=0.981)。然而,A组的峰浓度为(23.69±10.20)μg/ml,B组为(32.29±10.25)μg/ml,差异有统计学意义(P=0.002)。见表2。
2.2 两组临床疗效比较
A组临床有效率为73.3%(进步为63.3%,显效为 10.0%),B组临床有效率为 66.7%(进步为53.4%,显效为13.3%),两组比较,差异无统计学意义(χ2=0.317,P=0.573)。
2.3 不良反应发生情况
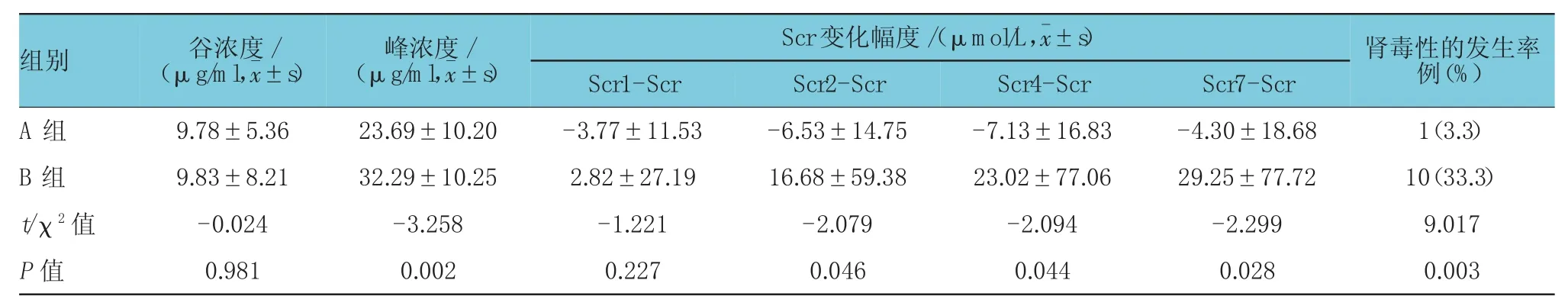
表2 万古霉素应用后各项指标的变化情况 (n=30)
3 讨论
近年来,革兰阳性球菌感染的比例越来越高,尤其是MRSA已经成为院内感染的重要病原菌。因此,万古霉素在临床上的应用比例也相应的有所提高[5]。
万古霉素是三环多肽类抗生素,是目前多种临床治疗指南推荐治疗MRSA的首选药物[6]。主要用于治疗MRSA、青霉素不敏感的肺炎链球菌及耐药肠球菌感染的治疗。目前国内尚无有关耐万古霉素金葡菌分离株的报道。迄今为止共报道了34例耐万古霉素金葡菌,其中1例在巴基斯坦,4例在伊拉克,13例在美国,16例出现在印度[7-8]。万古霉素的作用机制主要是与细菌细胞壁的氨基酸残基末端D一丙氨酰一D一丙氨酸(D-Ala-D-Ala)结合,阻止细胞壁的生物合成[9]。万古霉素是时间依赖性抗生素且具有抗生素后效应,治疗效果与血药浓度超过MIC的时间占给药期间百分比有关[11]。增大给药剂量、缩短给药时间间隔并不能改善药效,反而会增加不良反应的发生率。美国指南建议当AUC24/MIC≥400即可认为临床有效,但是由于当MIC超过1.5~2mg/L时就很难达到这个目标[12]。所以,2009年美国建康药剂师协会,美国传染病协会,传染病药剂师协会制定指南,将AUC24/MIC≥400改成万古霉素谷浓度达到10~20mg/L[12]。本研究中A组患者的谷浓度达标率(10~20μg/m l)较B组高,临床有效率亦较B组高。临床上应用万古霉素过程中需动态监测血药浓度,使得血药浓度达到指南规定的标准,提高临床疗效。
本研究中谷浓度与峰浓度的达标率均较低,这与重症监护室患者的身体状况有关。由于ICU患者基础情况较差,循环多不稳定,多数患者在用药期间都合用多巴胺、呋塞米、去甲肾上腺素等能提高血流动力学和肾脏血流量的药物,有研究发现[13],此类药物能干扰肾脏离子转运体系,从而使肾小球滤过率和肾小管分泌作用增强,肌酐清除率升高,导致万古霉素的血药浓度下降。此外,部分患者合并有胸腔积液、低蛋白血症,此时细胞外液容积改变会使得万古霉素血药浓度降低[14]。因此,在以后的用药期间要综合考虑患者病因、合并症等多方因素,结合血药浓度,及时调整给药方案,使得血药浓度达到治疗水平,从而提高万古霉素的治疗效果。
本研究纳入的60例患者中,共11例发生肾毒性,其中B组占10例(其中2例发生在用药后的第1天,3例发生在用药后的第2天,5例发生在用药后的第7天)。万古霉素的肾毒性的发生机制尚不清楚,可能与万古霉素中所含的杂质有关[15]。目前一些动物实验表明万古霉素肾毒性与其损害肾小球并导致近端肾小管发生缺血坏死有关,其机制主要是万古霉素导致了氧化应激反应所致[16-17]。有研究表示高谷浓度(>20mg/L)、高峰浓度(>40μg/ml)都是增加肾毒性发生率的风险因素[18-20]。ZIMMERMANN等[22]的研究中,无肾毒性组与肾毒性组的峰值浓度的差异存在统计学意义,峰浓度平均值分别为(29.7±7.0)μg/ml与(44.5±9.8)μg/ml。本研究中B组谷值浓度>20μg/ml的患者有4例(13.3)高于A组的1例(3.3%)。此外,B组患者的峰浓度高于A组,且B组中峰值度>40μg/ml的患者有6例(20%)高于A组的2例(6.6%)。从用药后的第2天开始,患者的肌酐变化幅度差异有统计学意义,变化幅度B组>A组,且B组的肌酐值升高速度越来越快,说明肾功能损伤的速度在加快。因此,B组肾毒性的发生率高于A组。在万古霉素应用过程中不仅要密切监测谷浓度,同时要动态监测峰浓度,尽量使谷、峰浓度维持在治疗范围内,从而减少副作用的发生率。临床上一旦出现肾毒性,应立即减小药物用量或停药。为了更好地验证年龄、血肌酐、谷浓度、峰浓度、蛋白与肾毒性的相关性,仍需要进行大样本的临床研究。
[1]李昂,段美丽,翁以炳,等.ICU病房病原菌的分布及其耐药性分析[J].中国现代医学杂志,2006,16(14):2186-2189.
[2]GUPTA A,BIYANI M,KHAIRA A.Vancomycin nephrotoxicity: myths and facts[J].The Netherlands Journal of Medicine,2011, 69(9):379-383.
[3]ROSZELL S,JONES C.Intravenous administration issues:a comparison of intravenous insertions and complications in vancomycin versus other antibiotics[J].Journal of Infusion Nursing: the Official Publication of the Infusion Nurses Society,2010,33 (2):112-118.
[4]MOH'D H,KHEIR F,KONG L,et al.Incidence and predictors of vancomycin-associated nephrotoxicity[J].Southern Medical Journal,2014,107(6):383-388.
[5]PLETZ M W,BURKHARDT O,WELTE T.Nosocomial methicillin-resistant Staphylococcus aureus (MRSA)pneumonia:linezolid or vancomycin-Comparison of pharmacology and clinical efficacy[J].European Journal of Medical Research,2010,15(12): 507-513.
[6]RYBAK M J,LOMAESTRO B M,ROTSCHAFER J C,et al. Vancomycin therapeutic guidelines:a summary of consensus recommendations from the infectious diseases society of america,the american society of health-system pharmacists,and the society of infectious diseases pharmacists[J].Clinical Infectious Diseases, 2009,49(3):325-327.
[7]GOULD I M.VRSA-doomsday superbug or damp squib[J].The Lancet Infectious Diseases,2010,10:816-818.
[8]MORAVVEJ Z,ESTAJI F,ASKARI E,et al.Update on the global number of vancomycin-resistant Staphylococcus aureus (VRSA)strains[J].International Journal of Antimicrobial Agents, 2013,42:370-371.
[9]LOWY F D.Antimicrobial resistance:the example of Staphylococcus aureus[J].The Journal of Clincal Investigation,2003,111 (9):1265-1273.
[10]CERVERA C,CASTAN EDA X,DE LA MARIA C G,et al. Effect of vancomycin minimal inhibitory concentration on the outcome of methicillin-susceptible Staphylococcus aureus endocarditis[J].Clinical Infectious Diseases,2014,58(12):1668-1675.
[11]MOISE-BRODER P A,FORREST A,BIRMINGHAM M C,et al.Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections[J].Clinical Pharmacokinetics,2004,43(13):925-942.
[12]RYBAK M J,LOMAESTRO B M,ROTSCHAFER J C,et al. Therapeutic monitoring of vancomycin in adults summary of consensus recommendations from the american society of health-system pharmacists,the infectious diseases society of america,and the society of infectious diseases pharmacists[J].Pharmacotherapy,2009,29(11):1275-1279.
[13]PEA F,PORRECA L,BARALDO M,et al.High vancomycin dosage regimens required by intensive care unit patients cotreated with drugs to improve haemodynamics following cardiac surgical procedures[J].The Journal of Antimicrobial Chemotherapy,2000,45(3):329-335.
[14]PEA F,VIALE P,FURLANUT M.Antimicrobial therapy in critically ill patients:a review of pathophysiological conditions responsible for altered disposition and pharmacokinetic variability[J].Clinical Pharmacokinetics,2005,44(10):1009-1034.
[15]陈红,李小惠,李为民,等.万古霉素治疗耐甲氧西林金黄色葡萄球菌肺炎老年患者的疗效分析 [J].中国感染与化疗杂志,2015, 15(5):434-438.
[16]KING D W,SMITH M A.Proliferative responses observed following vancomycin treatment in renal proximal tubule epithelial cells[J].Toxicology In Vitro,2004,18(6):797-803.
[17]CETIN H,OLGAR S,OKTEM F,et al.Novel evidence suggesting an anti-oxidant property for erythropoietin on vancomycin-induced nephrotoxicity in a rat model[J].Clinical and Experimental Pharmacology and Physiology,2007,34(11): 1181-1185.
[18]VAN HAL S J,PATERSON D L,LODISE T P.Systematic review and meta-analysis of vancomycin-induced nephrotoxicity associated with dosing schedules that maintain troughs between 15 and 20 milligrams per liter[J].Antimicrobial Agents and Chemotherapy,2013,57(2):734-744.
[19]GOLDMAN J L,HARRISON C J,MYERS A L,et al.No evidence of vancomycin minimal inhibitory concentration creep or heteroresistance identified in pediatric Staphylococcus aureus blood isolates[J].Pediatric Infectious Disease Journal,2014,33 (2):216-218.
[20]SAUGEL B,GRAMM C,WAGNER J Y,et al.Evaluation of a dosing regimen for continuous vancomycin infusion in critically ill patients:an observational study in intensive care unit patients[J].Journal of Critical Care,2014,29(3):351-355.
[21]LODISE T P,PATEL N,LOMAESTRO B M,et al.Relationship between initial vancomycin concentration-time profile and nephrotoxicity among hospitalized patients[J].Clinical Infectious Diseases,2009,49(4):507-514.
[22]ZIMMERMANN A E,KATONA B G,PLAISANCE K I.Association of vancomycin serum concentrations with outcomes in patients with gram-positive bacteremia[J].Pharmacotherapy,1995, 15(1):85-91.
[23]STRATTON C W,LIU C,WEEKS L S.Activity of LY146032 compared with that of methicillin,cefazolin,cefamandole,cefuroxime,ciprofloxacin,and vancomycin against staphylococci as determined by kill-kinetic studies[J].Antimicrobial Agents And Chemotherapy,1987,31(8):1210-1215.
(张蕾 编辑)
Efficacy and nephrotoxicity of Vancom ycin adm inistrated by two different intravenous regimens
Xue Li1,Wen-jing Zhao2,Bao-he Zang1,Yu-feng Zhang1
(1.Jiangsu Provincial Key Laboratory of Anesthesiology,Xuzhou Medical University,Xuzhou, Jiangsu 221004,China;2.Departmentof Intensive Care Medicine,the Affiliated Hospital, Xuzhou Medical University,Xuzhou,Jiangsu 221006,China)
ObjectiveTo evaluate the clinical-efficacy and safety of Vancomycin in two administration methods for treating patients in intensive care unit.MethodsSixty patients treated with Vancomycin in the Intensive Care Unit of the Hospital Affiliated to Xuzhou Medical University from January 2014 to March 2016 were enrolled,and randomly divided into two groups,each group had 30 patients.The patients in group A were administrated 0.5 g Vancomycin every 8 h for 3-14 d,while those in group B received 1.0 g Vancomycin every 12 h for 3-18 d. Patient's age,sex,serum creatinine(Scr),leucocyte count,neutrophil percentage,serum Vancomycin concentrations and course of treatmentwere recorded.The clinicalefficacy and safetywere compared between the two groups and the factors related to renal toxicity were evaluated.ResultsThe compliance rate ofminimal concentration(10-20μg/ml) reached 36.7%in the group A while 16.7%in the group B(P=0.080).The clinical effective rate was 73.3%in the group A,and 66.7%in the group B(P=0.573).The compliance rate of peak concentration(25-40μg/m l)reached36.7%in the group A while 56.7%in the group B (P=0.121).The peak concentration of the group B was significantly higher than thatof the group A[(23.69±10.20)vs(32.29±10.25),P=0.002].Acute renal dysfunction was reported in 1 patient(3.3%)of the group A and 10 patients(33.3%)of the group B (P=0.003).ConclusionsThere is no significant difference in the clinical efficacy between the two intravenous administration ways of Vancomycin.The peak concentration of the group B (1.0 g,q12h)is significantly higher than that of the group A (0.5 g,q8h),and the incidence of renal toxicity is significantly higher than that of the group A.Doctors should closelymonitor the change of serum drug concentration and be alert to the occurrence of renal toxicity.
Vancomycin;critical patient;intravenous administration;clinical efficacy;renal toxicity
R 453.2;R 969.3
A
10.3969/j.issn.1005-8982.2017.07.019
1005-8982(2017)07-0085-05
2016-08-08
赵文静,E-mail:zhaowj886@sina.com

