产丙谷二肽重组大肠杆菌的构建及发酵优化
何艳春, 刘沛沛, 张震宇*, 孙付保, 沈 松
(1.江南大学 生物工程学院,江苏 无锡 214122;2.工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
产丙谷二肽重组大肠杆菌的构建及发酵优化
何艳春1,2,3, 刘沛沛1,2,3, 张震宇*1,2,3, 孙付保1,2,3, 沈 松1,2,3
(1.江南大学 生物工程学院,江苏 无锡 214122;2.工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
SAET基因编码的α-氨基酸酯酰基转移酶能够以丙氨酸甲酯盐酸盐和谷氨酰胺为底物缩合生成L-丙氨酰-L-谷氨酰胺.为了使α-氨基酸酯酰基转移酶能够在大肠杆菌中过量表达,在保证氨基酸序列不变的前提下,优化密码子和mRNA二级结构,共改变了396个碱基,GC含量由原来的42.15%升高到48.22%;将优化后的基因分别与phoC启动子和色氨酸串联启动子相连并插入到不同质粒中,将重组质粒转入大肠杆菌,DH5α/pET21a-phoC-SAET产量最高。通过对重组大肠杆菌生产L-丙氨酰-L-谷氨酰胺的条件研究发现,最佳培养基是:葡萄糖15 g/L,酵母提取物10 g/L,胰蛋白胨10 g/L,NH4AC 5 g/L,KH2PO46.75 g/L,K2HPO42.25 g/L,MgSO4·7H2O 0.5 g/L。最适转化条件是:将发酵液加入到含Ala-OMe·HCl 100 mmol/L,Gln 50 mmol/L的pH 9的溶液中,25℃反应1.5 h。优化后产量达到383 mg/L,是优化前的3.9倍。
重组大肠杆菌;基因优化;α-氨基酸酯酰基转移酶;发酵条件优化
近年来,谷氨酰胺(Gln)作为特殊的免疫营养素成为各学科领域的研究热点,尤其在机体应激状态下对维护肠道结构和免疫功能的完整性具有不可替代的作用[1],谷氨酰胺被认为是应激状态下的“条件必需氨基酸”,比如在断奶仔猪、鸡和鱼类等饲料中添加谷氨酰胺可提高机体免疫功能和抗病能力。然而谷氨酰胺水溶性差(36 g/L),在加热条件下易生成有毒的焦谷氨酸和氨,限制了其在临床上的应用。相对应的,含L-谷氨酰胺的小肽,尤其是L-丙氨酰-L-谷氨酰胺(L-alanyl-L-glutamine,丙谷二肽),由于具有高热稳定性和水溶性(586 g/L)[2-3],在体内能够迅速地分解为L-谷氨酰胺等优点引起了国内外的广泛关注,该小肽能够弥补谷氨酰胺的不足,扩大了其在临床上作为静脉营养制剂的应用范围.
目前主要是通过化学合成的方法来合成L-丙氨酰-L-谷氨酰胺,通常有以下三种方法:1)N-羰基-丙氨酸酐法[4],该法虽不需要保护基团,但易产生三肽等副产物,导致产物收率低;2)使用保护基法[5-6],该法需要引入和去除保护基团,同时需要用到有毒试剂,对环境有一定的破坏力;3)D-2-卤-丙酰-L-谷氨酰胺氨解法[7]。然而目前这些化学合成方法通常合成过程复杂,中间环节多,易生成副产物,目的产物提纯困难,合成条件苛刻,常常使用一些有毒有害物质。
随着现代工业生物技术发展,利用微生物酶法进行丙谷二肽生物合成引起了研究者们的兴趣。Kazuhiko Tabata等[8]人发现在Bacillus subtilis 168中ywfE基因编码一种L-氨基酸连接酶,此酶能够催化游离的L-丙氨酸和L-谷氨酰胺合成L-丙氨酰-L-谷氨酰胺,副产物较少,通过摇瓶实验,发酵合成L-丙氨酰-L-谷氨酰胺的质量浓度为0.12 g/L。Tabata等[9]利用大肠杆菌过表达L-氨基酸连接酶,以葡萄糖和铵盐为底物直接合成丙谷二肽。Yoshinori Hirao等[10]筛选到了一株能表达α-氨基酸酯酰基转移酶的菌,该酶能以L-丙氨酸甲酯盐酸盐和L-谷氨酰胺为底物合成L-丙氨酰-L-谷氨酰胺。
中国的丙谷二肽产品主要依靠进口,然而国外产品采用的工艺合成成本高,步骤多,因而价格高。微生物酶法合成丙谷二肽具有反应条件温和、环境污染少、产率高、成本低等优点,利用微生物酶法合成丙谷二肽并将其产业化具有现实意义。目前尚未发现国内研究者利用微生物酶法进行丙谷二肽合成的相关报道,因此,作者尝试构建一株产丙谷二肽的重组大肠杆菌,并对其生长和反应条件进行初步优化。主要从以下几个方面来开展实验:Sphingobacterium siyangensis密码子偏好性与大肠杆菌相差较大,作者通过密码子优化,使得α-氨基酸酯酰基转移酶更加适合在大肠杆菌中表达;在外源基因的表达中,质粒的种类也是影响蛋白质表达的一个重要因素。本研究通过优化质粒,并选择与其相匹配的宿主菌来提高重组菌产丙谷二肽的能力;发酵培养基是影响重组菌生长和产酶的重要因素,同时,催化反应条件能影响酶活性,本研究通过优化培养基与催化反应条件,使其更易积累丙谷二肽。
1 材料与方法
1.1 材料
L-丙氨酰-L-谷氨酰胺 (纯度>98%,HPLC):TCI公司;L-谷氨酰胺(BR):国药集团;L-丙氨酸甲酯盐酸盐 (纯度>99%,BR):萨恩化学技术有限公司;邻苯二甲醛(纯度>99%,HPLC):Sigma公司。
1.2 菌株与质粒
大肠杆菌 JM109,DH5α,BL21(DE3),质粒pES-Ptrp2-Hyp,pUC19,pAMP,pET21a,pET28a:均为作者所在实验室保藏。
1.3 氨基酸酯酰基转移酶的优化改造
根据大肠杆菌密码子偏好性使用J cat软件对Sphingobacterium siyangensis中α-氨基酸酯酰基转移酶肽段的编码序列进行密码子优化,使GC含量值接近大肠杆菌;为了便于酶切操作,根据同义密码子原理消除酶切位点;使用RNA structure软件优化RNA翻译起始区的二级结构,促进翻译的顺利进行。优化后的序列直接连在phoC启动子[11-13]的下游,由旭冠公司进行全基因合成,并与载体pUC19连接。
1.4 表达载体的构建
以pUC19-phoC-SAET为模板,以P上和P下为引物,所用引物见表1。PCR扩增:94℃预变性5 min,94℃变性30 s,52℃退火 30 s,72℃延伸2 min,30个循环,72℃终延伸10 min。将PCR产物与pUC19-Ptrp2-Hyp载体一起用BamHⅠ,HindⅢ双酶切,胶回收SAET与pUC19-Ptrp2片段,过夜连接构建pUC19-Ptrp2-SAET,转化E.coli JM109,挑取阳性克隆至LB中过夜培养,提取质粒,单、双酶切验证,将验证正确的克隆子进行DNA测序。
将验证正确的重组质粒pUC19-phoC-SAET与pAMP、pET21a、pET28a同时进行EcoRⅠ、HindⅢ双酶切,胶回收载体与phoC-SAET片段,过夜连接构建 pAMP-phoC-SAET、pET21a-phoC-SAET、pET28a-phoC-SAET。
将pES-Ptrp2-SAET与pUC19、pAMP、pET21a、pET28a进行EcoRⅠ、BamHⅠ双酶切,胶回收后,过夜连接,构建重组质粒pUC19-Ptrp2-SAET、pAMPPtrp2-SAET、pET21a-Ptrp2-SAET、pET28a-Ptrp2-SAET。

表1 实验所需引物Table 1 Primers used in this study
1.5 细胞培养条件
接种一环重组大肠杆菌于LB培养基中,30℃、220 r/min过夜培养,按2%接种体积分数接种至装有30 mL LB培养基的250 mL摇瓶中,30℃、220 r/min振荡培养8 h,按5%接种体积分数接种至装有25 mL发酵培养基SF(20 g/L葡萄糖,10 g/L胰蛋白胨,10 g/L酵母提取物,5 g/L (NH4)2SO4,3 g/L KH2PO4,1 g/L K2HPO4,0.5 g/L MgSO4·7H2O)的250 mL摇瓶中,22℃、220 r/min振荡培养36 h。
1.6 完整细胞生产丙谷二肽的反应条件
取0.5 mL发酵液,加入500 μL含有200 mmol/L Gln,200 mmol/L Ala-OMe·HCl,pH 8.5的底物溶液,混匀后置25℃恒温水浴锅中反应2 h,加入等体积的体积分数1.7%H3PO4溶液终止反应,12 000 r/min离心5 min,取上清液按1.8所述测定丙谷二肽质量浓度。
1.7 酶活的测定
取0.5 mL发酵液,加入500 μL含有200 mmol/L Gln,200 mmol/L Ala-OMe·HCl,pH 9的 0.1 mol/L硼酸-NaOH缓冲液,混匀后置25℃恒温水浴锅中反应5 min,加入等体积的体积分数1.7%H3PO4溶液终止反应,12 000 r/min离心5 min,取上清液做柱前衍生。(一个酶活单位定义为1 mL发酵液在1 min内生成1 μmol产物所需酶量)
1.8 丙谷二肽的检测
1)OPA衍生:取标准样品或是反应液50 μL,加入200 μL甲醇,200 μL 0.1 mmol/L四硼酸钠,50 μL衍生试剂(50 mg邻苯二甲醛,加入4.5 mL甲醇溶解,加入500 μL 0.1 mmol/L四硼酸钠,50 μL β-巯基乙醇,混匀置4℃,可保存一周)混匀,于37℃恒温水浴锅中水浴25 min。加入500 μL流动相溶解,0.22 μm有机系膜过滤,取10 μL做HPLC分析。
2)HPLC检测:采用高效液相色谱法检测L-丙氨酰-L-谷氨酰胺的浓度,色谱条件如下:色谱柱为X-bridge C18(4.6 mm×250 mm,5 μm);柱温为40℃;流动相为12.5 mmol/L磷酸缓冲液(pH 7.2)∶乙腈=83∶17;流速为1 mL/min。
1.9 发酵优化
主要优化培养基成分 (碳源种类及浓度的优化、氮源种类及质量浓度的优化、磷酸盐浓度的优化)、种龄的优化和酶催化反应条件,具体包括pH(8、8.5、9、9.5、10),温度(10、15、20、25、30、35℃),酶与底物反应时间(0.5、1、1.5、2、2.5 h),两种底物浓度比 (Ala-OMe·HCl∶Gln=100∶50,100∶100,100∶150,100∶200,100∶250,200∶200)。
2 结果与讨论
2.1 α-氨基酸酯酰基转移酶基因的优化
密码子的选择是影响表达的因素之一,由于遗传密码子的简并性,绝大多数氨基酸都由几种密码子来编码。然而,E.coli对编码同一种氨基酸的各种密码子的使用频率并不相同,甚至相差很大[14]。稀有密码子的存在可大大降低蛋白质合成的效率,使蛋白质的表达量降低,甚至使蛋白质合成中途停止[15]。因此,用E.coli使用频率高的密码子替换稀有密码子,可提高α-氨基酸酯酰基转移酶的表达水平。
α-氨基酸酯酰基转移酶来源于Sphingobacterium siyangensis,基因序列全长1 860 bp,共编码619个氨基酸。通过数据库(http://www. kazusa.or.jp/codon/) 分 析 大 肠 杆 菌 K12 和Sphingobacterium siyangensis的密码子使用频率,结果表明两者差异较大。比如在 Sphingobacterium siyangensis中UGG使用频率为47.8%,而在大肠杆菌 中 仅 为 10.7% ;GGA 在 Sphingobacterium siyangensis的使用频率为32.6%,而在大肠杆菌中仅为9.2%。因此,首先使用网页(http://www.jcat.de/)进行密码子优化,CAI值[16]由原来的0.26升高到1.0,表明优化后的SAET基因更适于在大肠杆菌中表达。然后经过DNAMAN软件分析,优化后的SAET基因序列中有EcoRⅠ这个酶切位点,为了便于实验操作,通过同义转化消除EcoRⅠ这个位点,最后使用软件RNA Structure 5.3对优化后的SAET进行mRNA二级结构预测。预测结果表明,优化后基因序列5’端处于闭环状态,不利于与核糖体结合,手动调整5’端核苷酸,使得5’端为开环状态,结果见图1。同时用在大肠杆菌中使用频率较高的密码子替换频率低的,调整预测结果中存在的大茎环结构,降低核糖体结合mRNA的势能,共改变78个碱基,吉布斯自由能(ΔG)由原来的△G=-525.8 kcal/mol改变为△G=-507.5 kcal/mol。经过以上三步优化共改变384个碱基,改变了350个密码子,GC含量由原来的42.15%上升至48.22%,更加接近大肠杆菌中的GC含量(50.18%),最终优化结果见表2。
2.2 重组大肠杆菌的构建
2.2.1 质粒的优化 由于启动子强度的不同,可产生不同强度的基因表达水平,弱启动子能够在维持细胞正常代谢生长的前提下表达目的产物,而强启动子虽能大量表达目的蛋白质,但往往对菌体产生代谢负担。合成的pUC19-phoC-SAET由phoC启动子调控α-氨基酸酯酰基转移酶表达,phoC是一个弱启动子,为了比较不同强度的启动子对表达α-氨基酸酯酰基转移酶的影响,作者在α-氨基酸酯酰基转移酶基因上游引入一个强启动子(色氨酸串联启动子)构建一个由色氨酸串联启动子调控目的基因表达的重组质粒。该启动子是一个由两个色氨酸启动子串联而成的强启动子,全长237 bp,5′端为EcoRⅠ酶切位点,3’端为HindⅢ酶切位点。
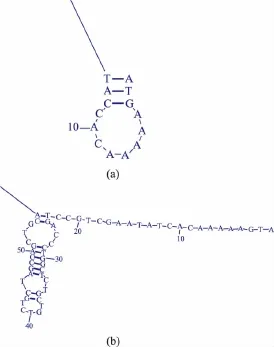
图1 优化前与优化后的α-氨基酸酯酰基转移酶mRNA 5’端二级结构预测Fig.1 α-amino acid ester acyltransferase’s potential mRNA secondary structures of unadjusted and adjusted
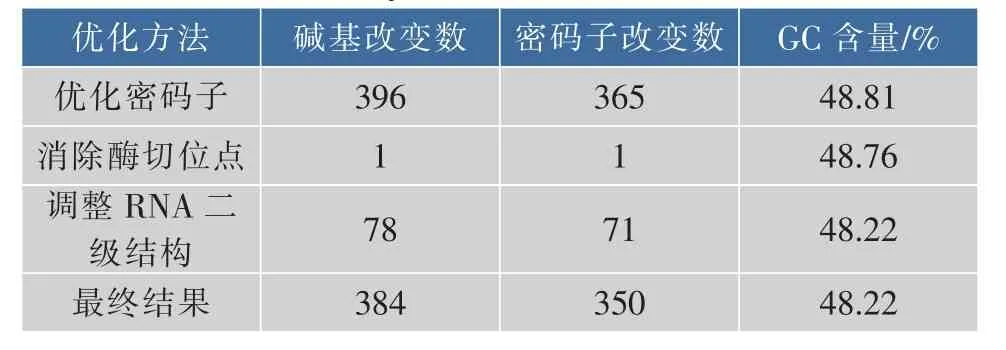
表2 α-氨基酸酯酰基转移酶优化结果Table 2 Results of codon optimization process α-amino acid ester acyltransferase
pUC19-phoC-SAET经单、双酶切,结果见图2。3株菌单、双酶切验证均正确,经DNA测序该序列完全正确。以验证正确的pUC19-phoC-SAET为模板,P上和P下为引物,进行PCR扩增。将PCR产物与载体pES-Ptrp2-Hyp连接,构建由色氨酸串联启动子调控目的基因表达的重组质粒pES-Ptrp2-SAET,转化E.coli JM109,提取质粒,单、双酶切验证结果见图3-4,经DNA测序该序列完全正确。
影响外源基因表达水平的因素很多,除启动子外,质粒的种类也是影响蛋白质表达的一个重要因素,接下来通过构建不同质粒来考察各质粒产丙谷二肽的能力。将pUC19-phoC-SAET和pES-Ptrp2-SAET双酶切,胶回收目的片段,将连有Ptrp2启动子和连有phoC启动子的α-氨基酸酯酰基转移酶基因片段分别连接在 pUC19、pAMP、pET21a、pET28a上,构建重组质粒 pUC19-Ptrp2-SAET、pAMP-Ptrp2-SAET、pET21a-Ptrp2-SAET、pET28a-Ptrp2-SAET、pUC19-phoC-SAET、pAMP-phoCSAET、pET21a-phoC-SAET、pET28a-phoC-SAET。将构建的9个重组质粒转入E.coli JM109,经摇瓶发酵测产量,结果见图5。当载体是pET系列(pET21a,pET28a)时,含有phoC启动子的实验组(A、B)丙谷二肽产量高于含Ptrp2启动子的实验组(F、G);当载体是pUC19系列(pUC19,pAMP)时,情况则刚好相反,含有phoC启动子的实验组(C、D)比含Ptrp2启动子的(H,I组)产丙谷二肽能力弱。另外,pES也是由pUC19改造的,它的丙谷二肽产量(E)与pUC19系列(C、D)水平相当。A,F和I组产量显著高于其他组,分别达到96、92、72 mg/L,因此选择A组质粒。其中A、F组均为pET21a质粒,表明pET21a较其他质粒而言,可能更加适合α-氨基酸酯酰基转移酶的表达。
图3 PCR产物Fig.3 Products of PCR
图4 pES-Ptrp2-SAET单、双酶切电泳结果Fig.4 Single,double digest of pES-Ptrp2-SAET

图5 不同重组质粒对丙谷二肽产量的影响Fig.5 Effect of different recombinant expression vectors
2.2.2 宿主菌的优化 重组质粒在不同宿主菌中的稳定性差别较大,宿主菌的细胞遗传特性会影响重组质粒的复制和传递,最终影响重组质粒的稳定性[17],因此选择适合的宿主细胞显得非常重要。在上面质粒优化基础上,通过考察质粒与宿主匹配性来选择质粒相对应的宿主菌,将pET21a-phoC-SAET转入大肠杆菌JM109、DH5α、BL21(DE3)中,摇瓶发酵结果见表3。宿主菌DH5α不管是产量还是酶活都是最高的,因此选择DH5α/pET21a-phoC-SAET为生产菌。

表3 不同重组大肠杆菌的丙谷二肽产量与酶活Table 3 Yield and α-amino acid ester acyltransferase activity of different recombinant strains
2.3 发酵优化
影响发酵的因素很多,通常可分为发酵培养基和发酵条件两个方面。通过对发酵培养基进行初步优化来考察该重组菌发酵产丙谷二肽的能力。
2.3.1 培养基优化
1)种子生长曲线的绘制:种子培养是为了获得足够多生长代谢旺盛的菌体。以重组菌 DH5α/ pET21a-phoC-SAET为出发菌株,绘制重组菌的生长曲线,结果见图6。由图6可知,菌体接入培养基LB中,4 h后进入对数生长期,4~12 h为对数生长期,14 h后进入稳定期。一般在对数生长中后期,菌体的代谢活性较高,生命力强,种子活力较好。因此选择最佳种龄为10 h。

图6 重组菌DH5α/pET21a-phoC-SAET生长曲线Fig.6 Growth curve of recombinant E.coli DH5α/ pET21a-phoC-SAET
2)碳源的优化:在基因工程菌发酵过程中,培养基的组成既要提高工程菌的生长速率,又要保证外源基因能够有效表达,碳源种类对菌体生长和外源基因表达有较大影响。采用葡萄糖、甘油、乳糖、糊精、可溶性淀粉为碳源,添加量为20 g/L,考察碳源种类对丙谷二肽积累量的影响,结果见图7(a)。由图7可知,以葡萄糖为碳源时丙谷二肽产量最高,远高于乳糖、糊精等碳源,得出葡萄糖是适合丙谷二肽积累的碳源。进一步考察葡萄糖质量浓度对丙谷二肽的影响,结果见图7(b)。由图可知,随着葡萄糖质量浓度的升高,丙谷二肽产量先逐步上升,在葡萄糖质量浓度大于15 g/L时,丙谷二肽产量逐步下降,因此最佳质量浓度为15 g/L。

图7 碳源优化Fig.7 Optimization of different carbon source
3)氮源的优化:培养基中的氮源能为微生物提供生长所必需的核苷酸、维生素和矿物质元素等。氮源的种类对微生物的生长有着较大的影响,分别采用0.1 mol/L的尿素、硫酸铵、氯化铵、乙酸铵作为培养基的无机氮源,考察不同种类氮源对丙谷二肽积累的影响,结果见图8(a)。由图8可知,乙酸铵作为氮源时,丙谷二肽产量达到353 mg/L,是硫酸铵的两倍多,远远高于其他种类的氮源。这可能是因为乙酸铵不仅提供氮元素,还提供乙酸根离子。考察乙酸铵质量浓度(0、5、10、15、20、25 g/L)对产丙谷二肽的影响,结果见图8(b)。由图8可知,乙酸铵质量浓度在5 g/L时,丙谷二肽产量最高,在乙酸铵质量浓度大于20 g/L时能够抑制大肠杆菌的生长。与无机氮源相比,有机氮源除含有丰富的蛋白质、肽类、游离的氨基酸以外,还含有少量的糖类、脂肪和生长因子等。因此,分别采用蛋白胨、鱼粉蛋白胨、胰蛋白胨、酵母膏、牛肉浸膏、酵母提取物作为重组菌发酵的有机氮源,添加量为20 g/L,考察不同有机氮源对重组菌产丙谷二肽的影响,结果见图8(c)。由图8可知,以酵母提取物与胰蛋白胨为有机氮源时,丙谷二肽产量高于其他氮源,接下来考察不同比例的两种有机氮源对产量的影响。结果表明,当两种底物以1∶1的比例添加时,与单独添加一种有机氮源相比,丙谷二肽产量更高,因此,选择有机氮源的添加为:胰蛋白胨10g/L,酵母提取物10g/L。
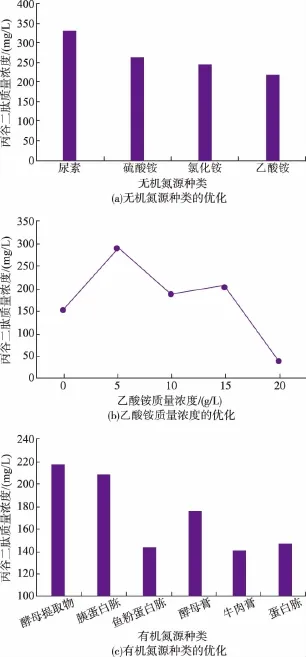
图8 氮源的优化Fig.8 Optimization of different inorganic nitrogen source
4)磷酸盐浓度的优化:在微生物生长代谢过程中,少量无机盐或其他营养因子起着极其重要的作用。作者所在实验室构建的重组菌中含有一个phoC启动子,该启动子由磷酸盐浓度调控。因此考察磷酸盐浓度对重组菌发酵产丙谷二肽的影响,结果见图9。由图可知,在磷酸盐浓度为36、48 mmol/L时,丙谷二肽产量稍高于其他实验组。整体来看,磷酸盐浓度对丙谷二肽积累量的影响不大。当培养基中不添加磷酸盐时,丙谷二肽的产量为248.9 mg/L,培养基中只能提供少量磷酸根,不能满足大量菌体生长的需要,同时因为缺乏磷酸根启动目的蛋白质的表达,因此产量仅略低于其他组。随着磷酸盐浓度的增大,丙谷二肽产量逐渐上升,当磷酸盐浓度大于48 mmol/L时,产量有所下降。可能是因为磷酸盐浓度过高时,启动子处于“关闭”状态,随着磷酸盐被菌体利用,低于一定值时才启动目的蛋白质的表达。因此选择磷酸盐浓度为36 mmol/L。

图9 磷酸盐浓度的优化Fig.9 Optimization of phosphates concentration
2.3.2 反应条件的优化 在本实验中,以发酵菌体为粗酶源,在一定反应体系下进行酶催化反应。催化反应条件是影响酶活性的重要因素,因此通过对催化反应条件初步优化,探索产丙谷二肽的最适反应条件。作者以发酵液作为粗酶源,在适合α-氨基酸酯酰基转移酶催化的条件下催化丙氨酸甲酯盐酸盐和谷氨酰胺合成丙谷二肽。这是一个酶催化反应,产物的积累与反应时间有一定的关系,因此考察反应时间对丙谷二肽积累量的影响,结果见图10(a)。反应1.5 h丙谷二肽产量最高,是其他组的两倍左右。由于丙氨酸甲酯在碱性溶液中不够稳定,反应时间过长会导致底物被降解,时间过短则反应不充分。
酶具有一定的温度适应范围,通常温度较低时,酶的催化活性也较低,而温度超过一定值时,有可能导致酶失活。考察温度对丙谷二肽产量的影响,结果见图10(b)。温度为10、15℃时,酶活性较低,随着温度的增加,丙谷二肽产量增加,高于25℃时,其产量反而下降,所以25℃为最适反应温度。
酶的稳定性与其所处环境的pH也紧密相关,环境中的pH会影响酶分子中相关集团的解离状态,极端pH还会影响酶活性中心的构象甚至使酶失活,考察不同pH值对丙谷二肽积累量的影响,结果见图10(c)。表明pH为9时,丙谷二肽产量最高,低于或高于9,其产量均有所下降,所以pH 9为最适pH值。
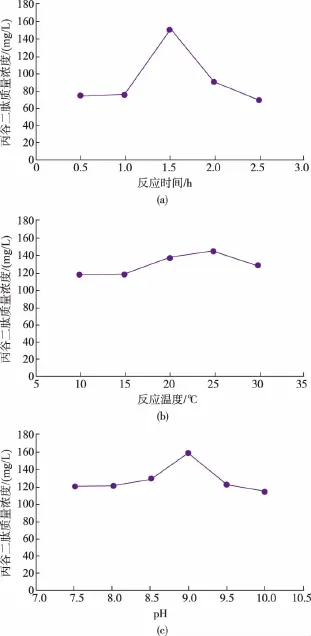
图10 反应时间、反应温度、pH值对丙谷二肽积累量的影响Fig.10 Optimization of reaction time
在以丙氨酸甲酯盐酸盐和谷氨酰胺为底物的催化反应中,Ala-OMe·HCl,Gln的Km值分别为21.3、23.3 mmol/L。不同的底物配比能影响到丙谷二肽的生成,考察底物配比对其影响,结果见图11。可知,在底物浓度比为200∶200 mmol/L时,丙谷二肽产量最高,然而,底物浓度分别为50 mmol/L谷氨酰胺、100 mmol/L丙氨酸甲酯盐酸盐时,底物利用率最高,在一定程度上节约成本,且能够减少产物的纯化步骤。

图11 底物配比的优化Fig.11 Optimization of the ratio of the two substrates,AlaOMe·HCl and Gln
2.4 重组大肠杆菌发酵生产丙谷二肽
挑取一环重组大肠杆菌DH5α/pET21a-phoCSAET接种至优化后的发酵培养基中,以菌液为粗酶源,添加到优化后的反应体系中反应,测得丙谷二肽产量为383 mg/L。
3 结语
作者成功构建了国内第一株产L-丙氨酰-L-谷氨酰胺的重组大肠杆菌。通过优化密码子、质粒、启动子、培养基组分、催化反应条件,最高产量达到383 mg/L,比优化前提高3.9倍,是利用L-氨基酸连接酶产丙谷二肽产量(0.12 g/L)的3倍。从构建的9种质粒中选取产量最高的质粒,并考察与该质粒相匹配的宿主细胞,得到DH5α/pET21a-phoC-SAET为最优的重组大肠杆菌。虽然其产量、酶活都是最高的,但是在发酵阶段,菌体生长缓慢,培养36 h后OD600才达到4左右,因此可调节培养温度以及接种体积分数提高菌体浓度,从而提高丙谷二肽产量。并且大肠杆菌基因组中有pepD,pepA,pepB,pepN等编码的酶能够降解二肽,后续实验中可以考虑敲除这些蛋白酶以提高目的产物的积累。本研究以发酵培养得到的重组大肠杆菌作为粗酶源,再把菌体添加到一定的反应体系中得到丙谷二肽,此方法工序较长,步骤偏多,在后续实验中可以考虑将底物直接添加到发酵培养基中,一步法直接生产丙谷二肽。
参考文献:
[1]WANG Suisui,LIANG Kun.The effect of glutamine on the gastrointestinal tract and immune function in preterm infants[J]. Medical Recapitulate,2010,16(4):521-523.(in Chinese)
[2]TRITSCH G,MOORE G.Spontaneous decomposition of glutamine in cell culture media[J].Exp Cell Res,1962,28(2):360-364.
[3]YAGASAKIM,HASHIMOTOS.Synthesisandapplicationofdipeptides;currentstatusandperspectives[J].Applied Microbiology Biotechnology,2008,81(1):13-22.
[4]唐果,赵玉芬,许鹏翔,等.N(2)-L-丙氨酰-L-谷氨酰胺二肽合成方法[P].中国专利:CN1683391,2005-10-19.
[5]焦庆才,钱绍松,陈然,等.含L-谷氨酰胺二肽的合成方法[P].中国专利,CN200410066112.3,2005-08-10.
[6]唐果,赵玉芬.N(2)-L-丙氨酰-L-谷氨酰胺二肽的合成与反应研究[D].福建:厦门大学,2004.
[7]姜能桥,刘文杰.一种L-丙氨酰-L-谷氨酰胺的制备方法[P].中国专利,200510103315.X,2005-09-16.
[8]TABATA Kazuhiko,HASHIMOTO Shin-ichi.Fermentative production of L-alany-L-glutamine by a metabolically engineered Escherichia coli strain expressing L-amino acid α-ligase[J].Applied and Environmental Microbiology,2007,73(20):6378-6385.
[9]TABATA Kazuhiko,IKEDA Hajime,HASHIMOTO Shin-ichi.ywfE in Bacillus subtilis codes for a novel enzyme,L-amino acid ligase[J].Journal of Bacteriology,2005,187(15):5195-5202.
[10]HIRAO Yoshinori,MIHARA Yasuhiro,KIRA Ikuo,et al.Enzymatic production of L-alanyl-L-glutamine by recombinant E.coli expressing α-amino acid ester acyltransferase from Sphingobacterium siyangensis[J].Biosci Biotechnol Biochem,2013,77(3):618-623.
[11]OLGA Vershinina,L V Znamenskaya.The pho regulons of bacteria[J].Microbiology,2002,71(5):497-511.
[12]TOMMASSEN J,JIM Hackett,BEN Lugtenberg,et al.Regulation of the pho regulon of Escherichia coli K-12 cloning of the regulatory genes phoB and phoR and identification of their gene products[J].Molecular Biology,1982,157(2):265-274.
[13]MAKINO Kozo,AMEMURA Mitsuko,KIM Soo-Ki,et al.Mechanism of transcriptional activation of the phosphate regulon in Escherichia coli[J].Microbiology,1998,36(4):231-238.
[14]PAUL M Sharp.Processes of genome evolution reflected by base frequency differences among Serratia marcescens genes[J]. Molecular Microbiology,1990,4(1):119-122.
[15]CHARLES Kurland,JONATHAN Gallant.Errors of heterologous protein expression[J].Current Opinion Biotechnology,1996,7(5):489-493.
[16]ALESSANDRA Carbone,ANDREI Zinovyev,F Képès.Codon adaptation index as a measure of dominating codon bias[J]. Bioinformatics,2003,19(16):2005-2015.
Construction of a L-Alanyl-L-Glutamine Producing Recombinant Strain and Optimization of Its Fermentation Conditions
HE Yanchun1,2,3, LIU Peipei1,2,3, ZHANG Zhenyu*1,2,3, SUN Fubao1,2,3, SHEN Song1,2,3
(1.SchoolofBiotechnology,Jiangnan University,Wuxi214122,China,2.Key Laboratory of Industrial Biotechnology,Jiangnan University,Wuxi 214122,China,3.Key Laboratory of Carbohydrate Chemistry and Biotechnology Ministry of Education,Jiangnan University,Wuxi 214122,China)
α-Amino acid ester acyltransferase,which is encoded by SAET,can synthesize L-alanyl-L-glutamine from L-alanine methyl ester hydrochloride and L-glutamine.To improve the expression level of α-amino acid ester acyltransferase in Escherichia coli,we optimized the codons and the mRNA secondary structure of SAET in the translation initiation region.Total of 396 nucleotides were changed,and the G+C ratio was simultaneously increased from 42.15%to 48.22% after optimization.Codon-optimized SAET gene was cloned into expression vectors with a tryptophan tandem promoter or phosphate promoter.DH5α/pET21a-phoC-SAET is the strain withthe highest yield.The composition of the optimized culture medium for the genetic engineered Escherichia coli to produce L-alanyl-L-glutamine is as follows:glucose 15 g/L,yeast extract 10 g/L,tryptone 10 g/L,NH4AC 5 g/L,KH2PO46.75 g/L,K2HPO42.25 g/L and MgSO4·7H2O 0.5 g/L.The optimal reaction conditions are:AlaOMe·HCl 100mmol/L,Gln 50 mmol/L,pH 9,at 25℃for 90 min.The yield is 383 mg/L,which showed 3.9 fold improvement over that of the initial condition.
recombinant Escherichia coli,codon optimization,α-amino acid ester acyltransferase,fermentation condition optimize
Q 815
A
1673—1689(2017)03—0287—09
2015-02-28
国家自然科学基金项目(30800018);高等学校博士学科点专项科研基金项目(200802951036);工业生物技术教育部重点实验室主任基金项目(KLIB-ZR200801)。
*通信作者:张震宇(1976—),男,江苏张家港人,理学博士,教授,硕士研究生导师,主要从事分子生物学和发酵工程方面的研究。
E-mail:zhangzy@gmail.com
何艳春,刘沛沛,张震宇,等.产丙谷二肽重组大肠杆菌的构建及发酵优化[J].食品与生物技术学报,2017,36(03):287-295.

