不同糖化血红蛋白水平对2型糖尿病患者中性粒细胞/淋巴细胞的影响
吴智勇,柳依萌,高小燕,李文高,余思渊,罗 鹏,张富贵,何 雷
(南方医科大学第二临床医学院,广州 510282)
·经验交流·
不同糖化血红蛋白水平对2型糖尿病患者中性粒细胞/淋巴细胞的影响
吴智勇,柳依萌,高小燕,李文高,余思渊,罗 鹏,张富贵,何 雷△
(南方医科大学第二临床医学院,广州 510282)
目的 探讨不同糖化血红蛋白(HbA1c)水平的2型糖尿病(T2DM)患者中性粒细胞/淋巴细胞(NIR)的变化并分析其可能的作用因素。方法 抽取302例诊断为T2DM的患者,按HbA1c不同水平分为4组,A组:HbA1c<6.5%(89例);B组:6.5%≤HbA1c≤7.0%(74例);C组:7.0%
糖尿病,2型;糖化血红蛋白;中性粒细胞/淋巴细胞;自主神经
糖尿病是一组由多病因引起的以慢性高血糖为特征的代谢性疾病,长期碳水化合物及脂肪、蛋白质代谢紊乱可以引起全身多系统损害,尤其是眼、肾、神经、心脏等组织器官慢性进行性病变、功能减退及衰竭,严重危害人类身体健康。近年来的研究表明亚临床慢性低度炎症状态在胰岛素抵抗的发生中起到了重要的作用,是2型糖尿病(T2DM)的重要特征[1-2]。亚临床慢性低度炎症是指感染性炎症和自身免疫性炎症水平以下的炎症,无临床可见的红、肿、热、痛等局部症状和全身症状,是机体一种慢性低度炎症反映状态。慢性亚临床炎症中,T2DM患者机体的免疫系统的组成部分被改变,最明显的变化发生在脂肪组织、肝、胰岛细胞、脉管系统和循环中的白细胞。中性粒细胞/淋巴细胞(NLR)是一个新提出的炎症因子,可以反应机体慢性炎症状态[3]。多项研究表明,NLR与血糖、胰岛素抵抗(IR)、代谢综合征及糖尿病多种并发症均有密切关系[1,4-10],并且NLR可作为预测糖尿病患者血糖升高的危险因子[11]。糖化血红蛋白(HbA1c)是血糖的一个重要指标,美国糖尿病学会(ADA)建议HbA1c控制在小于7%,国际糖尿病联盟(IDF)建议HbA1c控制标准为小于6.5%,在Sefil的研究中仅以7.0%作为分组的割点,为进一步明确NLR与血糖间的关系,笔者以HbA1c水平6.5%、7.0%、9.0%为割点,以此探究NLR在不同HbA1c水平变化的趋势及其可能的原因。
1 资料与方法
1.1 一般资料 选取2014年6月至2015年6月南方医科大学珠江医院内分泌科住院及门诊诊断为T2DM的患者302例(诊断标准:按WHO 1999年标准),根据血糖水平将T2DM患者分为4组[A组:HbA1c<6.5%(89例);B组:6.5%≤HbA1c≤7.0%(74例);C组:7.0%
1.2 方法 所有的研究对象接受统一的问卷调查和体检,测量身高、体质量,计算体质量指数(BMI),抽取受检者空腹外周静脉血4 mL,分离血清,测定空腹血糖(FBG)、空腹胰岛素(FIns)、肌酐(Cr)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、全血细胞计数。以HOMA胰岛素抵抗指数(HOMA-IR)评价IR:HOMA-IR=(FPG×FIns)/22.5。HbA1c水平采用离子交换高效液相色谱法(HPLC)测得。血糖采用葡萄糖氧化酶法。胰岛素采用Beckman Coulter公司生产的UniCelDxI 800,选用Access Ultrasensitive Insulin试剂盒,采用同时一步酶免法(夹心法)测定。
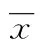
2 结 果
2.1 各组一般资料及生化指标比较 各组基本情况如年龄、性别、BMI、血脂、病程等比较,差异无统计学意义(P>0.05);各组间空腹血糖比较,差异有统计学意义(P<0.05),见表1。
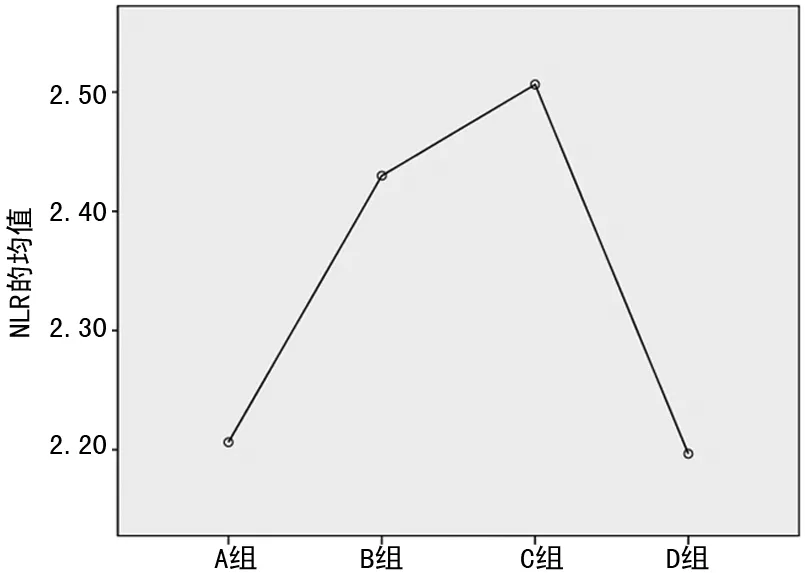
图1 各分组间NLR均值变化趋势
2.2 各组炎症指标及胰岛素抵抗比较 各组间淋巴细胞、白细胞计数及IR指数比较,差异无统计学意义(P>0.05)。各组中性粒细胞数值、NLR差异有统计学意义(P<0.05),见表2。
2.3 HbA1c≤9%时,HbA1c水平与其他指标的单因素相关性分析 其中NLR与HbA1c呈正相关(r=0.174,P<0.05),中性粒细胞与HbA1c呈正相关(r=0.159,P<0.05),见表3、图1~4。

表1 基本临床资料与生化指标比较
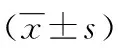
表2 各组NLR及IR比较
1:P<0.05,与A组比较;2:P<0.05,与B组比较;3:P<0.05,与C组比较;4:P<0.05,与D组比较。

表3 HbA1c水平的单因素相关分析

图2 各分组间NLR变化的箱式图
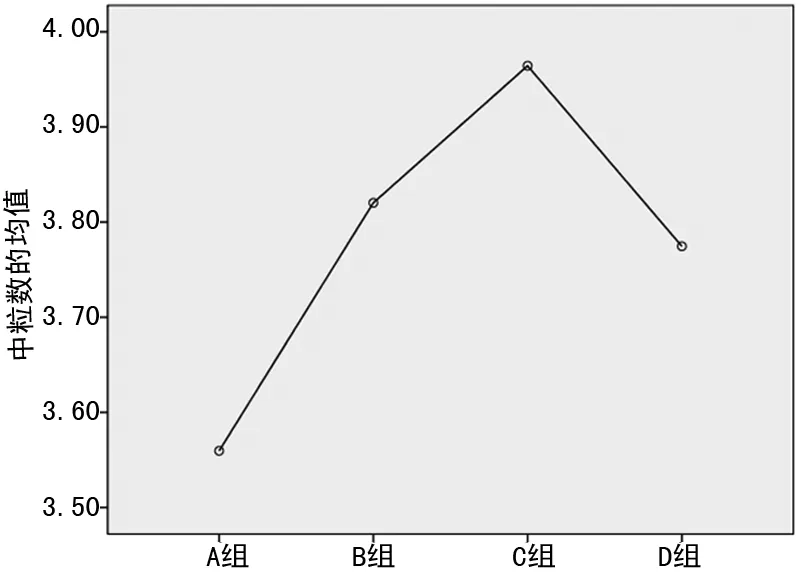
图3 各分组间中性粒细胞均值变化趋势

图4 各分组间淋巴细胞均值变化趋势
3 讨 论
HbA1c可以反映患者近8~12周的血糖水平,血糖水平的暂时波动对其影响很小,HbA1c是糖尿病诊断和治疗监测的重要标准,检测HbA1c水平有助于糖尿病的诊断,有助于了解糖尿病控制情况。近年来的研究认为机体的低度炎症可能参与糖尿病的发病机制,炎症介质在糖尿病的发生、发展中有作用。中性粒细胞是一种炎症反应中的非特异性炎症细胞,具有强大的免疫调节能力,中性粒细胞通过产生弹性蛋白酶等细胞因子的作用,阻断胰岛素信号通路,促进糖尿病发病[12];同时,淋巴细胞在慢性炎症反应中亦有调节作用。研究发现,T 细胞亚型CD4+CD25+FoxP3+表达较高的小鼠IR的程度较低[13]。
既往研究发现,HbA1c与NLR呈正相关,随NLR的升高而升高,而本研究却发现,T2DM患者的NLR值随HbA1c水平的升高并非呈现单一正相关的直线变化,在HbA1c≤9%时,NLR与HbA1c呈正相关(r=0.174,P<0.05);而当血糖进一步升高,HbA1c>9.0%时这种相关性消失,且NLR均值出现降低,NLR均值:D组小于B、C组,差异有统计学意义(P<0.05),见图1、2。出现差异的原因可能和糖尿病患者自主神经功能紊乱造成的中性粒细胞和淋巴细胞数目变化有关。
长期以来,糖尿病自主神经病变多被认为是继T2DM发生之后的一种并发症,然而,早在T2DM发病血糖升高之前,已有人注意到机体出现了自主神经功能的改变。自主神经功能广泛,不仅调控骨髓中性粒细胞、淋巴细胞增殖,也影响机体血糖变化和胰岛内分泌功能。研究显示,自主神经调控骨髓中性粒细胞、淋巴细胞的增殖和分化。中性粒细胞的数量与功能受到交感神经调控,副交感神经负责调控淋巴细胞的数量与功能。中性粒细胞表面表达大量肾上腺素受体,淋巴细胞表面则胆碱能受体占优势,生理状态下,人白天交感神经活动增强,白天中性粒细胞较夜晚升高;而副交感神经功能晚上占优势,人淋巴细胞则晚上较白天明显升高[14-15]。
Wierup等[16]研究显示,交感神经通过B细胞膜上的α2受体抑制胰岛素的分泌,副交感神经通过乙酰胆碱与毒蕈样受体结合,促使胰岛素的释放。同时,自主神经还通过中枢神经系统调控血糖变化,下丘脑多个核团中存在葡萄糖的反应性神经元和葡萄糖敏感性神经元,当血糖降低时,下丘脑腹正中核反馈性引起激素释放,通过交感神经作用于胰岛A细胞分泌胰高血糖素,使得血糖上升;当血糖升高的时候,下丘脑的内侧基底部兴奋,通过迷走神经刺激胰岛B细胞释放胰岛素[17-20]。
本研究发现,T2DM患者随着血糖升高,NLR与HbA1c均呈明显升高趋势,且两二者呈正相关,从图3中可以看出,随着血糖的升高,中性粒细胞数目在逐渐升高(P<0.05),这可能和T2DM患者交感神经过度兴奋有关。交感神经的兴奋可以促进中性粒细胞的增殖和分化,导致NLR上升。然而血糖升高到一定程度(HbA1c>9.0%)时,NLR与HbA1c的相关性消失,淋巴细胞出现上升趋势、NLR下降,提示随着血糖进一步升高,可能出现自主神经功能改变,高血糖通过下丘脑刺激迷走神经兴奋,而迷走神经功能亢进可能影响了淋巴细胞,从而改变NLR,见图4。本研究中未发现IR与NLR的相关性,这可能和入组条件、入组人群数量,以及IR的计算方法有关,其原因仍需进一步研究。
综上所述,NLR存在于血常规中,是临床常用检测指标,廉价且简单易得,NLR可以作为一个炎症指标反映糖尿病患者的状态及其发生并发症的危险性,目前关于糖尿病发病机制界内尚没有一个完整的认识,但是大量研究认为低度亚临床炎症对代谢综合征患者并发心血管疾病风险,以及糖尿病肾病、糖尿病视网膜病变有预警作用,而且通过本研究的分析与讨论认为NLR可能还与糖尿病自主神经功能状态相关,尽管具体因素及机制尚不明确[4-10]。目前,尚未发现有关NLR与糖尿病患者自主神经之间的相关研究,解读NLR在糖尿病中的作用,对于未来临床及基础医学的研究有相当的启发作用。本研究中尚存在一定的局限性,包括入组人群的地域限制和普遍性、某些潜在的入组误区、检测手段及检测指标的有效性等,需要进一步的改进和深入研究。
[1]Lorenzo C,Hanley AJ,Haffner SM.Differential white cell count and incident type 2 diabetes:the Insulin Resistance Atherosclerosis Study[J].Diabetologia,2014,57(1):83-92.
[2]PitsavosC,Tampourlou M,Panagiotakos DB,et al.Association between low-grade systemic inflammationand type 2 diabetes mellitus among men and women from the ATTICA study[J].Rev Diabet Stud,2007(4):98-104.
[3]Ahsen A,Ulu MS,Yuksel S,et al.As a newinflammatory marker for familial Mediterranean fever:neutrophil-to-lymphocyteratio[J].Inflammation,2013,36(6):1357-1362.
[4]Imtiaz F,Shafique K,Mirza SS,et al.Neutrophil lymphocyte ratio as a measure of systemic inflammation in prevalent chronic diseases in Asian population[J].Int Arch Med,2012,5(1):2.
[5]Tsai JC,Sheu SH,Chiu HC,et al.Association of peripheral total and differential leukocyte counts with metabolic syndrome and risk of ischemic cardiovascular diseases in patients with type 2 diabetes mellitus[J].Diabetes Metab Res Rev,2007,23(2):111-118.
[6]Ulu SM,Dogan M,Ahsen A,et al.Neutrophil-to-lymphocyte ratio as a quick and reliable predictive marker to diagnose the severity of diabetic retinopathy[J].Diabetes TechnolTher,2013,15(11):942-947.
[7]Azab B,Daoud J,Naeem FB,et al.Neutrophil-to-lymphocyte ratio as a predictor of worsening renal function in diabetic patients (3-year follow-up study)[J].Ren Fail,2012,34(5):571-576.
[8]Buyukkaya E,Karakas MF,Karakas E,et al.Correlation of neutrophil to lymphocyte ratio with the presence and severity of metabolic syndrome[J].Clin Appl Thromb Hemost,2014,20(2):159-163.
[9]Lou M,Luo P,Tang R,et al.Relationship between neutrophil-lymphocyte ratio and insulin resistance in newly diagnosed type 2 diabetes mellitus patients[J].BMC Endocrine Disorders,2015,15(1):9.
[10]Huang WJ,Huang JH,Liu QG,et al.Neutrophil-lymphocyte ratio is a reliable predictive marker for early-stage diabetic nephropathy[J].Clin Endocrinol (Oxf),2015,82(2):229-233.
[11]Sefil F,Ulutas KT,Dokuyucu R,et al.Investigation of neutrophil lymphocyte ratio and blood glucose regulation in patients with type 2 diabetes mellitus[J].J Int Med Res,2014,42(2):581-588.
[12]TalukdarS,Oh da Y,Bandyopadhyay G,et al.Neutrophils mediate insulin resistance in mice fed a high-fat diet through secreted elastase[J].Nat Med,2012,18(9):1407-1412.
[13]Eller K,Kirsch A,Wolf AM,et al.Potential role of regulatory T cells in reversing obesity-linked insulin resistance and diabetic nephropathy[J].Diabetes,2011,60(11):2954-2962.
[14]Abo T,Kawamura T.Immunomodulation by the autonomic nervous system:therapeutic approach for cancer,collagen diseases,and inflammatory bowel diseases[J].Ther Apher,2002,6(5):348-357.
[15]Suzuki S,Toyabe S,Moroda T,et al.Circadian rhythm of leucocytes and lymphocytes subsets and its possible correlation with the function of the autonomic nervous system[J].Clin Exp Immunol,1997,110(3):500-508.
[16]Wierup N,Richards WG,Bannon AW,et al.CART knock out mice have impaired insulin secretion and glucose intolerance,altered beta cell morphology and increased bodyweight [J].Regul Pept,2005,129(1/2/3):203-211.
[17]Lam TK,Roger Gutierrez-Juarez R,Pocai A,et al.Regulation of blood glucose by hypothalamic pyruvate metabolism[J].Science,2005(309):943-947.
[18]Borg MA,Borg WP,Tamborlane WV,et al.Chronic hypoglycemia and diabetes impair counterregulation induced by localized 2-deoxy-glucose perfusion of the ventromedial hypothalamus in rats[J].Diabetes,1999(48):584-587.
[19]Levin BE,Ambrose AD,Vanessa HR.Brain glucose sensing and body homeostasis:role in obesity and diabetes[J].Am J Physiol,1999,276(5 Pt 2):R1223-1231.
[20]Landsberg L.Insulin-mediated sympathetic stimulation:role in the pathogenesis of obesity-related hypertension[J].J Hypertens,2001(19):523-528.
吴智勇(1993-),在读本科生。△
,E-mail:765139701@qq.com。
10.3969/j.issn.1671-8348.2017.08.029
R589.9
B
1671-8348(2017)08-1097-04
2016-09-18
2016-11-16)

