WT1在结肠癌中的表达及临床意义
龚勇 仝巧云 郑世华
·论著·
WT1在结肠癌中的表达及临床意义
龚勇 仝巧云 郑世华
目的 检测WT1在结肠癌中的表达并探讨其临床意义。方法 应用免疫组化及半定量RT-PCR技术检测WT1在48例结肠癌及14例正常结肠组织中的表达情况,分析其与结肠癌患者的临床病理特征及预后等关系。结果 WT1在结肠癌中的阳性表达率明显高于正常组织,差异有统计学意义(P<0.05);WT1的表达与患者的年龄、性别和分化程度无关(P>0.05);而与肿瘤的TNM分期、淋巴结转移相关(P<0.05);生存分析显示WT1阳性表达组患者的生存期与阴性组差异无统计学意义(P>0.05)。结论WT1的高表达可能在结肠癌的发生发展中起重要作用,设想以WT1为靶点进行基因治疗,有可能为结肠癌的治疗提供新途径。
WT1;结肠癌
结肠癌是消化道中常见的恶性肿瘤之一,多发生于40岁以上的男性患者,在我国发病率和病死率较高,由于结肠癌早期症状隐匿,易被忽视,多数患者确诊时已至中晚期,预后较差,因此对于结肠癌的早期诊断及判断预后有重要意义[1]。Wilms肿瘤基因(Wilms’ tumor gene,WT1)是最早发现的与Wilms肿瘤的发生发展有关的一类基因,其编码的WT1蛋白通过识别、结合下游靶基因,产生激活或抑制等多种不同的生物学效应,在细胞的分化、增殖、凋亡、组织器官的发育及肿瘤的发生发展中起重要作用[2]。WT1在肺癌、乳腺癌、肝癌、胰腺癌等多种肿瘤细胞中异常表达,学者对WT1在白血病中的研究报道较多,但在结肠癌中的表达研究相对较少。我们采用免疫组化及RT-PCR等技术,检测结肠癌及正常结肠组织中WT1的表达,分析其与结肠癌患者的临床病理特征及预后等关系,为研究结肠癌发生的分子机制及预防治疗提供理论依据。
1 资料与方法
1.1 一般资料 2010年1月至2015年12月湖北省宜昌市中心人民医院病理科存档石蜡包埋的结肠标本62例:结肠癌组织48例,其中男30例,女18例;平均年龄(54.7±11.7)岁。正常结肠组织14例,其中男9例,女5例;平均年龄(57.5±13.1)岁。 患者术前均未行放化疗,术后均有明确的病理学诊断。根据美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)制定的结直肠癌TNM分期系统对48例结肠癌标本行TNM分期:Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期28例; 组织学分级高中分化29例,低分化19例;有淋巴结转移18例,无转移30例。2组在性别、年龄分布差异无统计学意义(P>0.05)。WT1鼠抗人抗体、SP免疫组化染色试剂盒购于赛信通(上海)生物试剂有限公司;总RNA提取试剂盒购于北京索莱宝科技有限公司,逆转录试剂盒购于北京中杉金桥生物技术有限公司;引物由NCBIprimer-BLAST软件设计,由Invitrogen公司合成。
1.2 方法
1.2.1SP免疫组化:按试剂盒说明进行,WT1抗原采用酶消化修复,用PBS代替一抗作阴性对照,已知的阳性片作阳性对照。以细胞核内出现棕黄色颗粒定义为WT1阳性染色。每例随机计数1 000个清晰的癌细胞,记录阳性染色细胞数,以(阳性染色细胞数/1 000)×100%≥15%定为染色阳性,即过度表达。
1.2.2 总RNA的提取:①从之前保存在-80℃冰箱中取出组织块重量约100mg,放在EP管中后研磨至匀浆状,加入1mlTlrizol试剂,室温静置5min; ②加入200μl氯仿 ,振荡15s,室温静置5min,离心(4℃、12 000r/min、15min);③吸取上层液体,加入500μl异丙醇,混匀后室温静10min,离心(4℃、12 000r/min、15min); ④弃上清,加入1ml75%乙醇,离心(4℃、7 500r/min、15min)弃上清;⑤加入RNasefreewater溶解RNA沉淀。
1.2.3cDNA合成:取2μl已提取的RNA,加入到98μl经 0.1%DEPC灭活RNA酶的去离子水中,用反转录试剂盒将总RNA反转录为cDNA。
1.2.4RT-PCR引物及扩增反应:引物由Invitrogen公司合成:WT1上游引物:5’-GGCATCTGAGACCAGTGAGAA-3’、下游引物:5’-GAGAGTCAGACTTGAAAGCAGT-3;β-actin内参上游引物5’-CCCATCTATGAGGGTTACGC-3’;下泳引物:5’-TTTAATGTCACGCACGATTTC-3’。扩增取cDNA1μl依次加入10×缓冲液、4种dNTP、20pmol的WT1引物(β-actin引物为10pmol)、Taq聚合酶2U、25mmol/LMgCl28μl。扩增条件:94℃变性1min、64℃退火1min、72℃延伸2min、共40个循环。
1.2.5PCR产物的分析:取PCR产物5μl,在2%琼脂糖凝胶电泳(含0.5μg/ml溴化乙锭),经凝胶图像分析仪对电泳条带亮度分析拍照,采用成像分析系统处理。以β-actin作为内参照,计算WT1mRNA的相对表达量。

2 结果
2.1 结肠癌及正常结肠组织中WT1的表达 在临床和病理双盲的情况下,由2名有经验的病理科医师对所有切片在显微镜下观察WT1的染色结果,WT1的阳性表达表现为肿瘤细胞核呈棕黄色染色。WT1在结肠癌组织中的表达率为87.50%(42/48),明显高于其在正常结肠组织中的表达率21.43%(3/14),差异有统计学意义(P<0.05)。
2.2 结肠癌组织WT1蛋白的表达与临床病理参数关系WT1的表达与患者年龄、性别、肿瘤部位无关(P>0.05);WT1在TNM分期Ⅰ-Ⅱ期和Ⅲ-Ⅳ期的阳性表达率分别为70.00%、100.00%;在高中分化组、低分化组的阳性表达率分别为72.22%、96.67%,WT1的表达随肿瘤分期而升高、细胞分化降低而升高,2组比较有统计学差异(P<0.05)。见表1。
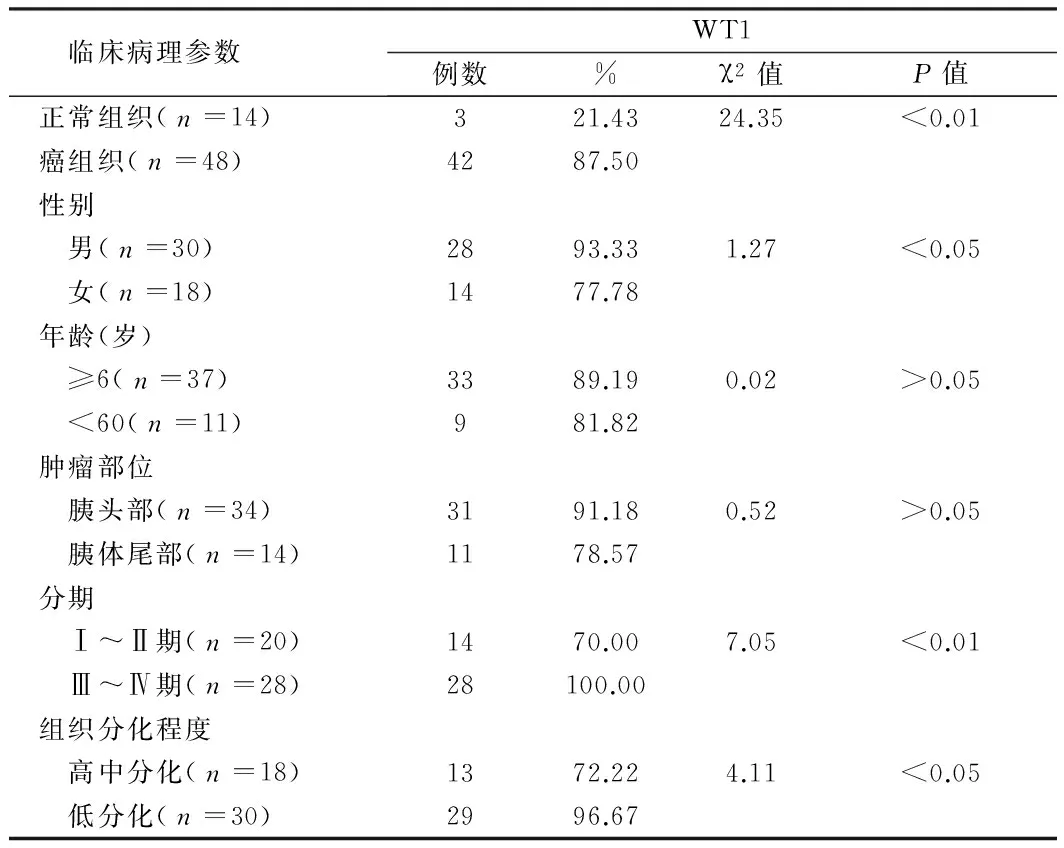
表1 WT1的表达及与结肠癌临床病理参数的关系
2.3WT1mRNA在结肠癌组织中的表达情况WT1基因和β-actin内参基因共同扩增,对RT-PCR产物进行琼脂糖凝胶电泳分析,可以看出WT1基因mRNA条带亮度及产量明显高于正常结肠组织,分析仪分析电泳条带亮度并进行灰度值结果显示WT1mRNA在结肠癌组织中的相对表达量为(2.08±0.44),与正常组织的相对表达量(0.23±0.37)相较,差异有统计学意义(P<0.01)。见图1。
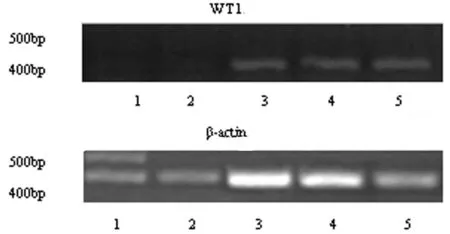
图1 第1泳道:空白对照;第2泳道:癌旁组织;第3、4、5泳道:癌组织
2.4WT1蛋白表达与患者术后生存期分析 对48例结肠癌患者术随访,6例WT1蛋白表达阴性的结肠癌患者术后 4年累积生存率为70.12%,中位生存期38个月;42例WT1蛋白表达阳性的患者术后4年累积生存率为41.02%,中位生存期24个月,2组差异无统计学意义(P>0.05)。见图2。
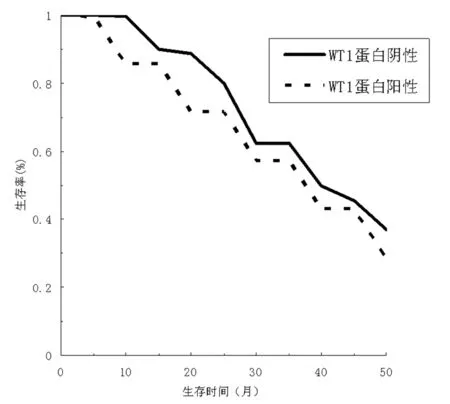
图2 WT1蛋白阴、阳性表达的患者术后生存曲线
3 讨论
Wilms肿瘤基因是MaxWilm等于1989年从儿童肾母细胞瘤(Wilm's瘤)染色体11p13分离出来的肿瘤基因,含有10个外显子,转录mRNA产物长约3kb[3]。WT1基因有多种不同的RNA剪切方式,其编码的蛋白为一多功能调控调节因子,主要功能是识别、结合某些生长因子基因的启动子来调节转录,如血管内皮生长因子(VEGF)、胰岛素样生长因子Ⅱ(IGF2)、集落刺激因子Ⅰ(CSF-Ⅰ)、癌基因Bcl2、抑癌基因P53、NDRG2等[4-6]。因此WT1在调节细胞的增殖、生长、分化、凋亡以及肿瘤细胞的发生发展中起重要的作用[7]。
国内外学者对WT1进行深入研究,WT1在白血病细胞、胰腺癌、肺癌、和甲状腺癌等恶性肿瘤细胞中高度表达[8,9]。近来研究发现WT1的表达与结肠癌的发生发展关系密切,国外学者Koesters等[10]应用RT-PCR及Westernblot检测分析了一系列人结肠癌细胞株WT1mRNA及其编码蛋白的表达情况,并通过序列分析确定WT1基因锌指结构区突变部位,结果结果示WT1mRNA在SW707、SW480 、SW948三类细胞株中高表达;在Colo320、KM12、LS180、Lovo、CX1、HT29、HCT116 等七类细胞株中也存在较高表达,而在LS174T和SW48两类细胞株及来自人正常结肠黏膜细胞中不表达;同时对15例原发性结肠癌组织中WT1mRNA水平进行检测,结果阳性表达率达86.68%(13/15),而在正常结肠黏膜组织中WT1mRNA的表达却很低。使用人类白细胞抗原肽对WT1特异性细胞毒性T淋巴细胞(CTLs)诱导活化,活化的CTLs不仅溶解外源性同源肽,也抑制了结肠肿瘤细胞WT1的表达。这些研究结果证实了WT1基因表达产物的高表达对结肠癌的发生发展起重要作用。
为探讨WT1在结肠癌组织中的表达及与临床病理参数关系,我们采用免疫组织化学及RT-PCR分别检测了WT1在48例结肠癌及14例正常结肠组织中的表达:WT1在结肠癌组织中的表达率为87.50%(42/48),明显高于正常组织21.43%(3/14),2组比较差异有统计学意义(P<0.05),这一研究结果初步提示:结肠癌组织中WT1的高表达可能参与了结肠癌的发生。我们进一步探讨WT1与结肠癌临床病理联系:WT1有随肿瘤分期升高、细胞分化降低而升高的趋势,但WT1蛋白表达的高低与结肠癌患者术后生存期无明显关系,综合分析认为WT1的高表达与结肠癌的恶性程度、侵袭和转移密切相关,但与预后关系不明,提示WT1的过度表达可能与结肠肿瘤的恶性程度有关,WT1是否可以作为指标来反映结肠癌的临床病理特征及预后,有待于进一步收集随访资料来研究证实。
作为一个特异性转录调控因子,WTl在多种肿瘤中异常表达。虽然我们的实验表明WTl在结肠癌中发挥着癌基因的作用,参与了结肠癌的发生、发展、浸润和转移,但WTl的具体生物学行为以及作用机制尚未完全清楚,需我们进一步研究。WTl的多种生物学功能表明WTl是一个非常有前景的肿瘤治疗靶点,设想以WT1基因为靶点进行基因治疗,抑制WT1基因转录活性,降低WT1的表达,促进细胞凋亡,有可能为结肠癌的治疗开辟新途径。
1SiegelR,NaishadhamD,JemalA.Cancerstatistics,2013.CA:ACancerJournalforClinicians,2013,63:11-30.
2MartínezCH,DaveS,IzawaJ.Wilms’gene.AdvExpMedBiol,2010,685:196-209.
3CallKM,GlaserT,ItoCY,etal.Isolationandcharacterizationofazincfingerpolypeptidegeneatthehumanchromosome11Wilms’tumorlocus.Cell,1990,60:509-520.
4HarutaM,AraiY,SugawaraW.DuplicationofpaternalIGF2orlossofmaternalIGF2imprintingoccursinhalfofWilmstumorswithvariousstructuralWT1abnormalities.GenesChromosomesCancer,2008,47:712-727.
5FurusatoE,HidayatAA,ManYG,etal.WT1andBcl2expressioninmelanocyticlesionsoftheconjunctiva:animmunohistochemicalstudyof123cases.ArchOphthalmol,2009,127:964-969.
6DupontJ,WangX,MarshallDS,etal.WilmsTumorGene(WT1)andp53expressioninendometrialcarcinomas:astudyof130casesusingatissuemicroarray.GynecolOncol2004,94:449-455.
7ZirnB,HartmannO,GesslerM.ExpressionprofilingofWilmstumorsrevealsnewcandidategenesfordifferentclinicalparameters.Cancer,2006,118:1954-1962.
8 龚勇,赵秋,杨芳,等.胰腺导管腺癌组织中WT1,IGF-IR表达与细胞凋亡的关系.世界华人消化杂志,2006,14:2810-2814.
9 蒙秋,吴清萍,黄守国.WT1基因在子宫颈癌组织细胞中的表达及意义.疑难病杂志,2013,12:614-616.
10KoestersR,LinnebacherM,CoyJF,etal.WT1isatumor-associatedantigenincoloncancerthatcanberecognizedbyinvitrostimulatedcytotoxicTcells.Cancer,2004,109:385-392.
Expression and clinical significance of WT1 in colon cancer
GONGYong,TONGQiaoyun,ZHENGShihua.
DigestiveDiseaseResearchInstituteofSanxiaUniversity,DepartmentofGastroenterology,CentralPeople’sHospitalofYichangCity,Hubei,Yichang443003,China
Objective To observe the expression of WT1 in colon carcinoma, and to explore its clinical significance.Methods The expression levels of WT1 in 48 cases of colon carcinoma and 14 cases of normal colon tissues were detected by immunohistochemistry and semi quantitative RT-PCR.The correlation between the expression of WT1 and clinical pathological features as well as patient's prognosis was analyzed.Results The positive expression rates of WT1 in colon carcinoma were significantly higher than those in normal colon tissues (P<0.05).TheexpressionofWT1wasnotcorrelatedtopatient'sageandsex,differentiationdegreeoftumor(P>0.05),however,whichwasrelatedwithTNMstagingandlymphnodemetastasisoftumor(P<0.05).ThesurvivalanalysisshowedthattherewasnosignificantdifferenceinsurvivaltimebetweenpatientswithWT1positiveexpressionandpatientswithWT1negativeexpression(P>0.05).Conclusion The high expression of WT1 may play an important role in the pathogenesis and development of colon cancer,which may provide an new way for treatment of colon cancer.
WT1; colon cancer
10.3969/j.issn.1002-7386.2017.08.015
443003 三峡大学消化病研究所 湖北省宜昌市中心人民医院消化内科
R
A
1002-7386(2017)08-1176-03
2016-09-20)

