核磁共振技术在手性识别方面的应用
杜国稳,陈连辉
(温州大学化学与材料工程学院,浙江 温州 325035)
核磁共振技术在手性识别方面的应用
杜国稳,陈连辉
(温州大学化学与材料工程学院,浙江 温州 325035)
近年来,NMR方法以其分析速度快﹑样品用量少﹑费用低等优点,逐渐成为手性分析不可缺少的工具。本文综述了NMR方法在研究立体化学中的动力学及其反应机理﹑测定手性物质的对映体纯度以及绝对构型﹑研究手性识别的机理和构象﹑鉴定不同构型的有机分子的立体结构和化学结构等方面的研究进展。
手性;对映体; NMR
近年来,许多分离技术已被开发应用于手性分析,如高效液相色谱法(HPLC)[1]﹑电化学传感器法[2]﹑质谱法(MS)[3]﹑光谱法[4]等。在以上分析方法中,NMR方法以分析速度快﹑样品用量少﹑费用低等优点,逐渐成为手性分析不可缺少的工具。利用NMR技术,不但能够测量主-客体分子间的化学计量关系和平衡常数,而且能够了解手性识别过程中作用点的信息。其主要应用在研究立体化学中动力学及其反应机理﹑测定手性物质的对映体纯度以及绝对构型﹑研究手性识别的机理和构象﹑鉴定不同构型的有机分子的立体结构和和化学结构等方面。
NMR技术测定对映体(ee值)的工作原理是直接或间接地使手性对映异构体的化学环境不等价,根据异构体在NMR谱图上不同的化学位移以及峰面积,计算对映异构体的ee值。目前,核磁共振技术研究手性识别有3种方法:一是手性衍生化试剂法(Chiral derivatizing agents法,简称CDA法),即使对映异构体转化为非对映异构体,测定对映异构体比率即能获得较好的分析结果,但是操作比较复杂;二是手性位移试剂法(Chiral shift reagents法,简称CSR法),该方法能获得较大的化学位移差,由于线宽的影响,对分析结果有不利的影响;三是手性溶解剂法(Chiral solvating agents法,简称CSA法),该方法利用手性溶解剂与底物快速形成缔合物,使对映异构体的性质有所差异,然后在NMR谱图上表现出来。常用的手性溶解试剂有镧系元素或过渡金属络合物﹑布朗斯特酸/碱﹑超分子受体等。
1 手性衍生化试剂法(CDA)
手性衍生化试剂由Raban于1965年首次提出,可以不经过化学拆分而直接通过NMR测定手性化合物的ee值,近几年,手性衍生化试剂的合成发展十分迅速。该方法将对映异构体转化为非对映异构体,基于NMR中特征峰的化学位移进行分析。衍生化试剂需要具备以下特征:一是功能基团能提供与底物的共价结合位点;二是基团可产生空间各向异性;三是极性或大的基团能提供固定结构。该方法主要应用于手性胺﹑醇﹑羧酸﹑多羟基化合物的构型等。
目前,最为常用的手性化试剂是Morsher[5]或MTPA试剂,即α-甲氧基-α-三氟甲基-α-苯基乙酸,以及其酰氯对映体(R-构型或S-构型),目前已经商业化。手性纯的对映异构体与Morsh’s acid或者其酰氯偶合生成一对非对映异构体S-MTPA酯或R-MTPA酯。由于所生成酯的构象不同,通过1H NMR和19FNMR分别测定α-甲氧基和α-三氟甲基的化学位移差异,可测定出对映体的绝对构型。
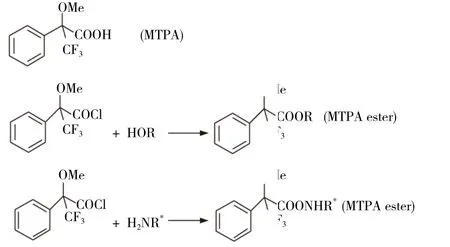
Figure1 MTPA and MTPA ester
James D. T.等[6]报道了通过三组分的反应来测定手性伯胺以及手性胺醇的ee值的手性衍生化试剂CDA(Scheme 1)。2-甲酰基苯硼酸和BINOL与消旋体的胺以及胺醇反应,用1H NMR直接进行分析,可以得到80%~90%的ee值。

Scheme 1 Chiral Derivatization Protocol for Determining the Enantiopurity of Chiral Amine with 2-formylphenyl boronic acid and (s)-BINOL
2 手性位移试剂法(CSR)

Scheme 2 chiral imidazolium salts (a) potassium salt of Mosher acid(b) Potassium salt of Mosher acid after the addition of 3 equiv
手性位移试剂法是一种可非常方便地测定对映异构体ee值的方法,该方法不需要衍生化试剂。手性位移试剂主要以镧系金属离子(Eu3+﹑Pr3+﹑Yb3+等)为中心原子,有机β-二酮为配体形成配位化合物,这种络合物是一种Lewis酸,可以和Lewis碱(如胺﹑醛﹑酮﹑羧酸﹑醇及其衍生物等)形成加合物。手性镧试剂于20世纪70年代首次报道。其结果是未受配合的质子通常受到去屏蔽作用,这些质子的化学位移发生改变,因此,不同的质子有不同程度的位移,使原来重叠的峰分开。不同的镧系离子导致不同的化学位移,铕﹑铒﹑铥﹑镱等加合物质子的化学位移移向低场,铈﹑镨﹑钕等加合物质子的化学位移移向高场。同时冠醚[15]﹑环糊精[7]﹑卟啉[8]﹑大环空腔化合物也是常用的位移试剂。
Luis等[9]报道了以手性咪唑鎓盐为手性位移试剂,对Mosher’s 酸及其衍生物进行手性分析,当加入3个当量的手性咪唑鎓盐时,以CD3CN作溶剂,用NMR进行检测,可以清楚地看到链接α-C的甲氧基进行了裂分。
Tanaka等[10-11]报道了其他两种大环空穴化合物对羧酸及其衍生物的构型分析,以及其对映体纯度的测定。Casanova[12]测定了镧系配合物手性Yb(hfc)3对醇的对映体纯度以及归队构型。Coxon[13]报道了首次用镧系化合物D-Yb(hfc)3以及L-和D-Eu(hfc)3,对氨基酸酯的α,β-质子进行NMR检测,发现其化学位移向低场移动。

Figure 2 different of Chiral Solvating Agent
此外,由于镧系配合物是顺磁手性位移试剂,用核磁共振一次测定时,镧系离子会造成谱峰变宽。顺磁离子会缩短弛豫时间,因此导致NMR谱线变宽,同时,磁场强度越强,NMR谱线变宽越严重,增加了分析的难度。
目前,所用镧及其他位移试剂分子量较大,熔点高,不易回收,重复利用率低,对环境不友好。而且大多数镧系位移试剂合成比较困难,对合成条件要求较高,由于我国对镧系等稀土元素的深加工技术薄弱,使得位移试剂的价格较高。
3 手性溶剂化试剂法(CSA)
手性溶剂化试剂按照缔合作用的不同,可分为两类,一是主-客体类型;二是供-受体类型。
3.1 主-客体类型
Carmer[14]首先于1953年报道了环糊精用于手性识别。环糊精的外缘(Rim)亲水而内腔(Cavity)疏水,因而它能够像酶一样提供一个疏水的结合位点作为主体,包络各种类型的适当的客体如有机小分子。其内腔疏水而外部亲水的特性使得环糊精可根据范德华力﹑疏水相互作用﹑主客体分子间的配位等与有机小分子形成包合物。
3.2 供-受体类型
这种类型的手性溶剂化试剂与对映异构体通过弱相互作用,如氢键﹑π-π相互作用等形成缔合物。这些手性溶剂化试剂都有一个各向异性的芳香环以及酸性(OH)或碱性(NH)基团作为位点,这类化合物大都有O﹑H﹑N等原子。近年来,其研究也越来越广泛。
Lei等人[15]合成了(R,R)-BINOL胺的衍生物作为手性溶剂化试剂,用来测定扁桃酸的ee值,在298K下以CDCl3作为溶剂,进行1H NMR检测,可以看出消旋体扁桃酸的手性质子出现了明显的裂分,其手性质子裂分Δ Δ δ为0.284×10-6。

Scheme 31H NMR spectra of free receptor, free mandelic acid, and the 1:1 mixture of receptor with (rac)-mandelic acid
Pericas等人[16]合成了双氨基化合物作为手性溶剂化试剂,用来测定扁桃酸及其衍生物的ee值。在303K下,摩尔比为1∶1,以CDCl3作为溶剂,进行1H NMR检测,可以看出消旋体扁桃酸的手性质子出现了明显的裂分,其消旋扁桃酸的手性质子的Δ Δ δ为0.25×10-6。
4 结论
本文对3种NMR技术测定对映异构体ee值的方法进行了综述。NMR技术具有样品用量少﹑分析速度快﹑费用低等优点,在测定对映异构体方面有着广泛的应用前景。以上方法中,手性衍生化试剂法测定对映异构体比率,能获得较好的分析结果,但是操作比较复杂且衍生化试剂比较昂贵。手性位移试剂法能获得较大的化学位移差,由于线宽的影响,对分析结果有不利的影响,试剂价格高,不适合大规模的应用。手性溶解剂法利用手性溶解剂与底物快速形成缔合物,使对映异构体的性质有所差异,方法简便,因此合成新的手性溶剂化试剂,是目前科研人员的研究方向。
[1] Bouchair N., Righezza M., Hamdi A. Reversed-phase High-performance Liquid Chromatographic Separation of some 2-arylpropinonic Acids Using Vancomycin as Chiral Stationary Phase [J]. J. Iran. Chem. Soc. 2015, 12(6): 921-928.
[2] Trojanowicz M., Kaniewska M. Electrochemical Chiral Sensors and Biosensors[J]. Electroanalysis, 2009, 21: 229-238.
[3] Bazanova O. B., Bredikhina Z. A., Babaev V. M., Sharafutdinova D. R., Fayzullin R. R., Bredikin A. A. Chiral (2-Cyanophenoxy) methyl-15-crown-5 in Diastereomeric Discrimination of Amino Acid Esters According to the Data of Electrospray Ionization Mass Spectrometry [J]. Russian J. Org. Chem., 2015, 51: 1642-1658.
[4] Wu L.M., Vogt F.G., Liu D.Q. Flow-Injection MS/MS for Gas-Phase Chiral Recognition and Enantiomeric Quantitation of a Novel Boron-Containing Antibiotic (GSK2251052A) by the Mass Spectrometric Kinetic Method [J]. Anal. Chem., 2013, 85: 4869-4874.
[5] Yolanda P.F., Kelly A.M., Johnson A.L., Arimori S., Bull S.D., James T.D. Simple Protocol for NMR Analysis of the Enantiomeric Purity of Primary Amines [J]. Org. Lett., 2006(4): 609-612.
[6] Tickell D.A., Mahon M.F., Bull S.D., James D.T. A Simple Protocol for NMR Analysis of the Enantiomeric Purity of Chiral Hydroxylamines [J]. Org. Lett., 2013, 15(4): 860-863.
[7] Wenzel T.J., Amonoo E.P., Shariff S.S., Aniagyei S.E. Sulfated and carboxymethylated cyclodextrins and their lanthanide complexes as chiral NMR discriminating agents [J].Tetrahedron: Asymmetry, 2003, 14(20): 3099-3104.
[8] (a) Schwenninger R., Schlogl J., Maynollo J., Gruber K., Ochsenbein P., Burgi H.-B., Konrat R., Krautler B. Metal complexes of a biconcave porphyrin with D4- structure-Versatile chiral shift agents [J]. Chem. Eur. J., 2001, 7(12): 2676-2686. (b) Ema T., Ouchi N., Doi T., Korenaga T., Sakai T. Highly sensitive chiral shift reagent bearing two zinc porphyrins [J]. Org. Lett., 2005, 7(18): 3985-3988.
[9] Altava B., Barbosa D.S., Burguete M.I., Escorihuela J., Luis S.V. Synthesis of new chiral imidazolium salts derived from amino acids: their evaluation in chiral molecular recognition [J]. Tetrahedron: Asymmetry, 2009, 20: 999-1003.
[10] Tanaka K., Fukuda N. Calixarene-like’ chiral amine macrocycles as novel chiral shift reagents for carboxylic acids [J].Tetrahedron: Asymmetry, 2009, 20: 111-114.
[11] Tanaka K., Fukuda N., Fujiwara T. Trianglamine as a new chiral shift reagent for secondary alcohols [J]. Tetrahedron: Asymmetry, 2007, 18: 2657-2661.
[12] (a) Blanc M-C., Bradesi P., Casanova J. Enantiomeric differentiation of acyclic terpenes by13C NMR spectroscopy usinga chiral lanthanide shift reagent [J]. Magn.Reson. Chem., 2005, 43: 176-179. (b)Lanfranchi D. A., Tomi F., Casanova J. Enantiomeric Dierentiation of Atropine/ Hyoscyamine by13C NMR Spectroscopy and its Application to Datura stramonium Extract [J].Phytochem Anal., 2010, 21: 597-601.
[13] Coxon J.M., Cambridge J.R. A., Nam S.G.C. NMR Separation of -Prochiral Protons to the Ether Oxygen of Chiral Esters with Lanthanide Shift Reagents [J]. Org. Lett., 2001, 26(3): 4225-4227.
[14] Cramer F. EinschluBverbindungen der Cyclodextrine [J]. Angew. Chem. Int.Ed., 1952, 64: 136-137.
[15] Ma Q.Z., Ma M.S., Tian H. ., Ye X.X., Xiao H.P., Chen L.H., Lei X.X. A Novel Amine Receptor Based on theBinol Scaffold Functions as a Highly Effective Chiral Shift Reagent for Carboxylic Acids [J]. Org. Lett., 2012, 14(23): 5813-5815.
[16] Bian G.L., Fan H.J., Yang S.W., Yue H.F., Huang H.Y., Zong H., Song L. A Chiral Bisthiourea as a Chiral Solvating Agent for Carboxylic Acids in the Presence of DMAP [J]. J. Org. Chem., 2013, 78: 9137-9142.
Application of NMR Technology in Chiral Recognition
DU Guowen, CHEN Lianhui
(College of Chemistry and Material Engineering, Wenzhou University, Wenzhou 325035)
In recent years, because of advantages of rapid analysis speed and low cost, NMR technology become an indispensable tool for chiral analysis. In this paper, the research progress of NMR technology, included study of kinetics and reaction mechanism in stereochemistry, determination of enantiomeric purity and absolute configuration of chiral materials, study of mechanism and conformation of chiral recognition, identifying of structure and chemical structure of organic molecules with different confgurations, were summarized.
chiral; single isomer; NMR
A
1671-9905(2017)04-0029-03
2017-02-20

