肌酐水解酶菌株S-09发酵条件优化及酶的分离纯化
石群,张庆芳,杨丽娜,任楠楠,乔慧,迟乃玉*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622)
肌酐水解酶菌株S-09发酵条件优化及酶的分离纯化
石群1,2,张庆芳1,2,杨丽娜1,2,任楠楠1,2,乔慧1,2,迟乃玉1,2*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622)
该实验以海洋来源的微小杆菌(Exiguobacteriumsp.)S-09为出发菌株,对其发酵培养基和产酶条件进行优化。并将粗酶液经硫酸铵盐析、透析、超滤离心和Sephadex G-100凝胶过滤层析进行分离纯化。结果表明,其最佳发酵培养基为0.5%的肌酐作为碳源、0.3%胰蛋白胨和0.2%玉米浆作为复合氮源,诱导物肌酸含量为0.3%;其最佳发酵条件为作用pH值7.5、温度25℃、装液量50 mL/250 mL、接种量3%。Fe2+和Mn2+能显著促进产酶。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳结果显示,纯化后的肌酐水解酶分子质量为24.3 ku。
肌酐水解酶;培养基;发酵条件;优化;分离纯化
肌酐水解酶(creatininase)EC 3.5.2.10可偶联肌氨酸氧化酶将肌酐降解为肌酸、甲醛和过氧化氢[1]。作为一种重要的诊断酶制剂,肌酐水解酶被应用于临床检测血清中的肌酐含量[2-3],用来诊断肾脏功能的健康程度。
肌酐含量检测已成为临床常规的检测项目,但国内因原酶提取技术不成熟、临床需酶量大、诱导物价格昂贵等因素使得酶促检测法的推广受到延滞[4-5],普遍采用的化学检测法因其特异性差、易受样品干扰而使得检测结果不准确[6]。肌酐水解酶作为酶促反应中的第一步[7],其酶的纯度及酶学性质因来源不同而有一定差异,会直接影响作用效果,如分子质量、亚基组成和蛋白质组成等[8-10],因此研究其纯度及性质变得尤为重要。此外,肌酐作为肾脏功能性障碍及尿毒症患者血液中仅次于尿素氮的第二大毒素[11],其含量的累积对红细胞有一定的损害[12]。而我国关于清除肌酐的药物研究涉及较少,因此研究开发肌酐水解酶的特性并应用于医疗事业是研究者当前面临的重要问题和挑战。
本实验利用海洋资源筛选出一株产肌酐水解酶的微小杆菌(Exiguobacteriumsp.)S-09,通过单因素实验优化S-09产酶条件,粗酶液经盐析、透析及Sephadex G-100凝胶柱层析进行分离纯化。目的是增加菌种来源、提高原酶纯度,为探究清除肌酐药物研制及进一步开发国产诊断酶制剂奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
微小杆菌(Exiguobacteriumsp.)S-09:分离自渤海海域(123°371′E,39°6972′N)海泥样品中,现由辽宁省海洋微生物工程技术研究中心保藏。
1.1.2 培养基
固体活化培养基采用LB培养基:胰蛋白胨1%,酵母浸粉0.5%,琼脂2%,NaCl 1%,水1 000 mL,pH 7.0,121℃灭菌20 min。
种子培养基:胰蛋白胨1%,酵母浸粉0.5%,NaCl 1%,水1 000 mL,pH 7.0,121℃灭菌20 min。
发酵培养基:肌酐0.5%,胰蛋白胨0.5%,K2HPO40.1%,MgSO4·7H2O 0.05%,KCl 0.05%,水1 000 mL,pH 7.0,121℃灭菌20 min。
1.1.3 化学试剂
肌酐(分析纯):大连凯美化工工程配套有限公司;肌酸(分析纯):国药集团化学试剂有限公司;苦味酸(分析纯):生工生物工程(上海)股份有限公司;蛋白Marker:加拿大Fermentas公司;其余试剂均为国产分析纯。
1.2 仪器与设备
HZP-250全温振荡培养箱:上海精宏实验设备有限公司;MLS-3750高压蒸汽灭菌器:日本三洋电机株式会社;LTI-700恒温培养箱:上海爱朗仪器有限公司;HD-1360超净工作台:北京东联哈尔仪器制造有限公司;DYY-6C电泳仪:北京市六一仪器厂;GelDoc XR+凝胶成像系统:广州市龙煜生物科技有限公司。
1.3 方法
1.3.1 菌株活化
无菌条件下,将保存于4℃条件下的斜面菌株接种到固体活化培养基中,25℃培养24h,纯化2次以备后续实验使用。
1.3.2 种子培养
无菌条件下挑取斜面上菌体一环,于装液量为100 mL/ 250mL的种子培养基中,于25℃、180 r/min摇床培养24 h。
1.3.3 发酵培养
按接种量1%吸取一定的种子液于装液量为200 mL/ 500mL的发酵培养基中,于25℃、180r/min摇床培养36h。
1.3.4 肌酐水解酶活测定方法[13-14]
取0.1 mL的酶液加入0.9 mL肌酸溶液中,37℃反应10 min后取出0.1 mL反应液加入1 mol/L NaOH和0.5%苦味酸(各1 mL)终止反应,加入0.9 mL蒸馏水,于25℃水浴锅水浴20 min后于波长520 nm处测吸光度值。肌酐水解酶活力定义:在上述反应条件下,每分钟催化1 μmol肌酐转变成产物所需要的酶量为一个酶活力单位(U)。
1.3.5 发酵条件单因素优化
通过对菌株生长的发酵培养基和发酵条件的优化,最终获得最适合菌株生长及其发酵条件,在原来的基础上提高发酵产物的产量,以期达到生产最大发酵产物的目的,是微生物产业化中重要的一步[15]。本实验以菌株S-09为出发菌株,探究发酵培养基配比和发酵的最优条件。
(1)最适诱导物浓度对菌株S-09发酵产酶的影响
选取肌酸为诱导物,探究不同加入量(0、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%)对酶活的影响。种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(2)不同碳源对菌株S-09发酵产酶的影响
分别选用0.5%不同碳源(肌酐、可溶性淀粉、花生油、乳糖、蔗糖、柠檬酸钠)作为唯一碳源,种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(3)不同氮源对菌株S-09发酵产酶的影响
分别选用0.5%不同氮源(胰蛋白胨、酵母膏、鱼粉蛋白胨、牛肉膏、玉米浆)作为唯一氮源,种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(4)复合氮源配比对菌株S-09发酵产酶的影响
在选取最适氮源的基础上以(胰蛋白胨+玉米浆)为复合氮源,胰蛋白胨与玉米浆配比分别为0.2%∶0.2%、0.2%∶0.3%、0.2%∶0.4%、0.3%∶0.2%、0.3%∶0.3%、0.3%∶0.4%,探究不同复合氮源配比对菌株产酶性能的影响。种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(5)pH对菌株S-09发酵产酶的影响
分别设置培养基初始pH分别为6.0、6.5、7.0、7.5、8.0、8.5、9.0,种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(6)培养温度对菌株S-09发酵产酶的影响
设置培养温度为15℃、20℃、25℃、30℃、35℃及不同培养时间的菌体(18 h、30 h、42 h),种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(7)装液量对菌株S-09发酵产酶的影响
设置装液量分别为25mL/250mL、50mL/250mL、75mL/ 250 mL、100 mL/250 mL、125 mL/250 mL、150 mL/250 mL的发酵培养基,种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(8)接种量对菌株S-09发酵产酶的影响
种子培养基分别以1%、2%、3%、4%、5%、6%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(9)金属离子对菌株S-09发酵产酶的影响
向培养基中加入浓度为0.5mmol/L的不同种类的金属离子(FeSO4、MnSO4、ZnSO4、CuCl2、CoCl2、MgCl2),种子培养基以5%的接种量接种到发酵培养基后,于25℃、180 r/min振荡培养36 h后破碎离心取上清测定酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
1.3.6 酶的分离纯化
(1)粗酶液的制备
将纯化后的菌株S-09接于发酵培养基中,培养36 h。发酵菌液于4℃、4 000 r/min离心30 min得到菌体,用超纯水将菌体水洗2次,4℃、4 000 r/min离心30 min。将离心得到的湿菌体用0.1mol/L的磷酸缓冲液(pH7.5)溶解。冰浴条件下用超声波细胞粉碎机裂菌(作用3 s,间隔3 s,120 W,共10 min)。在低温(4℃)条件下10 000 r/min离心10 min收集上清液即为肌酐水解酶粗酶液。
(2)硫酸铵沉淀
制备6份粗酶液,参照硫酸铵盐析溶解度表,向酶液中加入硫酸铵固体使其硫酸铵饱和度分别达到10%、20%、30%、40%、50%、60%、70%、80%。低温(4℃)保存12 h,离心收集沉淀用磷酸缓冲液溶解,分别测定不同梯度的沉淀蛋白浓度和酶活力,绘制盐析标准曲线。
(3)透析和超滤
将盐析得到的样品装入预先处理好的透析袋(截留分子质量14 000 u)中,4℃条件下透析,期间更换透析液。而后加入氯化钡溶液,直到无白色沉淀生成为止,检测透析液中无SO42-;将完成透析的样品转移到超滤管中进行蛋白浓缩,4℃、4 000 r/min离心10 min,测定肌酐水解酶酶活。
(4)SephadexG-100凝胶过滤层析
正确连接凝胶柱、核算蛋白检测仪、自动收集器和显示器,控制蛋白检测仪T值为100。待基线平衡后将超滤后的浓缩酶液2 mL加入用同样缓冲液平衡好的Sephadex G100凝胶柱(Ф1.6 cm×60 cm)中。调节设置自动收集器,根据显示器上的洗脱峰,记录相应试管管号,测定肌酐水解酶酶活力。
1.3.7 肌酐水解酶分子质量的测定
采用浓度为12%的分离胶和浓度为5%的浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),考马斯亮蓝R-250染色1 h后脱色至无色,根据分子质量和相对迁移率的关系确定肌酐水解酶分子质量。
2 结果与分析
2.1 单因素优化结果
2.1.1 肌酸含量对菌株S-09发酵产酶的影响
肌酐水解酶是一种诱导酶,而诱导物的昂贵价格是发酵产酶商业生产中的一大障碍[16],因此研究肌酸的有效加入量具有重要意义。不同肌酸含量对肌酐水解酶相对酶活的影响结果见图1。由图1可知,肌酸作为诱导物加入培养基中使得酶活有所提高,当培养基中不添加肌酸时酶活较低,随着肌酸含量的增加酶活呈不断上升趋势,当肌酸加入量在0.3%~0.8%时,相对酶活不断增大并在肌酸加入量为0.8%时达到100%;肌酸含量>0.8%时,肌酐水解酶相对酶活出现下降趋势。最终选取0.3%为最适肌酸加入量,原因是诱导物价格昂贵,加入少量诱导物不仅能提高酶的产量,而且更好的降低成本提升经济效益。
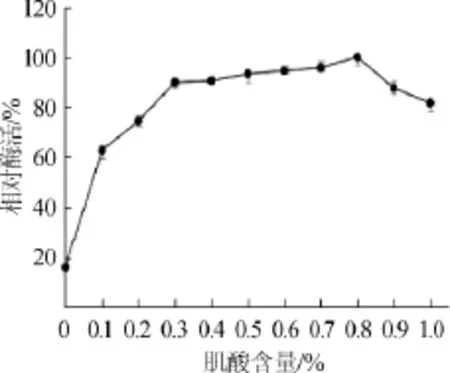
图1 肌酸含量对酶活的影响Fig.1 Effect of creatine contents on enzyme activity
2.1.2 不同碳源对菌株S-09发酵产酶的影响
不同碳源对菌株S-09发酵产酶的影响结果见图2。由图2可知,乳糖和葡萄糖作为碳源时酶活较低,而可溶性淀粉和柠檬酸钠作为碳源时酶活相对较高,肌酐作为碳源时相对酶活达到100%,并且肌酐还是一种诱导物能促进产酶。因此,选取肌酐作为最适碳源。

图2 碳源种类对酶活的影响Fig.2 Effect of carbon source types on enzyme activity
2.1.3 不同氮源对菌株S-09发酵产酶的影响
不同氮源对菌株S-09发酵产酶的影响结果见图3。由图3可知,以鱼粉作为氮源时相对酶活最低,酵母膏和牛肉膏作为氮源时能促进产酶但酶活水平一般,以胰蛋白胨和玉米浆作为氮源时不仅能稳定的促进产酶而且相对酶活达到100%。因此,选择胰蛋白胨和玉米浆作为培养基最适氮源。

图3 氮源种类对酶活的影响Fig.3 Effect of nitrogen source types on enzyme activity
2.1.4 复合氮源配比对菌株S-09发酵产酶的影响
胰蛋白胨和玉米浆都能较好的促进产酶,但两者含有不同种类的氨基酸、维生素及生长因子[17]。因此在选取(胰蛋白胨+玉米浆)为复合氮源,探究胰蛋白胨与玉米浆配比对酶活的影响,结果见图4。由图4可知,胰蛋白胨与玉米浆配比为0.2%∶0.4%和0.3%∶0.4%时氮源浓度较高,但其产酶活性并非最高,分析可能浓度过高对菌体生长产生一定抑制。而胰蛋白胨与玉米浆配比为0.3%∶0.2%时,添加到培养基中能更好的促进产酶,肌酐水解酶相对酶活达到100%。因此,胰蛋白胨与玉米浆最佳配比为0.3%∶0.2%。

图4 胰蛋白胨与玉米浆配比对酶活的影响Fig.4 Effect of tryptone and corn steep liquor ratio on enzyme activity
2.1.5 pH对菌株S-09发酵产酶的影响
不同pH值对肌酐水解酶酶活的影响结果见图5。由图5可知,pH在6.5~7.5范围内相对酶活随pH值的增加而增大;在pH 7.5时肌酐水解酶相对酶活达到100%;在pH>8.0时相对酶活随pH值的增加而降低。因此,发酵最适pH值为7.5。

图5pH对酶活的影响Fig.5 Effect of pH on enzyme activity
2.1.6 培养温度对菌株S-09发酵产酶的影响
由图6可知,生长时间为18 h的菌体产酶量增长缓慢,生长时间为30 h的菌体在25℃培养温度下菌体产酶达到最大值,相对酶活为100%,生长时间为42 h的菌体产酶量呈下降趋势,分析原因可能是随着培养基中营养物质逐渐消耗,菌体产酶能力开始下降。因此,最佳培养温度为25℃。
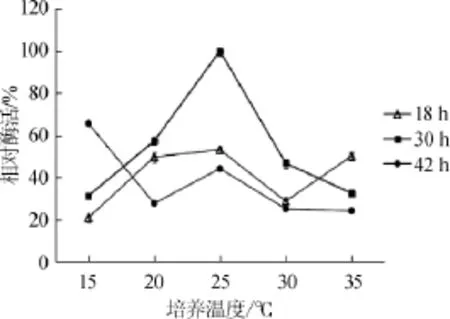
图6 培养温度对酶活的影响Fig.6 Effect of culture temperature on enzyme activity
2.1.7 装液量对菌株S-09发酵产酶的影响
由图7可知,装液量对菌体产酶酶活的影响并不是很大,装液量在50 mL/250 mL时肌酐水解酶相对酶活达到100%,此时溶氧量适宜菌体生长,随着装液增多相对酶活有所下降,分析原因可能是通气不足溶氧量较少影响菌体产酶能力。因此,选取50 mL/250 mL为最适装液量。

图7 装液量对酶活的影响Fig.7 Effect of liquid volume on enzyme activity
2.1.8 接种量对菌株S-09发酵产酶的影响
由图8可知,当接种量为1%~2%时,相对酶活较低。当接种量变大时酶活反而呈下降趋势,说明此时由于营养成分的逐渐消耗和溶氧不足等因素的影响,接种过量不利于发酵产酶。当接种量为3%时,相对酶活为99%;当接种量为5%时,肌酐水解酶相对酶活达到100%。但考虑到微生物的实际生产,选取3%为最适接种量,不仅起到高产量的作用还能为生产降低大量成本。

图8 接种量对酶活的影响Fig.8 Effect of inoculum on enzyme activity
2.1.9 金属离子对菌株S-09发酵产酶的影响
向培养基中加入浓度为0.5 mmol/L的不同种类的金属离子(Fe2+、Mn2+、Zn2+、Cu2+、Co2+、Mg2+),接种后培养36 h取样测定酶活力,结果见图9。由图9可知,Zn2+、Cu2+对酶有一定的抑制作用,与NISIHYA Y等[18]研究表明的肌酐水解酶是一种含有Zn2+的金属酶有所不同。Co2+、Mg2+对酶活影响不大,Fe2+、Mn2+对菌株发酵产酶有显著的促进作用。
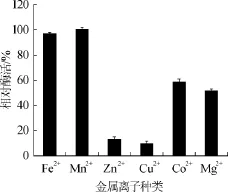
图9 金属离子对酶活的影响Fig.9 Effect of metal ions on enzyme activity
2.2 酶的分离纯化
2.2.1 硫酸铵盐析曲线
由图10可知,当硫酸铵饱和度达到40%时,沉淀中开始出现肌酐水解酶活性;当硫酸铵饱和度达到60%时,沉淀中的酶活达到100%。因此,表明该酶在硫酸铵饱和度达到40%~60%饱和度之间可以被有效地沉淀分离。
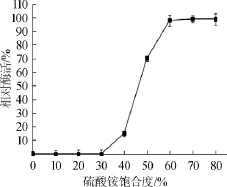
图10 硫酸铵盐析曲线Fig.10 Salting out curve ammonium sulfate
2.2.2 Sephadex G-100凝胶过滤层析
SephadexG-100凝胶过滤层析结果如图11所示,在整个洗脱过程中出现5个蛋白吸收峰,通过测定酶活可知,肌酐水解酶主要集中在最后一个蛋白吸收峰(64~75号)内。收集最后一个蛋白吸收峰内的酶液,浓缩后进行下一步电泳。
图11Sephadex G-100凝胶过滤层析结果
Fig.11 Gel filtration chromatogram results of Sephadex G-100
2.2.3 肌酐水解酶分子质量的测定结果

图12SDS-PAGE电泳图Fig.12 Electrophoretogram of SDS-PAGE
分别取粗酶液、盐析酶液和纯化后的肌酐水解酶样品进行SDS-PAGE电泳。结果见图12。由图12可知,SDS-PAGE凝胶电泳显示纯化后的肌酐水解酶为单一条带。根据分子质量和相对迁移率的关系,得出分子质量约为24.3 ku,与TSURU D等[19]研究报道的肌酐水解酶分子质量在23~33.7 ku之间相符。
3 结论
本实验选择的微小杆菌S-09为革兰氏阳性菌,且原始酶活较高,并对其发酵培养基和发酵条件进行单因素优化,以及对肌酐水解酶进行了分离纯化,结果表明,肌酐0.50%、胰蛋白胨和玉米浆配比为0.3%∶0.2%、肌酸含量0.3%、最适作用pH 7.5、最适温度25℃、通气量50 mL/250 mL、接种量3%、Fe2+和Mn2+能显著促进产酶,SDS-PAGE结果显示,肌酐水解酶的分子质量为24.3 ku。通过研究影响产酶因素、确定最优产酶条件、对酶进行分离纯化,为酶法生产国产试剂盒并实现商品化奠定了基础。
[1]崔有宏,罗侃,郑强,等.肌酐测定的酶学方法[J].西北国防医学杂志,2003,24(2):129-131.
[2]谢继光,蒙凯.血清肌酐测定方法的研究[J].临床和实验医学杂志,2007,6(12):144-145.
[3]张东玲,阚耀东.肌酐测定的方法学进展[J].国际检验医学杂志,2006,27(6):521-523.
[4]宋云霄,欧美贤,李水军,等.同位素稀释质谱法、酶法和碱性苦味酸法测定血清肌酐方法比较[J].检验医学,2013,28(8):698-703.
[5]HETU P O,GINGRAS M E,VINET B.Development and validation of a rapid liquid chromatography isotope dilution tandem mass spectrometry (LC-IDMS/MS)method for serum creatinine[J].Clin Biochem,2010,43 (13-14):1158-1162.
[6]陈筱菲,倪甘甜.酶法与碱性苦味酸法测定肌酐清除值的差异情况研究[J].检验医学,2010,25(4):272-274.
[7]赵更峰,马晓航,贾小明,等.节杆菌肌酐水解酶的纯化及特性研究[J].生物工程学报,2005,21(2):250-253
[8]NAGATE K,SASAKI H,HUA M,et al.Crystal structure of monomeric sarcosine oxidase fromBacillussp.NS-129 reveals multiple conformations at the active-site loop[J].P Jpn Acad Series B,2005,81(6):220-224.
[9]LEE S,JIA B,PHAM B,et al.Architecture and characterization of sarcosine oxidase fromThermococcus kodakarensisKOD1[J].Extremophiles, 2012,16(1):87-93.
[10]GUO K,MA X,SUN G,et al.Expression and characterization of a thermostable sarcosine oxidase(SOX)fromBacillussp.inEscherichia coli [J].Appl Microbiol Biot,2006,73(3):559-566.
[11]王金表.活性炭改性调控对人体肌酐毒素吸附性能及机理研究[D].北京:中国林业科学研究院,2014.
[12]程新,刘芳,张彦新,等.尿酸氧化酶与肌酐水解酶融合基因的克隆及其在大肠杆菌中的表达[J].中国现代医学杂志,2013,23(13):11-15.
[13]SONG L,DAI J,ZHEN K,et al.Production of novel NaN3-resistant creatine amidinohydrolase in recombinantEscherichia coli[J].Bioengineered,2015,6(4):248-250.
[14]YADAV S,DEVI R,BHAR P,et al.Immobilization of creatininase, creatinase and sarcosine oxidase on iron oxide nanoparticles/chitosan-gpolyaniline modified Pt electrode for detection of creatinine[J].Enzyme Microb Technol,2012,50(4-5):247-254.
[15]张广臣,雷虹,何欣,等.微生物发酵培养基优化中的现代数学统计学方法[J].食品与发酵工业,2010,36(5):110-113.
[16]梁剑光,贾佳红,吴俊伟,等.烟草节杆菌肌酐酶发酵培养基优化[J].中国生物工程杂志,2015,35(8):90-95.
[17]左莹,张萍,张惠.玉米浆在氨基酸发酵工业中的作用[J].中国酿造,2013,32(11):18-22.
[18]NISHYA Y,TODA A,OKA M.Characterization and structural of the Arthrobacter creatininase[J].Anal Bio Sci,2001,24(2):144-149.
[19]TSURU D,OKA I,YOSHIMOTO T.Creatinine decomposing enzymes inPseudomonas putida[J].Agr Biol Chem,1976,40(5):1011-1018.
Optimization of fermentation conditions of creatininase-productingExiguobacteriumsp.S-09 and separation and purification of creatininase
SHI Qun1,2,ZHANG Qingfang1,2,YANG Lina1,2,REN Nannan1,2,QIAO Hui1,2,CHI Naiyu1,2*
(1.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China; 2.Liaoning Marine Microbial Engineering and Technology Center,Dalian 116622,China)
UsingExiguobacteriumsp.S-09 from marine as original strain,the fermentation medium and creatininase-producing condition were optimized.The crude enzyme was separated and purified by salting out,dialysis,ultrafiltration and Sephadex G-100 gel filtration chromatography.The results showed that the optimum fermentation conditions were as follows:creatinine 0.5%,tryptone 0.3%,corn steep liquor 0.2%,creatine 0.3%,initial pH 7.5,culture temperature 25℃,liquid volume 100 ml/250 ml,inoculum 3%.Fe2+and Mn2+can strongly activate enzyme production.SDS-PAGE electrophoresis showed that molecular mass of creatininase purified was about 24.3 ku.
creatininase;medium;fermentation conditions;optimization;separation and purification
Q93
0254-5071(2017)04-0020-06
10.11882/j.issn.0254-5071.2017.04.005
2017-02-08
国家高技术研究发展计划‘863计划’(2007AA021306)
石群(1990-),女,硕士研究生,研究方向为微生物与酶工程。
*通讯作者:迟乃玉(1965-),男,教授,博士,研究方向为微生物与酶工程。

