MicroRNA-126与胃癌患者放化综合治疗效果的关系及其对胃癌SGC-7901细胞的放射增敏作用
田晓刚, 赵 林, 张春林, 任锦霞, 赵凤菊, 杨文翠, 苟彩霞
(甘肃省肿瘤医院放疗一病区,甘肃 兰州 730050)
MicroRNA-126与胃癌患者放化综合治疗效果的关系及其对胃癌SGC-7901细胞的放射增敏作用
田晓刚, 赵 林△, 张春林, 任锦霞, 赵凤菊, 杨文翠, 苟彩霞
(甘肃省肿瘤医院放疗一病区,甘肃 兰州 730050)
目的: 研究microRNA-126与胃癌患者放化综合治疗疗效的关系及其对胃癌细胞的放射增敏效果。方法: 选取2014年6月~2015年6月间我院收治的晚期胃癌患者60例为研究对象,其中男性32例,女性28例,年龄37~65岁,平均年龄(51±7)岁。所有患者均接受放化综合治疗。收集患者的胃癌病理组织标本,同时于治疗结束时采集静脉血标本。采用国际实体瘤疗效评价标准(RECIST)评价患者的近期疗效,根据疗效将患者分为治疗敏感组和非敏感组。实时荧光定量PCR检测各组患者组织及血浆中microRNA-126的表达变化。体外培养胃癌SGC-7901细胞并转染microRNA-126 mimic;平板集落形成实验分析microRNA-126 mimic转染对SGC-7901细胞放射敏感性的影响;流式细胞术检测转染microRNA-126 mimic对SGC-7901细胞凋亡率的影响。结果: 根据RECIST,共28例患者对治疗敏感,32例患者对治疗不敏感。与敏感组患者相比,不敏感组患者血浆和胃癌组织中的microRNA-126相对水平较低,相对于敏感组的倍数分别为0.72±0.04和0.48±0.03,差异具有统计学意义(P<0.05)。MicroRNA-126 mimic转染后SGC-7901细胞的SF2值和D0值减小(P<0.05),增敏比为1.74。流式细胞术分析结果发现,microRNA-126 mimic转染可以诱导SGC-7901细胞凋亡,并增加射线引起的细胞凋亡。结论: 较低的microRNA-126提示胃癌患者放化综合治疗疗效不佳;microRNA-126具有增加胃癌细胞放射敏感性的作用。
胃癌; 放疗; 放化综合治疗; MicroRNA-126
胃癌是常见的消化道恶性肿瘤,位居全球恶性肿瘤死亡原因的第2位,为我国恶性肿瘤死亡率的首位,同时伴有较高的发病率[1]。手术切除是治疗胃癌的有效方式,但胃癌早期症状不典型,加之受医疗条件、经济条件以及医疗观念的影响,在我国大部分患者在确诊时已经处于中晚期,存在远处转移,丧失了手术的最佳时机,即使接受根治性手术,术后的局部复发率依然是临床亟待解决的问题[2]。近年来,随着放疗技术,特别是三维适形放疗技术的发展,放疗已经成为重要的胃癌辅助治疗手段。对于进展期存在远处转移的胃癌患者,放疗可以增加局部控制率,降低术后复发率,特别是放疗联合化疗的综合治疗,可以有效改善胃癌患者的远期生存率和生活质量[3-4]。但是胃癌对放疗的敏感性终究有限,加之不同个体对放射性的敏感性存在差异,相同剂量下,一些患者可能疗效明显,一些患者可能疗效较差。虽然理论上增加放射剂量可以增加疗效,但脊髓及腹腔其它重要器官对放射线的耐受有限,因此不能靠单纯增加放疗剂量来解决问题。这种情况下,放疗增敏研究成为临床研究的热门课题,越来越多的研究试图通过药物和分子生物学手段增加肿瘤细胞对放疗的敏感性,以获得更好的治疗效果[5]。
MicroRNA是一类18~21 nt长度的非编码RNA,具有调控细胞生长和凋亡的作用。大量研究表明,肿瘤的发生发展过程中伴随着microRNA的水平变化,并影响肿瘤的放疗或化疗效果[6-7]。前期研究已经证实胃癌患者存在microRNA-126的低表达;microRNA-126表达越低,胃癌的侵袭能力越强,提示microRNA-126可能具有抑制胃癌细胞增殖的作用[8]。因此microRNA-126可能成为胃癌治疗的潜在靶点,但是microRNA-126是否与胃癌患者的放疗疗效有关,是否能够作为胃癌放疗增敏的潜在靶点,还有待研究。因此本研究旨在探讨胃癌患者循环microRNA-126及胃癌组织microRNA-126水平与放化综合治疗的关系,并在体外观察干预microRNA-126水平对胃癌细胞放疗敏感性的影响。
材 料 和 方 法
1 研究对象
选取2014年6月~2015年6月间我院收治的经病理证实的晚期胃癌患者60例为研究对象,其中男性32例,女性28例,年龄37~65岁,平均年龄(51±7)岁。分期采用UICC/AJCC标准,其中Ⅲ期42例,Ⅳ期18例。病理类型高分化腺癌28例,低分化腺癌15例,中分化腺癌10例,黏液腺癌7例。所有纳入研究的患者病历资料完整,均没有接受手术治疗,无放化疗禁忌症,卡氏评分70分以上,治疗方案为放化综合治疗。所有患者对研究内容知情同意,本研究方案由院医学伦理委员会批准同意。
2 主要试剂
MicroRNA快速提取试剂盒购自北京百泰克生物技术有限公司;TaqMan® MicroRNA反转录试剂盒购自Life Technologies;GoTaq® qPCR 试剂盒购自北京普洛麦格生物有限公司;microRNA-16、snRNA内参照序列及microRNA-126 mimic及对照序列购自Qiagen;DMEM培养基及胎牛血清购自Thermo;Annexin V-FITC购自Sigma。
3 主要方法
3.1 放化综合治疗方案 放疗采取常规图像引导放射治疗,采用6 MV X射线,放射剂量为50~60 Gy/ 30 f,每周5次。常规实施。化疗方案于放疗第1天实施,方案为口服替吉奥胶囊60 mg·m-2·d-1,每日2次、早晚餐后口服,连续服药21 d为1个周期,服用4个周期。
3.2 近期疗效评价标准 近期疗效评估采用国际实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)。根据病灶测量的结果,将所有患者分为完全缓解(complete remission,CR):所有目标病灶完全消失,至少维持4周;部分缓解(partial remission,PR):基线病灶最大径之和减少30%以上,至少维持4周;病变稳定(stable disease,SD):基线病灶最大径之和有所减少但未达PR,或有增加,但未达病变进展(progression of disease,PD),无新病灶出现,持续4周以上; PD为基线病灶最大径之和增大20%以上或出现新病灶。
3.3 实时荧光定量PCR检测microRNA-126的水平 收集患者病理学组织标本,并于治疗结束后采集患者静脉血分离血浆标本。MicroRNA快速提取试剂盒提取组织标本以及血浆标本中的microRNA,提取方法按照厂商说明书进行。使用TaqMan® MicroRNA反转录试剂盒将获取的microRNA反转为cDNA,反转录体系和条件按照说明书提供的方案进行。接着使用GoTaq® qPCR 试剂盒实施荧光定量PCR,反应体系和条件按照说明书提供的方案进行。血浆microRNA检测数据使用microRNA-16 作为内参照,组织microRNA检测数据使用U6 SnRNA为内参照。以2-ΔΔCt表示miR-126相对表达水平,ΔCt=Ct目标-Ct内参照。
3.4 胃癌细胞株培养 人胃癌SGC-7901细胞株获自中国科学院上海细胞生物学研究所细胞库。培养于含有10%胎牛血清的DMEM培养基,细胞消化使用0.25%胰酶。培养条件为37 ℃、5% CO2。随后实验均取处于对数生长期的细胞进行实验。
3.5 MicroRNA-126 mimic的转染 取对数期培养细胞,制备细胞悬液,以每孔1×105个细胞的密度接种于6孔板,当细胞汇合度达到75%左右时,使用LipofectamineTM2000转染试剂盒将microRNA-126 mimic转入细胞,microRNA-126 mimic的工作浓度为50 nmol/L,相同方法转染无关microRNA阴性对照(microRNA negative control,microRNA NC)作为阴性对照。继续培养48 h,RT-qPCR验证转染效果。
3.6 平板集落形成实验 取对数期培养细胞,分为3组:未经任何转染的SGC-7901细胞、转染micro-RNA-126 mimic的SGC-7901细胞以及转染micro-RNA NC的SGC-7901细胞。3组细胞分别暴露于0、1、2、4、6和8 Gy剂量,随后接种于培养皿中,各组细胞的接种数取决于照射剂量,0、1、2、4、6和8 Gy剂量对应的接种数分别为200、200、500、2 000、5 000和20 000个。每组各剂量设置3个平行对照。继续培养14 d,每4 d换液 1次。培养时间达到后,弃去培养皿中的培养液,PBS清洗后,使用100%甲醇固定30 min,吉姆萨染色后进行细胞集落计数。计算集落形成率(D0)和细胞存活分数(survival fraction,SF)。D0=0 Gy培养皿中的集落数/0 Gy培养皿中的细胞接种数×100%。SF=某剂量照射后的培养皿内的集落数/(该剂量的接种数×D0)。根据多靶单击模型拟合存活曲线,计算各组D0、SF2(2 Gy剂量对应的SF)以及放射增敏比(sensitizer enhancement ratio,SER)。SER=未经转染组的D0/转染组D0。
3.7 流式细胞术分析microRNA-126对细胞凋亡的影响 取对数期SGC-7901细胞,分为6组:无转染且未经射线处理的SGC-7901细胞;转染microRNA-126 mimic但不经射线处理的SGC-7901细胞;转染microRNA NC但不经射线处理的SGC-7901细胞;无转染但有4 Gy射线处理的SGC-7901细胞;转染microRNA-126 mimic且经4 Gy射线处理的SGC-7901细胞;转染microRNA NC且经射线处理的SGC-7901细胞。培养48 h后收集细胞。重悬浮细胞后,采用Annexin V-FITC试剂盒检测各组细胞的凋亡率:依次加入5 μL Annexin V-FITC和10 μL碘化丙啶染色液,混匀后室温避光孵育15 min上机检测。
4 统计学处理
统计学分析采用SPSS 17.0软件,正态分布数据以均数±标准差(mean±SD)表示,正态分布数据两组间的差异使用t检验分析,多组间的比较采用单因素方差分析。非正态分布数据之间的差异采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
结 果
1 临床预后情况
根据RECIST,共有10例患者被评估CR,18例患者被评估为PR,20例患者为SD,其余12例为PD,定义CR+PR患者为对治疗敏感的患者(敏感组,n=28),定义SD+PD的患者为非敏感患者(非敏感组,n=32)。2组间的一般临床资料如年龄、性别、病理类型及分期的差异均无统计学意义。
2 MicroRNA-126的表达水平与患者预后有关
如图1所示,对放化综合治疗疗效不敏感的患者血浆microRNA-126的表达水平较低,相对于敏感组的(72±4)%,差异具有统计学意义(P<0.05)。同时,对放化综合治疗疗效不敏感的患者胃癌组织的microRNA-126的表达水平也较低,相对于敏感组的(48±3)%,差异具有统计学意义(P<0.05)。上述结果提示较低的microRNA-126水平意味着对放化综合治疗不敏感。
3 MicroRNA-126 mimic转染对SGC-7901细胞放射敏感性的影响
如图2所示,转染microRNA-126 mimic后,SGC-7901细胞内的microRNA-126水平显著上调,与未经转染的细胞和转染阴性对照的细胞相比,差异具有统计学意义(P<0.05)。转染microRNA NC不会改变SGC-7901细胞的miroRNA-126。未转染的SGC-7901细胞,转染microRNA-126 mimic的SGC-7901细胞以及转染microRNA NC的SGC-7901细胞再经过射线照射并培养后的相关参数见表1。相比未经任何转染的细胞、转染microRNA-126后,细胞经过射线照射后的SF2值减小(P<0.05),D0值减小(P<0.05)。经过计算后SER为1.74,提示microRNA-126 mimic转染具有放射增敏作用。但是数据显示,转染microRNA NC并不影响SGC-7901细胞的放射敏感性。各组细胞经不同剂量照射后的生存曲线见图3,转染microRNA-126 mimic组细胞的存活情况与未经转染细胞及转染microRNA NC的细胞相比,差异具有统计学意义(P<0.05)。
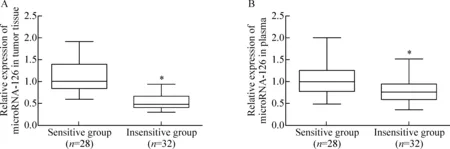
Figure 1.MicroRNA-126 exression in gastric carcinoma tissue (A) and plasma (B) from patients. Mean±SD.*P<0.05vssensitive group.
图1 2组患者胃癌组织和血浆microRNA-126表达水平的比较

Figure 2.MicroRNA-126 level changes after microRNA-126 mimic transfection. Mean±SD.n=3.*P<0.05vsnon-transfection group.
图2 转染microRNA-126 mimic后SGC-7901细胞细胞内microRNA-126水平的变化
表1 各组细胞的放射生物学参数
Table 1.Radiation parameters in each group (Mean±SD.n=3)
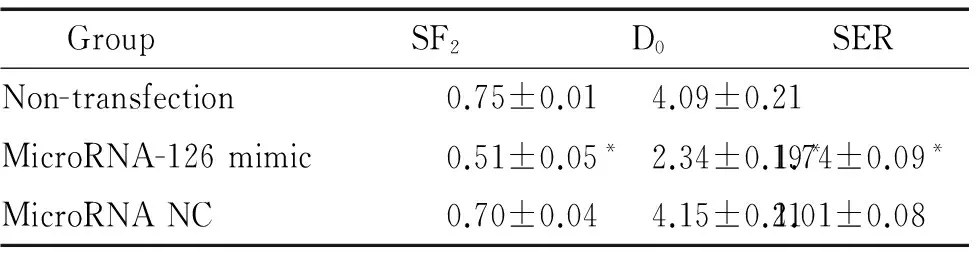
GroupSF2D0SERNon-transfection0.75±0.014.09±0.21MicroRNA-126mimic0.51±0.05*2.34±0.19*1.74±0.09*MicroRNANC0.70±0.044.15±0.211.01±0.08
*P<0.05vsother groups.
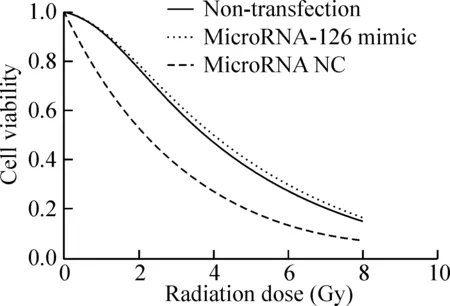
Figure 3.Survival curves after radiation in each group.
图3 各组细胞不同剂量照射后的生存曲线
4 MicroRNA-126 mimic转染可以增加SGC-7901的凋亡率
如图4所示,microRNA-126 mimic组与untransfection组相比,差异具有统计学意义(P<0.05)。4Gy处理的microRNA-126 mimic组细胞凋亡率较未照射组升高,同时也较4Gy照射而未转染组高,差异具有统计学意义(P<0.05)。该结果提示microRNA-126 mimic可能通过诱导细胞凋亡的作用而发挥放射增敏作用。
讨 论
胃癌已经成为威胁人类生命健康的重要恶性肿瘤。手术、放疗和化疗是胃癌治疗的传统方法,这3种方案的综合应用的临床效果已经得到了肯定。既往认为胃癌对放疗不敏感,因此放疗在很长一段时间都作为胃癌的姑息治疗手段。随着三维适形放疗等技术以及放疗设备的改善,以及根除术后辅助放疗效果的证实,胃癌的放疗逐渐受到重视,地位受到确定。术后辅助放疗的效果明确,患者可以通过术后放化联合治疗在无病生存和总生存率方面持续受益[9-10]。尽管如此,胃癌放疗的效果仍然不是很理想。因为对于大多数肿瘤来说,都对放疗存在一定的耐受和抵抗,如果加大放疗剂量,又会造成周围重要组织的损伤。因此,在放疗过程中,需要利用各种手段降低肿瘤细胞对射线的抵抗性和耐受性,增加其敏感性,比如辐射增敏剂的应用。目前,关于胃癌的放疗增敏药物,研究较多的是丙戊酸钠。研究认为丙戊酸钠联合放疗可诱导SGC-7901细胞细胞周期阻滞和细胞凋亡,增加SGC-7901细胞对放疗的敏感性。另外报道的一些药物还有甲基莲心碱、特异性环氧合酶抑制剂以及鱼藤素等。这些药物放疗增敏的机制不尽相同,但总结起来,实现放疗增敏的机制主要如下:(1)减弱肿瘤细胞受到辐射损伤后的修复能力,如抑制DNA修复能力,或抑制亚致死性损伤修复的能力[11];(2)增加射线对肿瘤的原发性损伤[12];(3)周期调节作用。该机制的较为复杂,研究也较为热门。对细胞周期的调节主要体现在,放疗增敏将细胞周期阻滞在对射线最敏感的阶段,如G1期向S期过渡的阶段及M期;也可通过作用于细胞周期检查点来解除周期阻滞,让DNA受损的细胞在修复完成前就进入下一周期,从而导致细胞死亡[11];(4)通过凋亡调控因子引起肿瘤细胞凋亡;(5)影响一些信号通路,比如Ras/MEK/ERK通路及PI3K/AKT/mTOR通路等[13]。以上述机制为基础,不难推测,任何具有调控细胞周期、细胞凋亡和信号通路作用的药物和分子均有可能运用于放疗增敏。
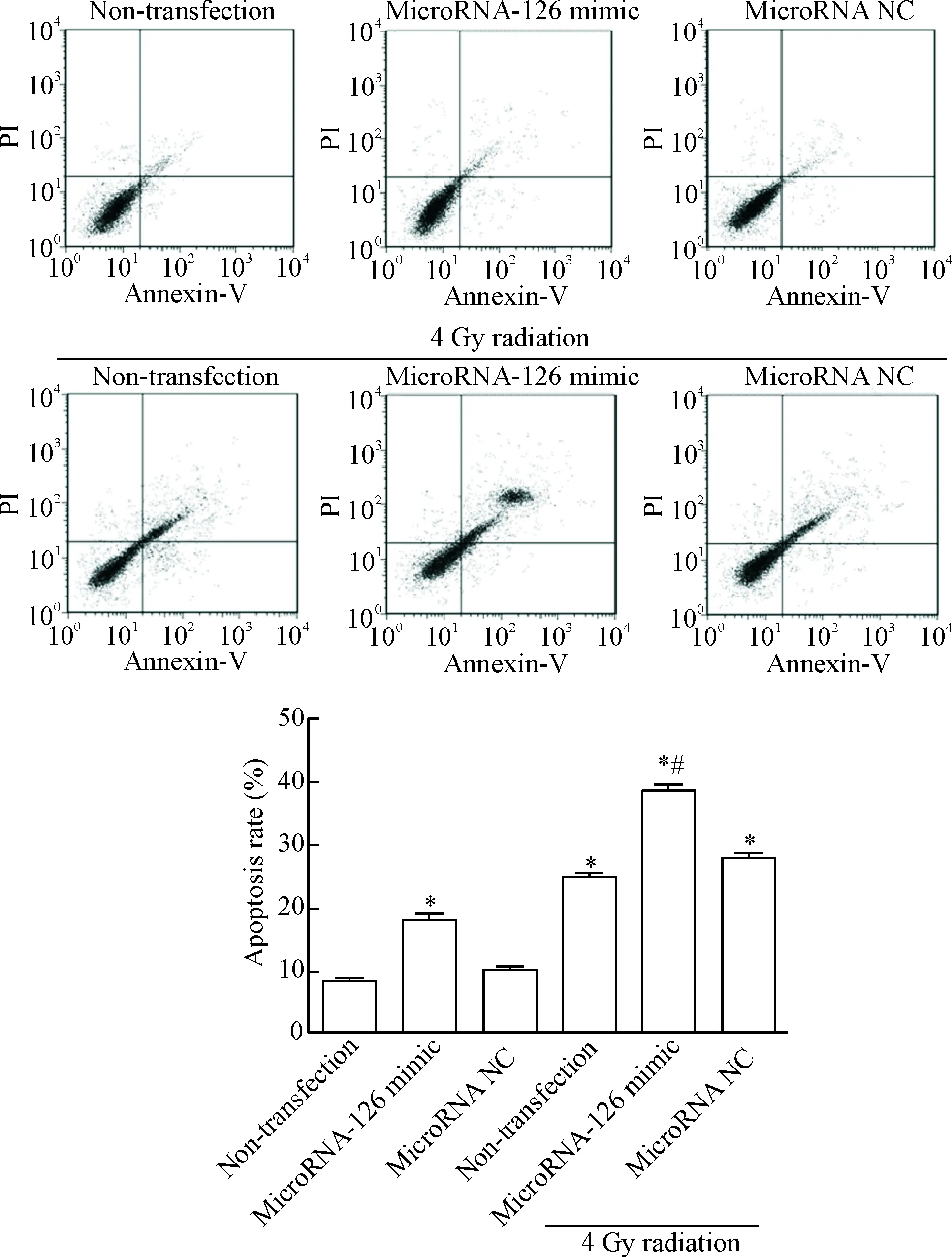
Figure 4.Apoptosis rate in each group detected by flow cytometry. Mean±SD.n=5.*P<0.05vsnon-transfection or microRNA NC group;#P<0.05vsmicroRNA-126 mimic.
图4 流式细胞术检测各组细胞凋亡率
MicroRNA为短链非编码RNA,通过与靶基因特定区域的结合,可以降解靶基因,从而使靶基因的表达降低,实现转录后调控作用。因此某一microRNA分子可能通过若干靶基因形成复杂的调控网络,从而影响细胞生长的调节。特别是在肿瘤中,大量研究已经证实microRNA可以调控肿瘤细胞的生长、周期以及凋亡,因此可用于肿瘤的诊断、评估和治疗[14-15]。MicroRNA对细胞周期、凋亡调控的特性,也决定microRNA必然具有在放疗增敏中发挥作用的潜力。本研究中,我们发现对放化综合治疗不敏感的患者存在microRNA-126的低表达,进一步通过细胞实验,我们得以证实,microRNA-126确实与肿瘤细胞的放疗敏感性有关,microRNA-126具有放疗增敏作用。之前的一些研究也证实了microRNA在肿瘤中的放疗增敏机制,如陈鑫等[16]发现microRNA-21可能引起食管癌细胞对放疗的抵抗,抑制microRNA-21可能具有放疗增敏的效果。至于microRNA发挥放疗增敏的具体机制如何,目前尚不完全清楚。如上所述,microRNA形成的调控网络是复杂的,因此目前关于microRNA放疗增敏机制的研究阐明的都是局部机制。有研究证明抑制microRNA-211可以实现结直肠癌细胞的放疗增敏,因为microRNA-211可能降低抑癌基因[17]的表达,而抑制microRNA-211后,PTEN的水平恢复,从而促进了放疗时的细胞凋亡。本研究未能阐明microRNA-126发挥放疗增敏的机制是通过何种靶基因,这有待于在后期研究中去探讨。
总之,我们认为microRNA-126水平与胃癌患者的放疗效果有关,可以作为增加胃癌放疗敏感性的潜在靶点。
[1] 邹小农, 孙喜斌, 陈万青, 等. 2003-2007年中国胃癌发病与死亡情况分析[J]. 肿瘤, 2012, 32(2):109-114.
[2] 董兵斌, 徐阿曼. 胃癌手术风险及影响因素研究现状[J]. 中国肿瘤临床, 2015, 42(2):125-128.
[3] Kumagai K, Rouvelas I, Tsai JA, et al. Survival benefit and additional value of preoperative chemoradiotherapy in resectable gastric and gastro-oesophageal junction cancer: a direct and adjusted indirect comparison meta-analysis[J]. Eur J Surg Oncol, 2015, 41(3):282-294.
[4] Trip AK, Poppema BJ, van Berge Henegouwen MI, et al. Preoperative chemoradiotherapy in locally advanced gastric cancer, a phase I/II feasibility and efficacy study[J]. Radiother Oncol, 2014, 112(2):284-288.
[5] Zhang Z, Liu T, Zhang X. Preliminary report on AT1727 as a potential radiosensitizer[J]. Int J Radiation Oncology Biol Physics, 1984, 10(12): 2305-2307.
[6] 孟昭杰, 巴雅尔, 张 明, 等. 黄连素通过调节miRNA-146 a促进乳腺癌细胞凋亡[J]. 中国病理生理杂志, 2016, 32(11):1966-1971.
[7] Wang J, Wang Q, Liu H, et al. MicroRNA expression and its implication for the diagnosis and therapeutic strategies of gastric cancer[J]. Cancer Lett, 2010, 297(2): 137-143.
[8] Wang J, Chen X, Su L, et al. MicroRNA-126 inhibits cell proliferation in gastric cancer by targeting LAT-1[J]. Biomed Pharmacother, 2015, 72:66-73.
[9] Foo M, Crosby T, Rackley T, et al. Role of (chemo)-radiotherapy in resectable gastric cancer[J]. Clin Oncol (R Coll Radiol), 2014, 26(9):541-550.
[10]Leong T, Willis D, Joon DL, et al. 3D conformal radiotherapy for gastric cancer: results of a comparative planning study[J]. Radiother Oncol, 2005, 74(3):301-306.
[11]蒋 俊, 权循凤. 基因放疗增敏的机制及临床研究进展[J]. 安徽医学, 2012, 33(8):1093-1095.
[12]钱 宇, 马建芬, 曹博强, 等. 放疗增敏剂相关研究进展[J]. 山东医药, 2013, 53(48):79-82.
[13]李 雪, 刘宁波, 赵路军, 等. mTOR抑制剂放疗增敏的研究进展[J]. 中国肿瘤临床, 2014, 41(17):1128-1130.
[14]Wang GJ, Liu GH, Ye YW, et al. The role of microRNA-1274a in the tumorigenesis of gastric cancer: accelerating cancer cell proliferation and migration via directly targeting FOXO4[J]. Biochem Biophys Res Commun, 2015, 459(4):629-635.
[15]Yamanaka S, Olaru AV, An F, et al. MicroRNA-21 inhibits Serpini1, a gene with novel tumour suppressive effects in gastric cancer[J]. Dig Liver Dis, 2012, 44(7):589-596.
[16]陈 鑫, 车少敏, 惠蓓娜, 等. 食管鳞癌放射抗拒的相关microRNA筛选[J]. 西安交通大学学报:医学版, 2013, 34(3):296-301.
[17]张晓槟, 孙 凯, 雷尚通, 等. Anti-microRNA-221通过上调PTEN蛋白表达增加结直肠癌细胞的放射增敏性[J]. 南方医科大学学报, 2013, 33(5): 728-732.
(责任编辑: 林白霜, 罗 森)
Relationship between microRNA-126 and curative effect of chemoradiotherapy in patients with gastric cancer, and enhancement effect of microRNA-126 on radiosensitivity of SGC-7901 cells
TIAN Xiao-gang, ZHAO Lin, ZHANG Chun-lin, REN Jin-xia, ZHAO Feng-ju, YANG Wen-cui, GOU Cai-xia
(TheFirstWardofDepartmentofRadiotherapy,GansuProvincialCancerHospital,Lanzhou730050,China.E-mail:liuybres@126.com)
AIM: To investigate the influences of microRNA-126 on the curative effect of chemoradiotherapy and radiosensitivity of SGC-7901 cells. METHODS: The patients of gastric cancer (n=60) were selected in this study including 32 males and 28 females with the average age of (51±7) years. All patients received similar chemoradiotherapy strategy. The tissue and blood samples were collected during treatment. The short-term curative effect was evaluated by the Response Evaluation Criteria in Solid Tumors (RECIST), and the patients were divided into sensitive group and insensitive group. The microRNA-126 levels were detected by RT-qPCR. The SGC-7901 cells were maintainedinvitroand transfected with microRNA-126 mimic. The plate colony formation assay was used to determine the enhancement effect of microRNA-126 on radiosensitivity of the SGC-7901 cells. The apoptotic rate of the SGC-7901 cells induced by microRNA-126 was analyzed by flow cytometry. RESULTS: According to the RECIST, 28 cases were defined as sensitive patients and 32 cases were the insensitive patients. Compared with the sensitive patients, the microRNA-126 levels both in blood and tissue samples were lowered in the insensitive patients, and the relative fold changes were 0.72±0.04 and 0.48±0.03, respectively (P<0.05). After transfection with microRNA-126 minic, the SF2and D0in the SGC-7901 cells were decreased with the SER of 1.74. Furthermore, microRNA-126 induced apoptosis of SGC-7901 cells and enhanced their radiosensitivity. CONCLUSION: The patients with low microRNA-126 level may suffer a poor curative effect of chemoradiotherapy on the gastric cancer. MicroRNA-126 has an enhancement effect on the radiosensitivity to the SGC-7901 cells.
Gastric cancer; Radiotherapy; Chemoradiotherapy; MicroRNA-126
1000- 4718(2017)04- 0705- 06
2016- 12- 07
2017- 02- 13
R363; R735.2
A
10.3969/j.issn.1000- 4718.2017.04.021
△通讯作者 Tel: 13838287197; E-mail: liuybres@126.com

