髓源性抑制细胞在妊娠过程中的变化及作用
张涛,许健,刁梁辉,李玉叶,文志伟,黄志超,曾勇*
(1. 深圳中山泌尿外科医院生殖中心,深圳 518043;2. 香港中文大学威尔斯亲王医院妇产科,香港 999077)
髓源性抑制细胞在妊娠过程中的变化及作用
张涛1,2,许健1,刁梁辉1,李玉叶1,文志伟2,黄志超2,曾勇1*
(1. 深圳中山泌尿外科医院生殖中心,深圳 518043;2. 香港中文大学威尔斯亲王医院妇产科,香港 999077)
目的 探索髓源性抑制细胞(MDSC)在妊娠过程中的变化以及免疫抑制作用,为母胎免疫耐受调控提供理论基础。 方法 选取2014年1~12月在我院行产检的正常妊娠妇女共106例作为研究对象,孕早、中、晚期孕妇分别为24、29、32例,产妇21例。对照组为于我院行孕前检查的正常妇女,无流产史及其他基础疾病,共34例。分别采集孕早期、中期、晚期外周血以及产妇生产时外周血、脐带血、胎盘以及蜕膜组织、产后24 h外周血进行检测。孕早、中、晚期孕妇分别为24、29、32例,产妇为21例。对照组为于我院行孕前检查的正常妇女,无流产史及其他基础疾病,共34例。采用流式细胞仪技术检测MDSC的比例,分析MDSC的变化。采用流式分选、纯化后的MDSC,与CD3+T细胞共培养,通过分析[3H]胸(腺嘧啶脱氧核)苷密度分析T细胞增殖能力。 结果 妊娠妇女外周血MDSC的比例(6.25±3.59)%显著高于未妊娠正常女性(1.70±0.77)%(P<0.01),而孕中期外周血MDSC比例(10.43±7.22)%显著高于孕早期(3.88±1.67)%、晚期(5.25±1.91)%(P<0.01);分娩后,外周血MDSC比例(1.81±1.08)%下降至妊娠前水平。脐带血、蜕膜以及胎盘组织中MDSC的比例也维持在较高水平,脐带血MDSC比例(17.15±6.00)%显著高于蜕膜(8.65±3.67)%及胎盘(7.66±3.73)%(P<0.01)。MDSC显著抑制外周血CD3+T细胞增殖能力(P<0.01)。 结论 MDSC可能参与了母胎免疫耐受的调节,抑制母体免疫排斥反应,有利于妊娠继续维持。
髓源性抑制细胞(MDSC); 母胎免疫耐受; 妊娠; 周围血; 脐带血
(JReprodMed2017,26(4):357-361)
生殖免疫学观点认为,妊娠是一种成功的同种半异体移植现象,正常妊娠取决于母胎界面免疫系统间精确的动态平衡[1]。但如果母胎双方免疫耐受被打破,则会引起母体对胎儿的排斥而发生流产[2-3]。然而母胎界面免疫耐受的确切机制目前仍不清楚。多项研究证实,髓源性抑制细胞(myloiderived suppressor cells,MDSC)在肿瘤免疫逃逸以及器官移植免疫耐受中发挥了重要的作用。MDSC是由处于不同分化阶段的不成熟的巨噬细胞、树突状细胞和中性粒细胞组成的异质性的细胞群体[4],研究发现,MDSC可以促进肿瘤细胞逃避机体免疫监控[5-6],避免移植器官被宿主免疫细胞排斥[7-8]。然而,MDSC是否也参与了母胎免疫耐受的调节,目前尚未明确。本研究探讨MDSC与妊娠的关系,为母胎免疫耐受提供更多理论基础。
资料和方法
一、临床资料
选取2014年1~12月在我院行产检的正常妊娠妇女共106例作为研究对象,分别采集孕早期、中期、晚期周围血以及产妇生产时外周血、脐带血、胎盘以及蜕膜组织、产后24 h外周血进行检测,孕早、中、晚期孕妇分别为24、29、32例,产妇是21例。对照组为于我院行孕前检查的正常妇女,无流产史及其他基础疾病,共34例。排除标准:孕期高血压、糖尿病、产前子痫、胎儿宫内生长受限、胆汁淤积综合征等产科并发症;孕前无基础疾病:如肝炎、高血压、糖尿病、肥胖等。本研究入选的所有患者均签署知情同意书,实验流程已经获得香港威尔士医院伦理委员会许可。
二、主要仪器和试剂
仪器设备主要包括FACS Canto II型流式细胞仪和FACS Aria分选仪(BD,美国)、组织分解仪(Miltenyi Biotec,德国)、β粒子计数仪(Perkin Elmer,美国)。主要试剂包括直标单抗Lineage-FITC、CD3-FITC、CD11b-PE、CD33-PE/Cy5、HLA-DR-APC及红细胞裂解液(BioLegend,美国),CD3、CD28抗体、Ficoll分离液(BD,美国),透明质酸酶、胶原蛋白酶1a、DNAse I、牛血清蛋白、[3H]胸(腺嘧啶脱氧核)苷(Sigma,美国),RPMI 1640培养液、链霉素青霉素(Invitrogen,美国),重组人IL-2细胞因子(R&D,美国)。
三、方法
1. 血液标本的采集及制备方法:采集入组人群肘正中静脉血、产妇脐带血1 ml,肝素抗凝,裂解红细胞后,调整细胞浓度为1×107/ml。取100 μl加入Lineage-FITC、CD11b-PE、CD33-PE/Cy5、HLA-DR-APC各20 μl,4℃避光静置30 min,加1 ml 5% BSA/PBS洗涤,离心5 min,弃上清,加0.5 ml 5% BSA/PBS重悬细胞混匀,上机分析。
2. 胎盘、蜕膜组织单细胞制备方法:经剖宫产术或阴道分娩出胎盘后,取中间部位组织,采用刮匙刮取1.5~3 g蜕膜组织。用PBS清洗2次后,用刀片将组织切成1 mm×1 mm×1 mm大小,在37℃消化液(200 U/ml透明质酸酶、1 mg/ml胶原蛋白酶1a、0.2 mg/ml DNAse I、1 mg/ml 牛血清蛋白)中消化40 min,每20 min用组织分解仪中速搅拌2次。脱落细胞用50 μm滤网过滤,用PBS洗涤1次后加红细胞裂解液裂解红细胞,PBS洗涤两次后将细胞浓度调整为1×107/ml,加入抗体孵育。
3. T细胞增殖实验:采集正常妇女周围血10 ml,加入Ficoll分离液梯度离心,获取单核细胞,利用流式分选仪分选CD3+T细胞。脐带血经过同样处理,分选Linlow/negHLA-DRlow/negCD33+CD11b+MDSC细胞。将纯化CD3+T细胞加入96孔板(每孔含2×105细胞),每孔加入20 μl CD3、CD28抗体和IL-2(100 U/ml)刺激T细胞增殖。按照1 000∶1,100∶1,10∶1,1∶1的比例加入纯化的MDSC,在37℃,5%CO2,95%空气湿度培养箱培养72 h后加入[3H]胸(腺嘧啶脱氧核)苷5 μl,12 h后收集细胞,利用β粒子计数仪测量[3H]胸(腺嘧啶脱氧核)苷含量。
四、统计学分析
使用SPSS 16.0进行统计学分析,应用One-wayANOVA检验评估各时期MDSC表达水平的变化,P<0.05为差异具有统计学意义。
结 果
一、一般资料分析
正常对照组妇女平均年龄(33.8±4.7)岁,孕早期孕妇平均年龄为(35.2±5.4)岁,孕中期孕妇平均年龄为(34.5±4.9)岁,孕晚期孕妇平均年龄为(36.1±3.9)岁,各组间年龄无统计学差异(P>0.01)。所有入组人群无合并高血压、糖尿病、甲亢、甲减等疾病。
二、不同孕期及分娩、分娩后周围血MDSC比例的变化
妊娠期周围血MDSC表达水平(6.52±3.59)%显著高于非妊娠妇女(1.70±0.77)%(P<0.01),妊娠中期MDSC表达量高达(10.43±7.22)%,显著高于妊娠早(3.88±1.67)%及晚期妇女(5.25±1.91)%(P<0.01)。而产后周围血MDSC开始下降,产后24 h 基本达妊娠前水平(图1、2)。
三、脐带血、蜕膜、胎盘MDSC的表达水平
脐带血、脱膜以及胎盘组织中MDSC的比例也维持在较高水平,分别为(17.15±6.00)%、(8.65±3.67)%、(7.66±3.73)%。脐带血MDSC比例显著高于蜕膜及胎盘(P<0.01),而蜕膜及胎盘组织之间MDSC比例差异无统计学意义(P>0.05)(图3)。
四、孕期周围血MDSC抑制CD3+T细胞增生分离孕中期周围血MDSC及CD3+T细胞,检测MDSC对T细胞的抑制作用,结果显示孕期MDSC可以显著抑制CD3+T细胞增殖(P<0.01),不同浓度CD3+T细胞与MDSC(1 000:1,100:1,10:1,1:1)共培养后,[3H]胸(腺嘧啶脱氧核)苷含量分别为(125 288.83±14 014.58),(79 335.72±8 809.11),(65 622.67±8 917.23),(34 963.07±6 650.96)(图4)。
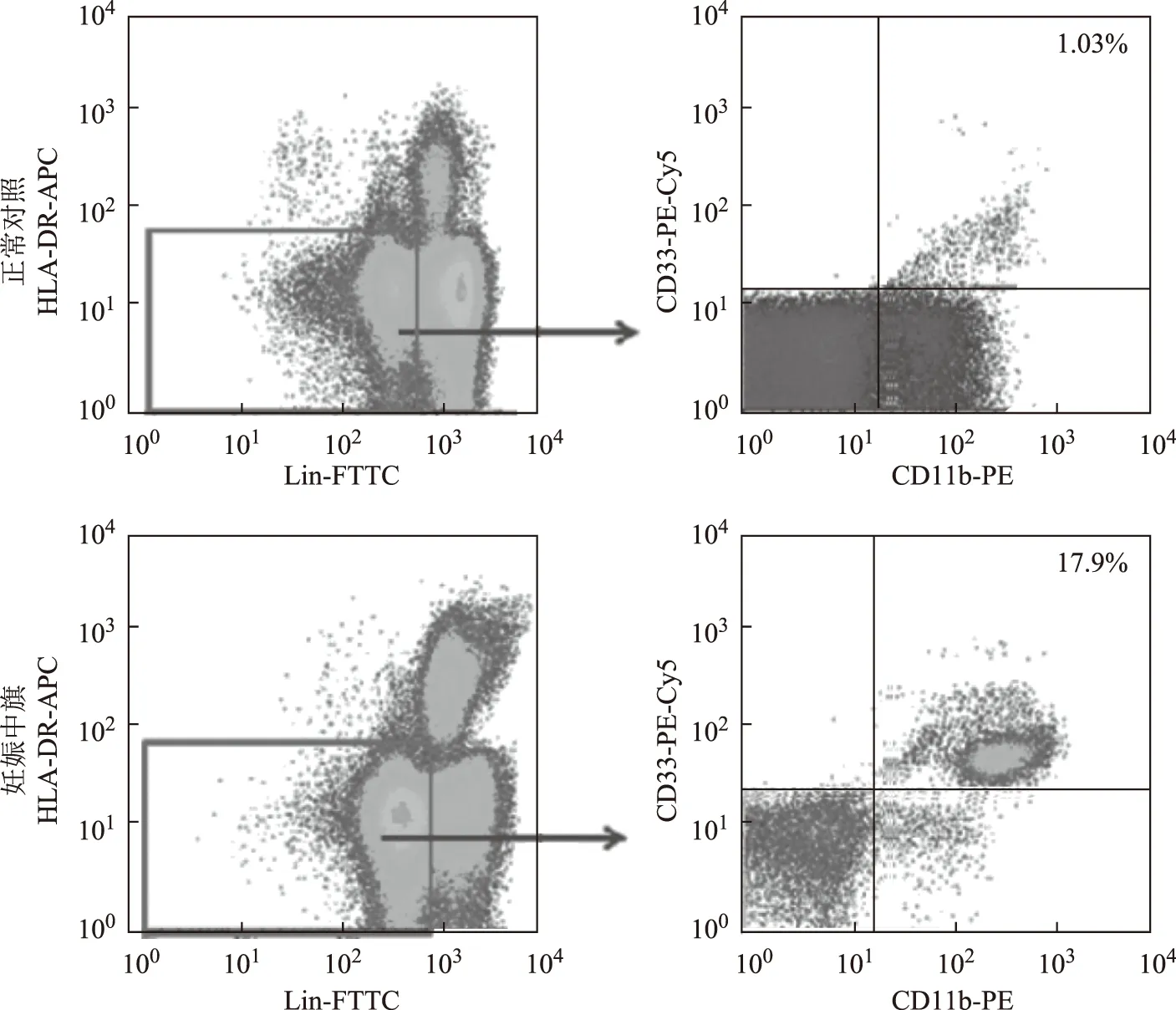
图1 妊娠中期周围血MDSC比例变化
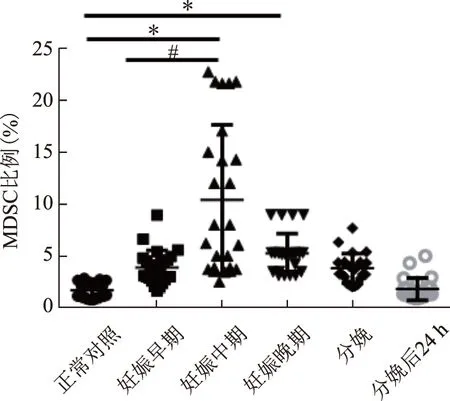
注:与对照组比较,*P<0.01;与妊娠早期比较,#P<0.01图2 妊娠期外周血MDSC的变化
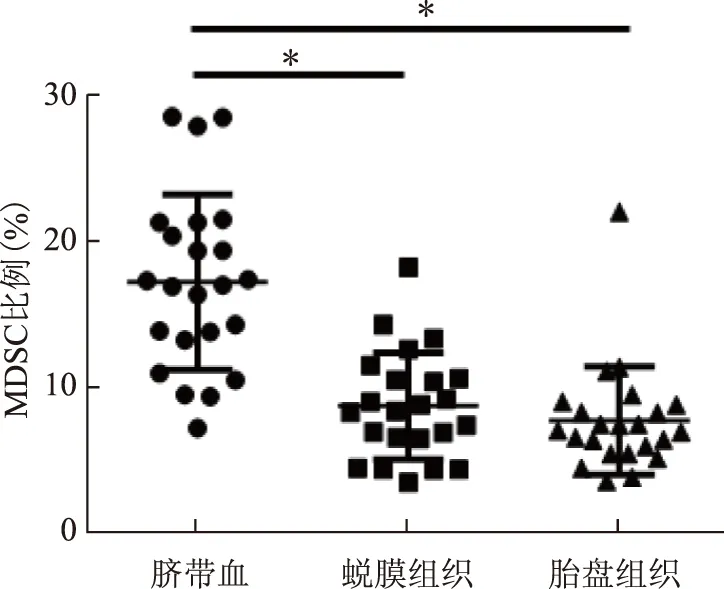
注:与脐带血比较,*P<0.01图3 胎儿脐带血、蜕膜、胎盘组织MDSC表达水平

注:与单纯T细胞增殖相比较,*P<0.01图4 MDSC显著抑制CD3+T细胞增生
讨 论
MDSC是一群表型异质细胞群,来源于骨髓祖细胞和未成熟髓细胞,是树突状细胞、巨噬细胞和粒细胞的前体,根据细胞表面标记物以及形态的不同,可分为粒细胞型MDSC(G-MDSC)和单核细胞型MDSC(M-MDSC)[9]。MDSC主要通过高表达精氨酸酶1、诱导性一氧化氮合酶(iNOS)和活性氧(ROS),抑制抗原特异性以及非特异性T细胞增殖及功能,这也被视为鉴定MDSC生物活性的重要特征之一[9]。另外,MDSC对其他免疫细胞也发挥调节作用。已有研究显示,MDSC有利于促进巨噬细胞向M2型巨噬细胞分化[10],分泌更多的IL-10和TGF-β,使免疫应答向有利于肿瘤的方向发展。MDSC还可以通过下调NK细胞表面激活性受体(NKG2D)来抑制NK细胞对肿瘤细胞的杀伤性[11]。此外,一些学者发现在肿瘤微环境中MDSC通过分泌IL-10、INF-γ和Arginase促进调节性T(Treg)细胞分化[12],Treg细胞进一步抑制抗肿瘤免疫反应。妊娠过程中,母体免疫学特征改变与肿瘤患者具有相似性,表现为T细胞增殖、杀伤功能减退[2],Th细胞因子处于抑制状态[3],NK毒性降低[3],M2型巨噬细胞[13]、Treg细胞增加[14]。这些改变共同参与母胎免疫耐受的调节,维持妊娠进行,母胎免疫耐受一旦失衡,则会导致流产、产前子痫、早产、胎儿宫内生长受限[15]。然而,引起这些免疫抑制的原因尚不清楚,MDSC是否在妊娠过程中发挥了介导肿瘤细胞免疫逃逸的类似作用至今未明。
本实验观察了妊娠不同时期周围血MDSC比例的变化,结果表明妊娠期妇女中、晚期MDSC比例显著高于正常未孕妇女,而妊娠中期MDSC比例最高,分娩后MDSC降至孕前水平,这一研究与Köstlin等[16]的研究结果相一致,这些发现均提示孕中期MDSC升高可能对妊娠的维持发挥了至关重要的作用。至今,导致妊娠妇女MDSC升高的原因并不清楚,妊娠期的生理改变,如血液系统的改变,以及血管生成因子,促、抑炎因子、人类淋巴细胞抗原的改变都可能是诱导MDSC聚集的原因,但这一推测仍需要更多的研究加以证实。
蜕膜、胎盘组织中MDSC的含量也很高,分别占组织免疫细胞的(8.65±3.67)%,(7.66±3.73)%,这说明MDSC在母胎界面可能发挥了保护作用,使胎儿避免受到母体免疫细胞的攻击。脐带血中MDSC的比率显著高于蜕膜、胎盘组织,已有研究显示脐带血以及新生儿血中MDSC含量显著高于成人,并可抑制T细胞增殖和炎症因子产生以及降低NK细胞毒性[17],以上研究发现均表明MDSC参与调控母胎免疫耐受。
本研究发现纯化MDSC可以抑制周围血抗原非特异性CD3+T细胞的增殖,这说明妊娠过程中MDSC的大量聚集对妊娠期全身免疫抑制发挥了重要作用,而母胎界面MDSC对局部免疫耐受发挥调控作用。Nair等[18]的研究发现复发性流产患者周围血MDSC的含量显著低于正常对照组人群,而复发性流产的免疫学特征表现为T细胞增殖、杀伤功能增加,促炎因子升高,NK毒性增高等。Kang等[19]的研究也发现MDSC可以通过上调Treg细胞Foxp3表达量促进母胎免疫耐受。这些研究进一步证实了MDSC参与母胎免疫耐受的调节。
国内至今尚无关于妊娠期MDSC变化的报道,本实验揭示了MDSC在妊娠过程中的变化趋势,结合功能学研究证实了MDSC可能参与母胎免疫耐受的调节。妊娠期MDSC与其他免疫细胞、细胞因子的交互作用以及与流产、早产等的关系仍需要更多研究进行探索,为母胎免疫学的发展提供更多的理论知识。
[1] Bonney EA. Immune Regulation in Pregnancy:A Matter of Perspective? [J]. Obstet Gynecol Clin North Am,2016,43:679-698.
[2] Carbone J,Sarmiento E,Gallego A,et al. Peripheral blood T-and B-cell immunophenotypic abnormalities in selected women with unexplained recurrent miscarriage[J]. J Reprod Immunol,2016,113:50-53.
[3] Gao Y,Wang PL. Increased CD56(+) NK cells and enhanced Th1 responses in human unexplained recurrent spontaneous abortion [J]. Genet Mol Res,2015,14:18103-18109.
[4] Millrud CR,Bergenfelz C,Leandersson K. On the origin of myeloid-derived suppressor cells [J]. Oncotarget,2016,doi:10.18632/oncotarget.12278.
[5] Tuettenberg A,Steinbrink K,Schuppan D. Myeloid cells as orchestrators of the tumor microenvironment:novel targets for nanoparticular cancer therapy [J]. Nanomedicine (Lond),2016,11:2735-2751.
[6] de Haas N,de Koning C,Spilgies L,et al. Improving cancer immunotherapy by targeting the STATe of MDSCs[J]. Oncoimmunology,2016,5:e1196312.
[7] Yang F,Li Y,Wu T,et al. TNFα-induced M-MDSCs promote transplant immune tolerance via nitric oxide [J]. J Mol Med (Berl),2016,94:911-920.
[8] Ochando J,Conde P,Bronte V. Monocyte-Derived Suppressor Cells in Transplantation [J]. Curr Transplant Rep,2015,2:176-183.
[9] Zhao Y,Wu T,Shao S,et al. Phenotype,development,and biological function of myeloid-derived suppressor cells[J]. Oncoimmunology 2015,5:e1004983.
[10] Fu C,Jiang L,Xu X,et al. STAT4 knockout protects LPS-induced lung injury by increasing of MDSC and promoting of macrophage differentiation [J]. Respir Physiol Neurobiol,2016,223:16-22.
[11] Elkabets M,Ribeiro VS,Dinarello CA,et al. IL-1β regulates a novel myeloid-derived suppressor cell subset that impairs NK cell development and function [J]. Eur J Immunol,2010,40:3347-3357.
[12] Serafini P,Mgebroff S,Noonan K,et al. Myeloid-derived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory T cells [J]. Cancer Res,2008,68:5439-5449.
[13] Xu Y,Romero R,Miller D,et al. An M1-like Macrophage Polarization in Decidual Tissue during Spontaneous Preterm Labor That Is Attenuated by Rosiglitazone Treatment[J]. J Immunol,2016,196:2476-2491.
[14] Figueiredo AS,Schumacher A. The T helper type 17/regulatory T cell paradigm in pregnancy [J]. Immunology,2016,148:13-21.
[15] Triggianese P,Perricone C,Chimenti MS,et al. Innate Immune System at the Maternal-Fetal Interface:Mechanisms of Disease and Targets of Therapy in Pregnancy Syndromes [J]. Am J Reprod Immunol,2016,76:245-257.
[16] Köstlin N,Kugel H,Spring B,et al. Granulocytic myeloid derived suppressor cells expand in human pregnancy and modulate T-cell responses [J]. Eur J Immunol,2014,44:2582-2591.
[17] Gervassi A,Lejarcegui N,Dross S,et al. Myeloid derived suppressor cells are present at high frequency in neonates and suppress in vitro T cell responses [J]. PLoS One,2014,9:e107816.
[18] Nair RR,Sinha P,Khanna A,et al. Reduced Myeloid-derived Suppressor Cells in the Blood and Endometrium is Associated with Early Miscarriage [J]. Am J Reprod Immunol,2015,73:479-486.
[19] Kang X,Zhang X,Liu Z,et al. Granulocytic myeloid-derived suppressor cells maintain feto-maternal tolerance by inducing Foxp3 expression in CD4+CD25-T cells by activation of the TGF-β/β-catenin pathway [J]. Mol Hum Reprod,2016,22:499-511.
[编辑:侯丽]
The change and role of myeloid derived suppressor cells during pregnancy
ZHANGTao1,2,XUJian1,DIAOLiang-hui1,LIYu-ye1,WENZhi-wei2,HUANGZhi-chao2,ZENGYong1*
1.AssistedReproductiveTechnologyCenter,ShenzhenZhongshanUrologyHospital,Shenzhen518043; 2.DepartmentofObstetricsandGynecology,theChineseUniversityofHongKong,HongKong999077
Objective:To investigate the changes of myeloid derived suppressor cells (MDSC) and its immune-suppressive function during pregnancy for providing more evidence for the maternal-fetal immune tolerance.Methods:A total of 106 women with normal pregnancy who were admitted to our hospital from January to December in 2014 were selected as subjects. The number of the pregnant women in the early,middle and late stage were 24,29,32 respectively,and 21 women were after delivery. Thirty four normal women without abortion history and other basic diseases were as control group. The peripheral blood from the normal pregnancy women at the first,second and third trimester,and cord blood,deciduas and placenta,as well as peripheral blood after 24 hours postpartum were collected for the analysis of MDSC percentage by flow cytometry. The effect of isolated pure MDSC on T cell proliferation was analyzed by the density of [3H] thymidine.Results:The percentage of peripheral MDSC in pregnancy women(6.25±3.59%)was significantly increased compared with non-pregnant healthy women(1.7±0.77%)(P<0.01);while the percentage of MDSC in the second trimester(10.43±7.22%)was significantly higher than that in the first(3.88±1.67%)and third trimester(5.25±1.91%)(P<0.01). MDSC was rapidly decreased after delivery(1.81±1.08%)to non-pregnancy level. Besides,MDSC percentage in cord blood,deciduas and placenta were also higher. The percentage of MDSC in cord blood (17.15±6.00%)was significantly higher than that in deciduas(8.65±3.67%)and placenta(7.66±3.73%)(P<0.01). The proliferation of T cells was significantly inhibited by MDSC (P<0.01).Conclusions:MDSC may play a critical role in maternal-fetal immune tolerance,suppress immune response and contribute to the maintenance of pregnancy.
Myeloid derived suppressor cells (MDSC); Maternal-fetal immune tolerance; Pregnancy; Peripheral blood; Cord blood
10.3969/j.issn.1004-3845.2017.04.013
2016-11-10;
2016-12-18
【基因项目】 深圳市科技计划基础研究项目(JCYJ20160427113429186);国家自然科学青年基金(8160060585)
张涛,女,山西长治人,博士,妇产科学专业. (*
)

