依达拉奉对脑缺血缺氧新生大鼠神经功能的影响
于沛霞,薄立军,薛 辉,郄晓娟,徐贯杰*(.河北医科大学第三医院麻醉科,河北 石家庄 05005;.河北医科大学第二医院麻醉科,河北 石家庄 050000;.河北省邯郸市第四医院麻醉科,河北 邯郸 05600)
·论 著·
依达拉奉对脑缺血缺氧新生大鼠神经功能的影响
于沛霞1,薄立军2,薛 辉3,郄晓娟1,徐贯杰1*
(1.河北医科大学第三医院麻醉科,河北 石家庄 050051;2.河北医科大学第二医院麻醉科,河北 石家庄 050000;3.河北省邯郸市第四医院麻醉科,河北 邯郸 056200)
目的观察依达拉奉对脑缺血缺氧新生大鼠神经功能和行为的影响,探讨依达拉奉保护神经功能的作用机制。方法建立新生大鼠(7 d)脑缺氧缺血损伤(hypoxia-ischemia brain damage,HIBD)模型。48只SD大鼠随机分3组,各16只,假手术组(S)仅进行手术而不造成缺氧状态,HIBD模型组(R)持续缺氧2 h,依达拉奉组(F)于HIBD 2 h即刻腹腔注射给予依达拉奉3 mg/kg。观察各组干预后新生大鼠神经功能评分、伊文思蓝及脑组织基质金属蛋白酶9(matrix metalloprotein-9,MMP-9)含量的变化,透射电镜观察病理学改变。结果R组MMP-9、2%伊文思蓝(Evans blue,EB)、神经评分分值高于S组,翻身次数少于S组。F组MMP-9、EB、神经评分分值低于R组,翻身次数R组、F组少于S组,R组少于F组,差异均有统计学意义(P<0.05)。R组新生大鼠死亡1例,F组、S组无新生大鼠死亡。结论新生大鼠脑缺血缺氧后脑组织MMP-9表达增高, 血脑屏障通透性增加,自由基清除剂依达拉奉可以保护血脑屏障通透性,改善神经功能,降低死亡率,其作用可能与抑制MMP-9在损伤脑组织中的表达有关。
脑缺血;血脑屏障;基质金属蛋白酶9
新生儿缺血缺氧造成的脑损伤是一个复杂的、多因素参与的过程,目前由于高龄产妇的增加,新生儿缺血缺氧性脑损伤的发生不断增加,如何有效地治疗新生儿缺血缺氧性脑损伤成为热点话题。在新出生大鼠的脑缺血缺氧损伤的研究中发现新生大鼠血脑屏障的完整性起着重要的作用,血脑屏障对缺血缺氧非常敏感,可导致明显的脑水肿和脑梗死,造成严重的神经功能障碍。近年来大量研究证实,蛋白酶和自由基的大量产生和释放激活基质金属蛋白酶9(matrix metalloprotein-9,MMP-9)是导致缺血缺氧损伤的主要致病因素[1-2]。本研究采用Rice的方法建立新生大鼠脑缺氧缺血模型[3],观察自由基清除剂依达拉奉对新生大鼠脑缺血缺氧后血脑屏障通透性变化和MMP-9表达的影响,旨在进一步了解新生大鼠脑缺血缺氧损伤的分子机制,并为新生儿缺血缺氧性脑损伤的临床治疗提供帮助。
1 材料与方法
1.1 实验动物 新生7 d的健康SD大鼠, 共48只,由河北省实验动物中心提供(1501100),体质量12~16 g。采用随机数字表法分成3组: 假手术(S)组、缺血缺氧(R)组、依达拉奉(F)组,每组16只。
1.2 模型制备 Rice方法建立新生大鼠脑缺氧缺血损伤(hypoxia-ischemia brain damage,HIBD)模型。7 d SD大鼠,于术前禁食6 h,自由饮水,环境温度19~22 ℃。假手术组仅进行手术而不造成缺血缺氧;缺血缺氧组建立HIBD模型,新生大鼠行左侧颈总动脉永久性结扎,2 h后置于玻璃缺氧箱中,37 ℃恒温,输入氧浓度为(8.0±0.1)%的氮氧混合气体持续缺氧2 h;依达拉奉组于持续缺氧2 h即刻腹腔注射给予依达拉奉3 mg/kg。假手术组和缺血缺氧组给予生理盐水2 mL/kg, 依达拉奉组给予依达拉奉3 mg/kg,浓度1.5 mg/mL[4]。每组均母鼠喂养24 h。
1.3 观察指标 ①各组新生大鼠24 h后死亡率。②将新生SD大鼠缺血缺氧处理后,喂养24 h,按随机原则每组选取8只,断头处死,剥离左侧脑额叶皮质备用。将新生大鼠剩余脑组织用于制备脑组织匀浆3 500 r/min离心10 min后,留脑组织匀浆上清液,酶联免疫吸附测定方法测定各组大鼠脑组织匀浆MMP-9浓度。③透射电镜下新生SD大鼠大脑血脑屏障超微结构的改变:冰盘上将新生SD大鼠大脑额叶皮质剪成符合透射电镜使用的组织小碎块,经固定冷藏1 h后,在透射电镜下观察。④每组剩余8只新生大鼠水合氯醛麻醉后,置于动物解剖实验台上固定,游离左侧股静脉,留置输液针并固定,用于注入4 mL/kg、2%伊文思蓝(Evans blue,EB)生理盐水溶液。输注1 h后,用剪刀开胸暴露心脏,将22 ℃生理盐水注入左心室,灌注压为110 mmHg,观察右心房流出液体的颜色,当液体颜色为无色时,停止灌注,立即断头处死新生大鼠。剥离并留取双侧大脑组织,电子天平称质量后制成脑组织匀浆,50 ℃恒温水浴箱保存48 h,离心机上以3 000 r/min离心15 min,取脑组织匀浆上清液用于测量EB含量。
1.4 神经功能评分 ①五点量表评估神经行为,由不知道动物分组的研究者进行操作。正常(无神经功能缺损)0分:大鼠表现正常,完全可以伸开前肢朝地抬起尾巴,晃来晃去。轻度神经功能缺损1分:起重尾巴,晃来晃去时,大鼠不能完全伸展自己的左前肢;中度神经功能缺损2分:大鼠已经减少抗侧推和轻度神经行为;严重的神经功能缺损3分:只转身成一个圆圈,并有轻度和中度神经行为;严重的神经功能缺损4分:只走路不自然,并有意识的低迷水平。②观察新生SD大鼠翻身实验:各组新生SD大鼠放置于动物实验台上,取仰卧位,助手记录新生SD大鼠翻身时,其四肢着地所用时间,当被测SD新生大鼠不能在1 min内翻身成功,则记录为翻身失败。各组每只大鼠必须不间断测试10次,结果用于统计学分析。
1.5 统计学方法 应用SPSS 23.0统计学软件处理数据。多组间计量资料比较采用单因素方差分析,两两比较采用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组各项指标比较 R组MMP-9、2% EB含量及神经功能评分分值高于S组,翻身次数少于S组。F组MMP-9、EB含量及神经功能评分分值低于R组,翻身次数R组、F组少于S组,R组少于F组,差异均有统计学意义(P<0.05)。见表1。
R组新生大鼠死亡1只,F组、S组无新生大鼠死亡。
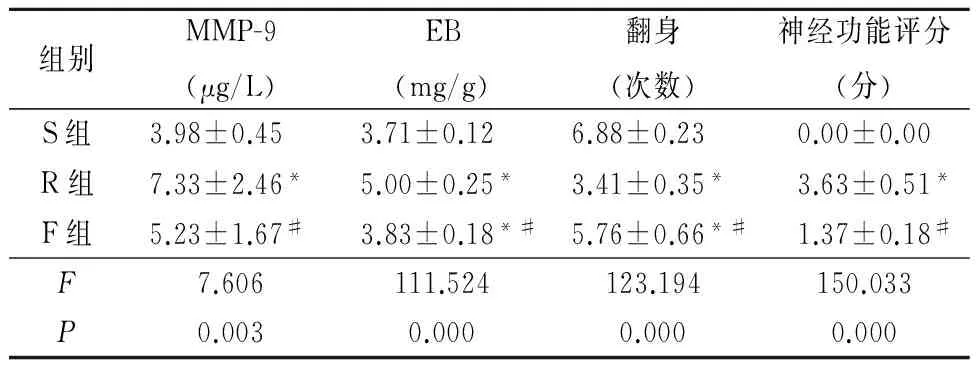
表1 3组MMP-9、EB、翻身次数、神经功能评分比较Table 1 The comparison of MMP-9,EB,turn over times and nerve function score (n=8)
*P<0.05与S组比较 #P<0.05与R组比较(SNK-q检验)
2.2 3组间电子显微镜下超微结构比较 S组:血脑屏障的结构和毛细血管的基膜完整,只有少部分线粒体嵴和膜表现为融合现象(图1)。R组:血脑屏障的结构破坏,毛细血管的基膜出现断裂,包膜大部分紧密连接不完整,线粒体肿胀,也表现出嵴或膜融合或消失(图2)。F组:血脑屏障的结构较少被破坏,毛细血管的基膜较完整,包膜连接完整,大部分紧密连接存在,部分线粒体肿胀,少量嵴和膜融合或消失(图3)。
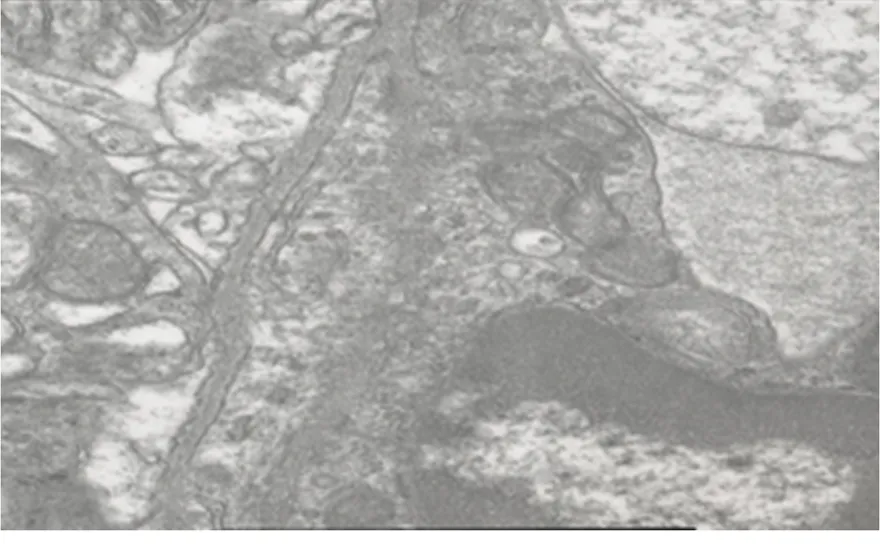
图1 S组大鼠血脑屏障的超微结构(TEM ×20 000)
Figure 1 The ultrastructure of blood brain barrier of a rat from S group (TEM ×20 000)

图2 R组大鼠血脑屏障的超微结构(TEM ×20 000)
Figure 2 The ultrastructure of blood brain barrier of a rat from R group (TEM ×20 000)

图3 Y组大鼠血脑屏障的超微结构(TEM ×20 000)
Figure 3 The ultrastructure of blood brain barrier of a rat from Y group (TEM ×20 000)
3 讨 论
新生儿胎内窘迫导致的HIBD是目前严重威胁新生儿健康甚至生命的疾病之一。HIBD是一个复杂的级联损伤过程,包含了能量代谢障碍、兴奋性氨基酸的释放、炎症级联反应、氧自由基合成释放、内环境失衡等[5]。其中由于脑缺血缺氧导致脂质过氧化反应大量持续进行,进而导致脑组织中大量自由基产生。有文献报道,氧自由基特别是超氧阴离子在HIBD后对脑水肿形成和脑细胞损伤有重要作用[2]。也有学者认为,HIBD过程中,大量活性氧及NO产生释放,进而通过各种信号途径破坏微血管的完整性,导致脑出血和水肿[6]。新生大鼠脑组织线粒体发育不成熟,ATP合成和储备能力欠缺,同时新生大鼠ATP合成的能量来源不足,内源性的抗氧化能力不完善,导致新生大鼠脑组织对缺血缺氧更敏感[7]。新生大鼠HIBD,由于脑组织脂质含量较高,导致氧自由基的大量产生,机体不能清除,使其过氧化增强,导致了脑组织细胞损伤[8]。
本研究通过Rice方法建立新生大鼠HIBD模型,结果显示,R组较S组,在脑缺血缺氧24 h,脑组织EB的含量增高,神经功能缺损评分增高,翻身次数减少,电子显微镜下结构损伤明显,脑组织匀浆MMP-9浓度表达明显升高。说明HIDB模型建立成功,HIBD破坏了血脑屏障,且影响到了脑的功能。因此,HIBD可能的机制是:新生大鼠脑缺血缺氧导致脑组织氧自由基大量合成释放, 活化MMPs,激活蛋白水解酶,进而降解基底膜,造成血脑屏障破坏,导致脑损伤和脑功能障碍。
MMPs是一组Zn2+依赖的肽链内切酶,尤其是MMP-9参与机体的许多生理病理过程[9]。在正常生理状态下MMPs低水平表达,而在缺血缺氧、外伤等条件下MMPs表达增加,MMPs被激活,影响组织细胞和基质蛋白的损伤和修复。在HIBD的病理条件下,MMP-9发挥主要作用。生理条件下,MMP-9以酶原proMMP-9的形式合成后,存在于正常脑组织中,proMMP-9是无活性的。如果某些特定因素,可导致proMMP-9酶原被激活,但小剂量的也会被降解酶迅速降解,因而组织中只存在极低水平的活化MMP-9[10]。但在病理条件下,如果proMMP-9被大量激活,不能被降解酶全部降解,MMP-9可以导致破坏部分细胞外基质成分,从而增加血脑屏障通透性,促进脑水肿形成,导致脑梗死加重,甚至表现为脑出血、脑损伤[11-12]。依达拉奉是一种新型自由基清除剂[13]。有大量文献报道,依达拉奉作为自由基清除剂和抗氧化剂,能够在脑缺血、脑外伤等条件下,降低脑组织中羟自由基的浓度[14],抑制迟发性神经元死亡,减轻血管内皮细胞的损害和缺血性的脑水肿[15-16],目前已被广泛应用于临床脑外伤和脑梗死的治疗。
本研究通过建立新生大鼠HIBD模型,造成了新生大鼠脑缺血缺氧,于缺血缺氧结束即刻,给于腹腔注射依达拉奉 3 mg/kg,观察大鼠脑组织EB含量、神经功能缺损、组织超微结构的变化和MMP-9的表达,结果显示F组较R组,脑组织EB含量明显降低,神经功能评分分值明显减少,翻身次数明显增多,电子显微镜下结构损伤明显减轻,脑组织匀浆MMP-9浓度表达明显降低。超微结构的组织形态学与生化指标结果,表明依达拉奉对新生大鼠HIBD模型造成的HIBD有明显的减轻作用。本研究结果发现MMP-9浓度在新生大鼠缺血缺氧后24 h明显升高,这说明MMP-9参与了急性HIBD过程,并进一步证实脑缺血缺氧导致的血脑屏障的开放与脑组织MMP-9活性表达增高有关。
目前大量的研究认为在HIBD的早期阶段,部分蛋白酶如MMPs对大鼠血脑屏障有明显的损害作用。结合本研究结果显示F组新生大鼠脑组织中MMP-9的浓度较R组明显降低,脑组织EB的渗出量减少,血脑屏障的完整性得到保护,提示依达拉奉可能通过抑制MMP-9的活化介导了新生大鼠血脑屏障的破坏,进而减轻HIBD。因此,依达拉奉于缺血缺氧结束即刻腹腔注射3 mg/kg,通过抑制氧自由基合成和释放,并加快氧自由基的清除,抑制了MMP-9的激活,进而减轻新生大鼠血脑屏障破坏,减轻了HIBD,改善了神经功能。其机制可能与清除自由基、抑制MMP-9在损伤脑组织中表达、减轻脑水肿有关。
[1] Piras S,Furfaro AL,Domenicotti C,et al. RAGE Expression and ROS Generation in Neurons:Differentiation versus Damage[J]. Oxid Med Cell Longey,2016,2016:9348651.
[2] Kehrer JP,Klotz LO. Free radicals and related reactive species as mediators of tissue injury and disease:implications for Health[J]. Crit Rev Toxicol,2015,45(9):765-798.
[3] 王琍琍,王杨,宣桂华,等.新生大鼠脑缺氧缺血损伤模型的建立[J].安徽医科大学学报,2004,39(4):259-261.
[4] Ren C,Li N,Wang B,et al. Limb ischemic perconditioning attenuates blood-brain barrier disruption by inhibiting activity of MMP-9 and occludin degradation after focal cerebral ischemia[J]. Aging Dis,2015,6(6):406-417.
[5] Wu Q,Chen W,Sinha B,et al. Neuroprotective agents for neonatal hypoxic-ischemic brain injury[J]. Drug Discov Today,2015,20(11):1372-1381.
[6] Phaniendra A,Jestadi DB,Periyasamy L. Free radicals:properties,sources,targets,and their implication in various diseases[J]. Indian J Clin Biochem,2015,30(1):11-26.
[7] Niatsetskaya ZV,Sosunov SA,Matsiukevich D,et al. The oxygen free radicals originating from mitochondrial complex I contribute to oxidative brain injury following hypoxia-ischemia in neonatal mice[J]. J Neurosci,2012,32(9):3235-3244.
[8] Ma NT,Zhou R,Chang RY,et al. Protective effects of aloperine on neonatal rat primary cultured hippocampal neurons injured by oxygen-glucose deprivation and reperfusion[J]. J Nat Med,2015,69(4):575-583.
[9] Bauvois B. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers:outside-in signaling and relationship to tumor progression[J]. Biochim Biophys Acta,2012,1825(1):29-36.
[10] Dayer C,Stamenkovic I. Recruitment of matrix metalloproteinase-9(MMP-9) to the fibroblast cell surface by lysyl hydroxylase 3(LH3) triggers transforming growth factor-β(TGF-β) activation and fibroblast differentiation[J]. J Biol Chem,2015,290(22):13763-13778.
[11] Turner RJ,Sharp FR. Implications of MMP9 for Blood Brain Barrier Disruption and Hemorrhagic Transformation Following Ischemic Stroke[J]. Front Cell Neurosci,2016,10:56.
[12] Chaturvedi M,Kaczmarek L. MMP-9 inhibition:a therapeutic strategy in ischemic stroke[J]. Mol Neurobiol,2014,49(1):563-573.
[13] Edaravone Acute Infarction Study Group. Effect of a novel free radical scavenger,edaravone(MCI-186),on acute brain infarction. randomized,placebo-controlled,double-blind study at multicenters[J]. Cerebrovasc Dis,2003,15(3):222-229.
[14] Lu Q,Harris VA,Rafikov R,et al. Nitric oxide induces hypoxia ischemic injury in the neonatal brain via the disruption of neuronal iron metabolism[J]. Redox Biol,2015,6:112-121.
[15] Fujiwara N,Som AT,Pham LD,et al. A free radical scavenger edaravone suppresses systemic inflammatory responses in a rat transient focal ischemia model[J]. Neurosci Lett,2016,633:7-13.
[16] Hassan MQ,Akhtar MS,Akhtar M,et al. Edaravone,a potent free radical scavenger and a calciu487463m channel blocker attenuate isoproterenol induced myocardial infarction by suppressing oxidative stress,apoptotic signaling and ultrastructural damage[J]. Ther Adv Cardiovasc Dis,2016,10(4):214-223.
(本文编辑:刘斯静)
Effect of edaravone on neurological function of newborn rats with cerebral ischemia and anoxia
YU Pei-xia1, BO Li-jun2, XUE Hui3, QIE Xiao-juan1, XU Guan-jie1*
(1.DepartmentofAnesthesiology,theThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China; 2.DepartmentofAnesthesiology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 3.DepartmentofAnesthesiology,theForthHospitalofHandan,HebeiProvince,Handan056200,China)
Objective To investigate whether Edaravone has a protective effect in model for newborn rats of hypoxic-ischemia brain damage. Methods Seven-day-old(P7) SD rats 48 were randomly divided into 3 groups(n=16, each group): control group(group S), hypoxia-ischemia brain group(group R), edaravone group(group F). P7 rats were subjected to hypoxia-ischemia brain damage for 2 h. Edaravone was treated after hypoxic-ischemia brain damage in group F. After 24h, neurological deficit scores were assessed. Matrix metalloprotein-9(MMP-9) was detected by enzyme-linked immunosorbent assay in the ischemic penumbrae of the cerebral cortex. The nervous structure was detected by electron microscopic observation. The content of Evans blue(EB) in the brain of neonatal rats was determined. Results MMP-9, EB, S score in group R were higher than that of group S. Turn over times in group R were less than that of group S. MMP-9, EB, S score in group F were lower than that of group S. Turn over times in group R and group F were less than that of group S. Turn over times in group R were less than that of group F. The differences were statistically significant(P<0.05). There is one death of rat in group R, and no death in group F and S. Conclusion The expression of MMP-9 in brain tissue of neonatal rats with cerebral ischemia and hypoxia was increased, and the permeability of blood brain barrier was increased. Edaravone treatment provides neuroprotection against cerebral ischemia and hypoxia in neonatal rats by protecting blood brain barrier permeability, improving neurological function. The mechanisms for the effect might be related to the inhibition of MMP-9 expression in cerebral ischemia and hypoxia in neonatal rats.
brain ischemia; blood-brain barrier; matrix metalloproteinase 9
2016-11-21;
2016-12-14
河北省医学科学研究重点课题(20130221)
于沛霞(1979-),女,天津人,河北医科大学第三医院主治医师,医学硕士,从事临床麻醉学研究。
R743.31
A
1007-3205(2017)04-0423-05
10.3969/j.issn.1007-3205.2017.04.013
*通讯作者

