三苞唇柱苣苔离体培养体系的建立
[KH-3D]林茂,李进华,唐庆,廖美兰,王华新,龙定建
(广西壮族自治区林业科学研究院,广西南宁530002)
三苞唇柱苣苔离体培养体系的建立
[KH-*3D]林茂,李进华,唐庆,廖美兰,王华新,龙定建*
(广西壮族自治区林业科学研究院,广西南宁530002)
以三苞唇柱苣苔(Chirita tribracteata W.T.Wang)的幼嫩叶片为外植体,开展外植体消毒灭菌、叶片愈伤组织的诱导及分化、继代增殖培养、生根培养以及植株玻璃化的研究。结果表明:叶片的灭菌方法可采用乙醇浸泡10 s结合升汞浸泡12~16 s;叶片的最佳愈伤组织诱导、分化培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L;继代增殖培养基为MS+6-BA 1.0 mg/L+IBA 0.1~0.5 mg/L或者MS+6-BA 1.0 mg/L+NAA 0.1~0.5 mg/L;最佳生根培养基为1/2MS+IBA 0.1~0.3 mg/L,生根率为100.00%;培养基中不添加6-BA或添加低浓度的6-BA或者添加适量活性炭均可减轻植株的玻璃化。
三苞唇柱苣苔;离体培养;玻璃化
三苞唇柱苣苔(Chirita tribracteata W.T.Wang)为多年生草本植物,属苦苣苔科唇柱苣苔属。三苞唇柱苣苔生于石灰岩山洞中或石灰岩石山山脚,喜阴湿,花期为6月。该物种的模式产地为石灰岩山洞,在分布上具有一定的特殊性和局限性。由于该物种对生境要求严格,分布范围又极其狭窄,使得该种成为珍稀濒危物种。在目前发现的居群中,植株数量不多,但居群更新良好。三苞唇柱苣苔具有很高的观赏价值,花量大,易爆盆,极具室内观赏盆花开发前景,由于其具有极高的药用价值,频受人类活动的干扰,导致其生境受到破坏。因此,对该种进行资源保护及开发利用研究,尤其是加强繁育及种质资源的研究有一定必要性和迫切性。苦苣苔科植物的种子都极小,不易收集贮藏,常规的播种繁育受到了一定的限制,尤其是在繁育规模和速度上。组织培养具有繁殖数量多、速度快的特点,是实现快速繁殖、资源保存的有效途径。近年来关于苦苣苔科植物的离体培养研究逐年增加,关于唇柱苣苔属植物的组培快繁研究也陆续报道[1-6],而关于三苞唇柱苣苔的组织培养方面的研究不多,仅有余海霞[7]、韦啸[8]、黄素梅[9]进行了相关报道,并成功建立了组培快繁体系。三苞唇柱苣苔的外植体以幼嫩叶片[7,9]、带腋芽花梗[8-9]、花瓣[9]为主,但黄素梅认为花梗易被诱导出不定芽,而幼叶、花瓣未能诱导出不定芽。现以三苞唇柱苣苔的幼嫩叶片为外植体,对离体培养各阶段的适宜培养基进行筛选,以期建立离体培养体系,为其种质保存、繁育提供理论依据,并为三苞唇柱苣苔的引种栽培、种质开发及可持续利用提供科技支持。
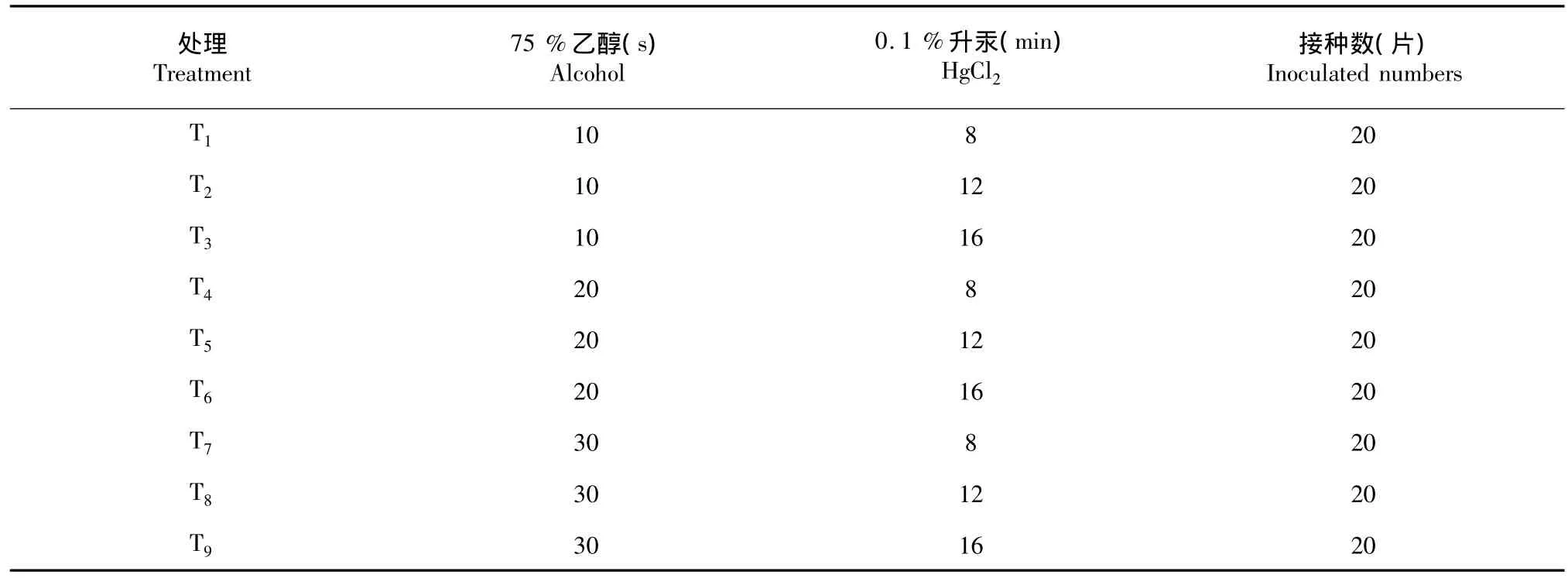
表1 外植体的灭菌方法Table 1The methods of sterilization on explant
1 材料与方法
1.1 试验材料
1.1.1 材料以野生三苞唇柱苣苔的幼嫩叶片为材料,由广西壮族自治区林业科学研究院园林花卉所提供。
1.1.2 培养基及培养条件MS培养基中,白砂糖含量为30 g/L,琼脂4 g/L,pH 5.8~6.0。1/2MS培养基的大量元素含量为MS培养基的一半,白砂糖为15 g/L,其余成分及含量同MS培养基,pH 5.8~6.0。培养温度(25±1)℃,光照时间为12 h/d,光照强度为2000 lx。
1.2 试验方法
1.2.1 外植体的消毒灭菌以三包唇柱苣苔的健康植物为母株,取其幼嫩叶片,用洗洁精浸泡叶片10 min后,在自来水下冲洗,边冲洗边用软毛刷轻轻刷洗幼嫩叶片,随后转入超净工作台上操作。在工作台上,按照表1中乙醇和升汞的灭菌时间进行消毒灭菌,乙醇和升汞灭菌后,用无菌水冲洗3~4次,将叶片切成20 mm×20 mm的大小,接种到MS的培养基上。每种灭菌方法的处理叶片数为20片,重复3次。15 d后统计叶片污染、成活情况,并计算污染率、成活率:污染率(%)=污染数/接种数×100 %;发芽率(%)=萌发数/接种数×100%。
1.2.2 愈伤组织诱导与分化将未污染的叶片切成5 mm×5 mm的大小,叶片四周切除部分组织,使其四周带有伤口,然后接种在含有不同激素种类和浓度的培养基上,进行愈伤组织的诱导与分化培养,每种培养基的接种量为20片,重复3次。每天观察愈伤诱导情况,连续观察25 d后,统计愈伤诱导数以及分化数,并计算愈伤组织诱导率、愈伤组织分化率。
愈伤组织诱导率(%)=产生愈伤组织的叶片数/接种数×100
愈伤组织分化率(%)=发生分化的愈伤数/接种数×100
1.2.3 继代增殖培养将愈伤分化获得的组培芽,接种在添加了不同激素组合配比的继代增殖培养基上,每种培养基的接种量为20株,重复3次。每天观察组培芽的继代增殖情况,连续观察25 d后,统计新芽数,并计算增殖系数。
增殖系数=新芽数/接种数
1.2.4 生根培养当植株小苗高度为3~4 cm时,将其接种在不同的生根培养基上,每种培养基的接种量为20株,重复3次。每天观察小苗的生根以及生长情况,连续观察20 d后,统计生根数、根数,并计算生根率。
生根率(%)=生根数/接种数×100
1.2.5 组培苗玻璃化的预防以MS为基本培养基,将健壮的组培芽分别接种在含有不同6-BA浓度、不同活性炭、的培养基上,如表2、3。每种培养基的接种量为20株,重复3次。每天观察植株的生长情况,连续观察20 d后,统计玻璃化数,并分析6-BA浓度、不同活性炭对组培苗玻璃化影响。
玻璃化率(%)=玻璃化苗数/接种数×100
1.3 统计分析
使用SPSS 19.0统计软件进行差异显著性测验(Duncan’s多重比较),数据用平均值表示。

表2 6-BA对玻璃化的影响Table 2Effects of 6-BA on vitrification
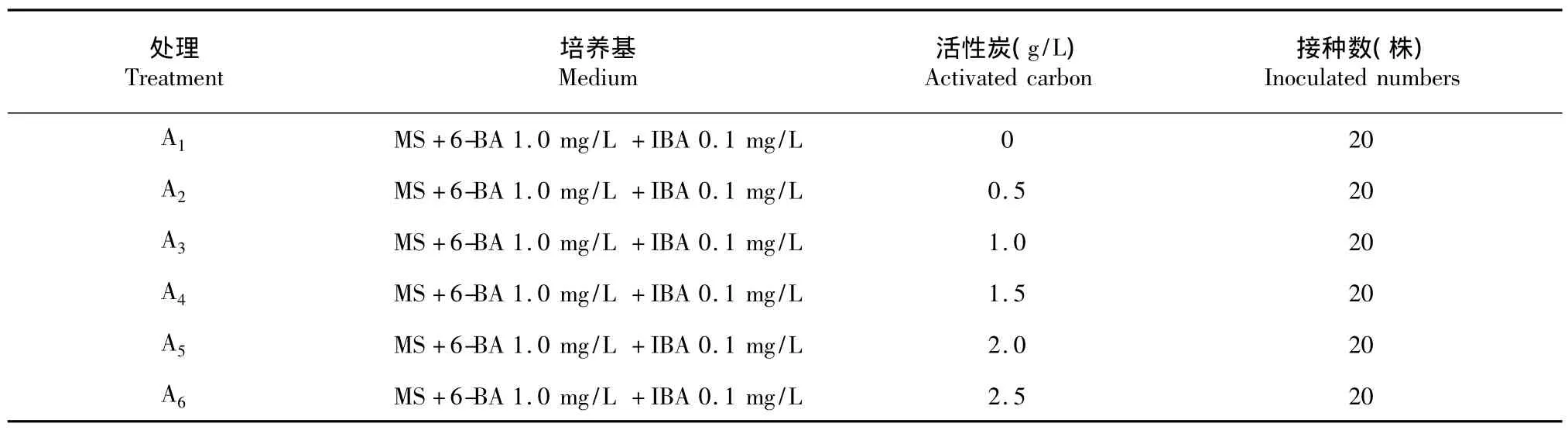
表3 活性炭对玻璃化的影响Table 3Effects of activated carbon on vitrification
2 结果与分析
2.1 外植体的消毒灭菌
从表4可看出,T1的污染率显著高于其余8个处理的污染率,T1的成活率显著低于T2、T3、T4的成活率;T8、T9的污染率显著低于其余7个处理的污染率,T8、T9的成活率也显著低于T2、T3、T4的成活率。T2、T3的污染率无显著差异,分别为51.67%、46.47%;T2、T3的成活率无显著差异,2个处理的成活率显著高于其他处理,分别为28.33%、31.67 %。由此表明,不同消毒处理方式对外植体的影响不同。在相同的乙醇灭菌时间下,随着升汞灭菌时间的增加,污染率降低,成活率则表现出不同的变化:乙醇灭菌时间短,成活率呈上升趋势,乙醇灭菌时间长,成活率呈下降趋势。在相同的升汞灭菌时间下,随着乙醇灭菌时间的增加,污染率在降低,成活率的变化趋势无规律。综上可知,乙醇、升汞的灭菌时间对三苞唇柱苣苔的外植体影响大,灭菌时间短,污染率高,灭菌时间长,成活率偏低,其中,乙醇灭菌时间10 s结合升汞灭菌12~16 s,可以成功获得三苞唇柱苣苔的无菌外植体。
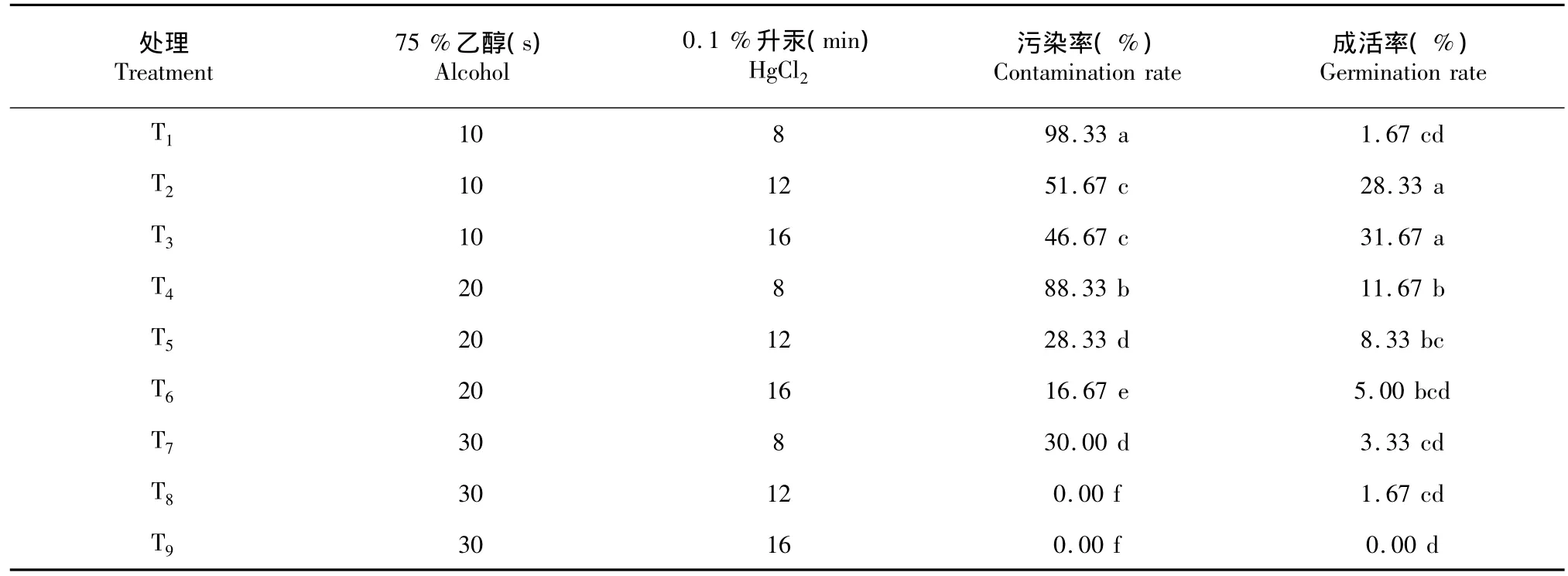
表4 不同消毒处理方式对三苞唇柱苣苔外植体的影响Table 4Effects of different methods of sterilization on explants of the Chirita tribracteata W.T.Wang
2.2 愈伤组织诱导与分化
从表5可知,I3、I6的愈伤诱导率分别为96.67 %、98.33%,显著高于I1、I4,I3、I6的愈伤诱导率。I2、I5的愈伤诱导率无显著差异。I3的愈伤分化率显著高于I1、I4、I5、I6,I3的愈伤分化率与I2的无显著差异,I3的愈伤分化率为96.67%。由此可得,不同种类和浓度的生长素对三苞唇柱苣苔均可诱导出愈伤组织,并且随着生长素浓度的增加,愈伤诱导率呈上升趋势;但不同的生长素对愈伤组织分化率的影响不同,2,4-D的愈伤分化率显著低于NAA的愈伤分化率。可见,生长素NAA对愈伤的诱导和分化均有显著作用。当培养基为MS+6-BA 2.0 mg/L+ NAA 0.1 mg/L,愈伤诱导率为96.67%,愈伤分化率为96.67%,愈伤组织在叶片的切口处发生,分化出的组培芽较多。
2.3 继代增殖培养
由表6可看出,Z11的增殖系数为12.10,显著高于Z1、Z2、Z7的增殖系数,但Z11培养基上的植株生长差,植株出现玻璃化、黄化的现象。Z1、Z2、Z7、Z8的增殖系数无显著差异,且植株生长健壮,植株玻璃化少。由此可知,不同激素配比对三苞唇柱苣苔的继代增殖培养影响不同,当6-BA的浓度为1.0mg/L时,增殖系数虽然较低,但植株健壮,植株玻璃化程度不高。而随着6-BA的浓度的升高,增殖系数也升高,但此时的植株大部分生长细弱,出现玻璃化甚至黄化的现象。综上可得出,在培养基MS+6-BA 1.0 mg/L+IBA 0.1~0.5 mg/L或者MS+6-BA 1.0 mg/L+NAA 0.1~0.5 mg/L上,植株生长健壮,植株的玻璃化少。
2.4 生根培养
从表7可看出,各处理间的生根率无显著差异,生根率均为100.00%。R1、R2的根数显著低于与其余处理的根数。由此表明,三苞唇柱苣苔的生根率不受基本培养基、激素种类和浓度的影响,即在不添加任何激素的MS、1/2MS培养基上均可诱导不定根的形成。但激素的有无对根数的影响存在显著差异,在不添加任何激素的MS、1/2MS培养基的根数显著偏低,而在添加了激素的MS、1/2MS培养基上,根数随着激素浓度增加而增加。尤其是在1/2MS培养基上添加IBA浓度为0.1~0.3 mg/L时,生根最佳,植株健壮,生根极快,根白,有侧根。综上所述,三苞唇柱苣苔最佳生根培养基为1/2MS+IBA 0.1~0.3 mg/L,生根率为100.00%,植株生长健壮,生根极快,根系白色,并带有侧根。

表5 三苞唇柱苣苔的愈伤组织诱导与分化Table 5Callus induction and callus differentiation of the Chirita tribracteata W.T.Wang
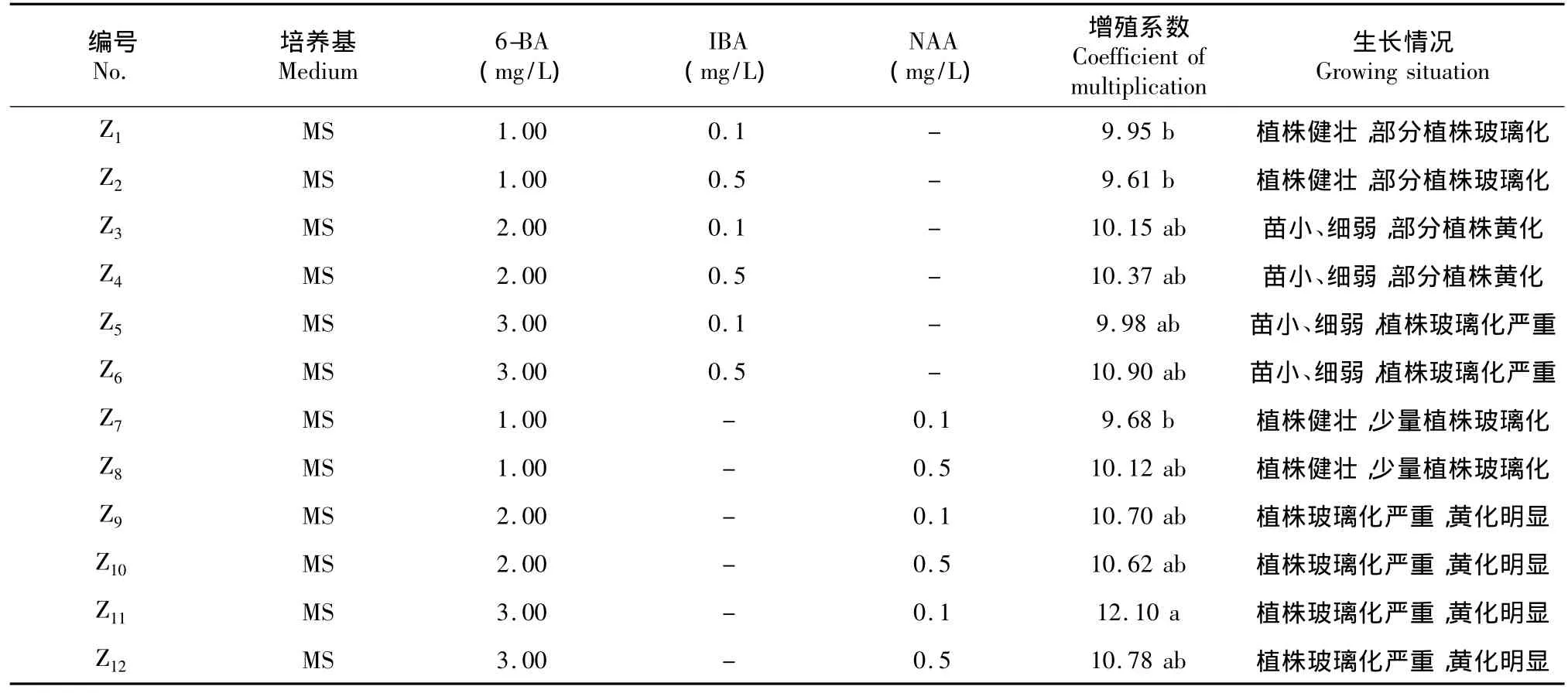
表6 不同激素配比对三苞唇柱苣苔的继代增殖培养的影响Table 6Effects of different hormone combinations on proliferation culture of the Chirita tribracteata W.T.Wang
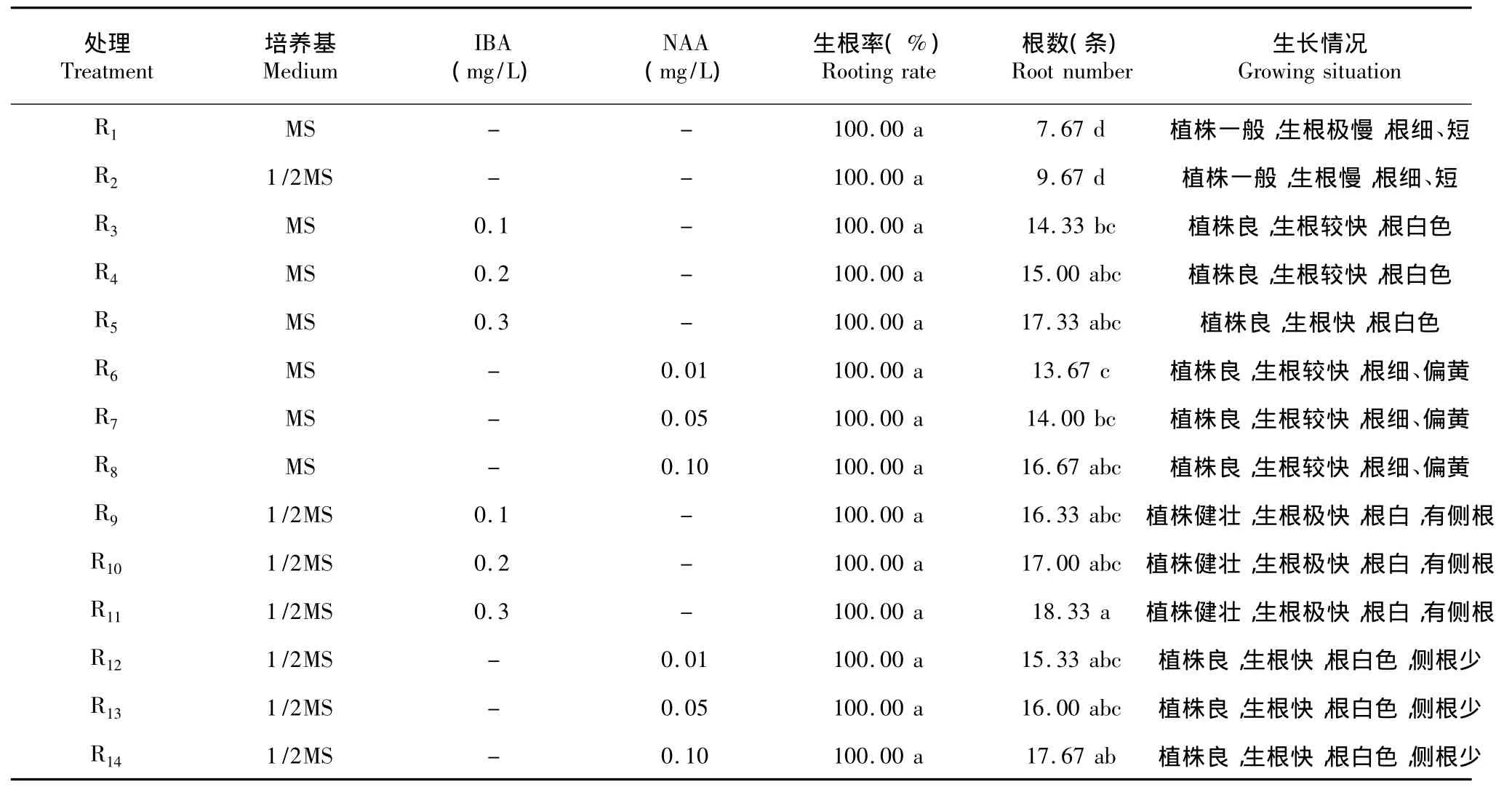
表7 不同激素配比对三苞唇柱苣苔的生根培养的影响Table 7Effects of different hormone combinations on rooting culture of the Chirita tribracteata W.T.Wang
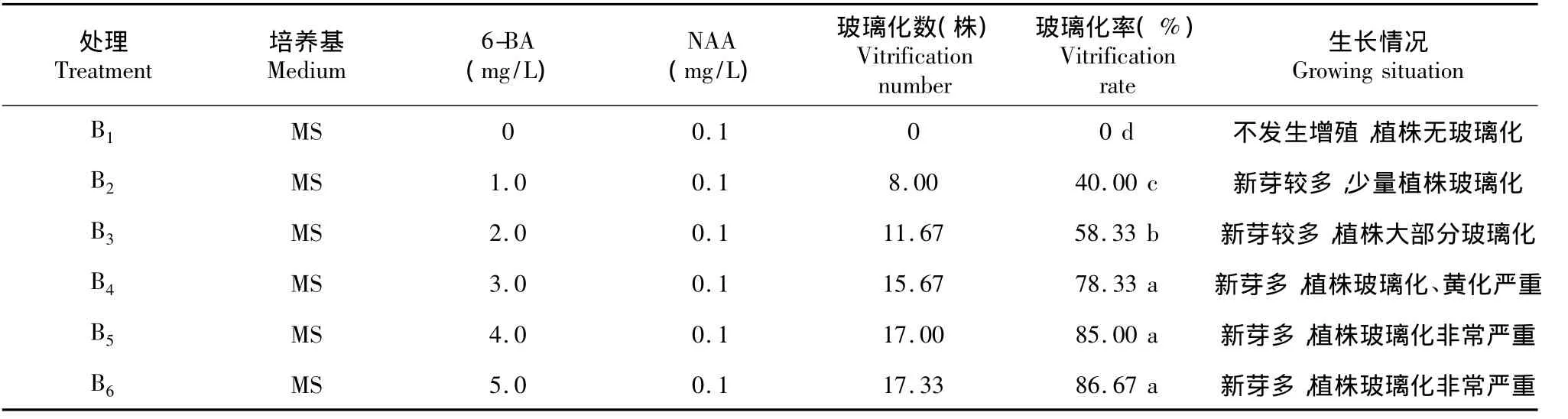
表8 不同6-BA浓度对三苞唇柱苣苔玻璃化的影响Table 8Effects of different concentrations of 6-BA on vitrification of the Chirita tribracteata W.T.Wang
2.5 组培苗玻璃化的预防
2.5.16 -BA对玻璃化的影响由表8可看出,B1的玻璃化率显著低于其他处理,玻璃化率为0,B2的玻璃化率显著低于B3、B4、B5、B6,B3的玻璃化率显著低于B4、B5、B6,B4、B5、B6的玻璃化率无显著差异,其中B6的玻璃化率最高,为86.67%。由此表明,6-BA是影响三苞唇柱苣苔植株玻璃化的因素之一,随着6-BA浓度的增加,植株的玻璃化率逐渐增加,当6-BA的浓度达到3.0 mg/L以上时,玻璃化率增加不显著。因此,为有效预防植株发生玻璃化,可在培养基中不添加6-BA,但考虑到增殖培养的目的是大量扩繁,适当添加6-BA有利于新芽的获得,因此,当6-BA与NAA比例适宜时,即培养基为MS+ 6-BA1.0 mg/L+NAA 0.1 mg/L时,可有效减轻植株玻璃化。
2.5.2 活性炭对玻璃化的影响由表9可看出,A1的玻璃化率显著高于其他处理,玻璃化率为56.67 %,A2的玻璃化率显著高于A4、A5、A6,A2、A3的玻璃化率无显著差异,A4、A5、A6的玻璃化率无显著差异,其中A6的玻璃化率最低,为26.67%。由此表明,活性炭是影响植株玻璃化的因素之一,随着活性炭浓度的增加,植株的玻璃化率逐渐降低,当活性炭的浓度达到1.0 mg/L以上时,玻璃化率降低不显著。因此,在培养基中适当添加活性炭可以有效减轻植株的玻璃化率。
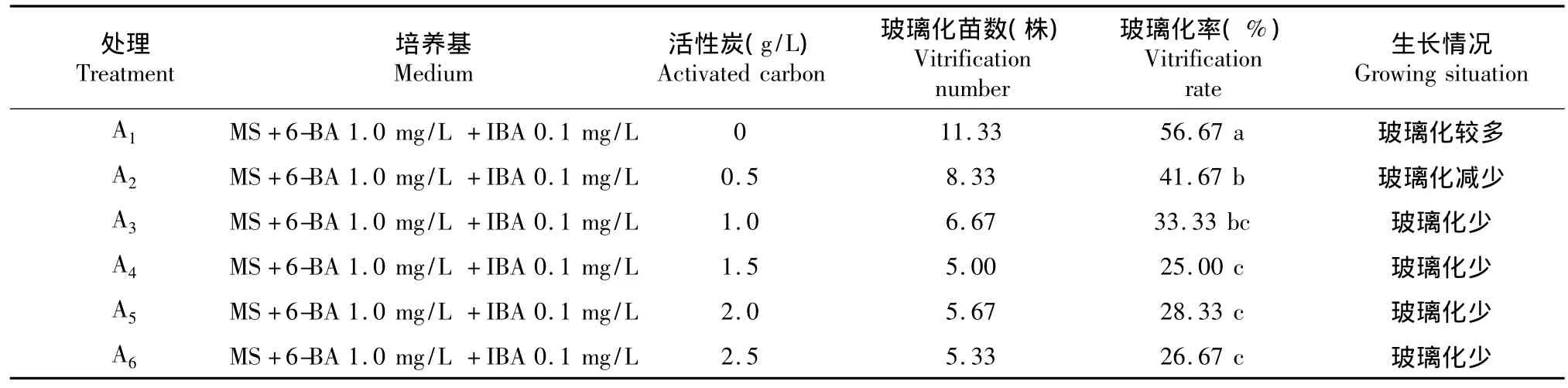
表9 活性炭对玻璃化的影响Table 9Effects of activated carbon on vitrification of the Chirita tribracteata W.T.Wang
3 讨论与结论
苦苣苔科植物的特征之一是叶片具有茸毛,这给外植体的消毒灭菌带来极大的困难。本研究的几种处理均未达到很好的消毒效果,原因之一可能是叶片带茸毛从而影响了消毒效果,这与韦啸[8]等看法是一致的。在前人的研究中,有采用70%乙醇灭菌30 s,0.1%HgCl2灭菌4 min对荔波唇柱苣苔进行灭菌,外植体污染率30%,成活率为57%[2],也有采用70%乙醇灭菌30 s后再用0.1%HgCl2表面消毒7 min,其污染率仅为26.7%,成活率达73.3%[8],后者达到较高成活率的原因可能是其以花梗为外植体。本试验选择幼嫩叶片为外植体,是基于叶片取材容易,对母株伤害小为出发点,但有研究认为唇柱苣苔属其他植物以花梗作为外植体进行离体快繁的效果好于幼叶[9],甚至有将带苞片的花蕾作为外植体进行组培快繁的[10]。
植物组织培养中植株出现呈半透明状、脆弱易破碎的现象称为玻璃化[11]。发生玻璃化的植株所含叶绿素及蛋白质含量低,不利于移栽成活,其原因可能与培养的环境条件有关,培养基水势过高,培养容器相对湿度大,培养基中的细胞分裂素浓度高所致。细胞分裂素浓度过高导致玻璃化的研究前人报道较多。对大苞短毛唇柱苣苔叶片进行诱导时,当TDZ浓度高于0.5 mg/L时,不定芽玻璃化现象严重[1]。赵佐敏[12]指出随着6-BA浓度的增加,非洲菊外植体分化出的玻璃化苗比例呈递增趋势,此结论在香石竹[13]等的组培中也得到验证。现有的研究表明,苦苣苔科植物的组织培养中发生玻璃化频率高。在本研究中,玻璃化的现象严重,通过实验发现,在培养基中不添加6-BA或适当添加低浓度的6-BA可以有效缓解玻璃化现象,这与黄素梅[9]的研究结果是一致的。玻璃苗发生的百分率随6-BA浓度的增加而增加。此外,在培养基中适当添加活性炭也可以减轻植株的玻璃化。
本试验以叶片为外植体,成功建立了三苞唇柱苣苔的立体培养体系,外植体的灭菌方法可采用乙醇浸泡10 s结合升汞浸泡菌12~16 s;叶片的最佳愈伤组织诱导、分化培养基为MS+6-BA 2.0 mg/L +NAA 0.1 mg/L,愈伤诱导率为96.67%,愈伤分化率为96.67%;继代增殖培养基为MS+6-BA1.0 mg/L+IBA 0.1~0.5 mg/L或者MS+6-BA 1.0 mg/L+NAA 0.1~0.5 mg/L;最佳生根培养基为1/ 2MS+IBA 0.1~0.3 mg/L,生根率为100.00%;培养基中不添加6-BA或添加低浓度的6-BA或者添加适量活性炭均可减轻植株的玻璃化。
[1]文弢,娄丽,侯娜,等.大苞短毛唇柱苣苔离体培养和快速繁殖[J].天然产物研究与开发,2016,28:350-353.
[2]侯娜,田晓瑞,娄丽,等.荔波唇柱苣苔离体叶片不定芽的诱导及植株再生[J].林业科技开发,2015,29(4):67-70.
[3]Chuanming FU,Kanghua XIAN,Jinxiang HE,et al.Rapid Propagation of Chirita Ophiopogoides in Vitro[J].Agricultural Science&Technology,2015,16(12):2677-2681.
[4]张占江,李翠,吕惠珍,等.条叶唇柱苣苔组织培养研究[J].种子,2013,32(9):19-22.
[5]潘梅,戚华莎,黄赛,等.烟叶唇柱苣苔叶片分化与植株再生研究[J].北方园艺,2014,(23):83-86.
[6]张占江,李翠,韦莹,等.珍稀濒危药用植物弄岗唇柱苣苔离体保存研究[J].北方园艺,2014(4):136-138.
[7]余海霞,凌征柱,黄雪彦,等.三苞唇柱苣苔的组织培养与快速繁殖[J].植物生理学通讯,2010,46(11):1177-1178.
[8]韦啸,唐赛春,黄素梅.三苞唇柱苣苔花梗的离体培养[J].北方园艺,2011,(16):144-147.
[9]黄素梅.三苞唇柱苦芭苔组织培养快速繁殖技术研究[D].南宁:广西大学,2005.
[10]梁桂友.三种苦苣苔科植物组织培养快速繁殖研究[D].北京:北京林业大学,2007:6-7.
[11]温放,李湛东,张启翔.牛耳朵的离体培养和快速繁殖[J].植物生理学通讯,2006,42(5):906.
[12]赵佐敏.非洲菊组培苗玻璃化控制研究初报[J].贵州农业学报,2005,33(3):77.
[13]李瑶,王利华,叶鸣明,等.影响香石竹试管苗玻璃化的因素[J].植物生理学通讯,1997,33(4):256-258.
(责任编辑 王冠玉)
Study on in Vitro Propagation Technology of Chirita tribracteata W.T.Wang
LIN Mao,LI Jin-hua,TANG Qing,LIAO Mei-lan,WANG Hua-xin,LONG Ding-jian*
(Guangxi Zhuang Autonomous Region Forestry Research Institute,Guangxi Nanning 530002,China)
The leaves of Chirita tribracteata W.T.Wang were used as material,and the disinfectant method,callus induction,callus differentiation,proliferation subculture,rooting culture and vitrification of plant were studied.The results showed that the disinfectant method was 75%ethanol for 10s with 0.1%HgCl2for 12-16 min.The suitable medium of callus inducing and differentiation from leaves was MS+6-BA 2.0 mg/L+NAA 0.1 mg/L,the suitable medium of proliferation culture was MS+6-BA 1.0 mg/L+IBA 0.1-0.5 mg/L or MS+6-BA 1.0 mg/L+NAA 0.1-0.5 mg/L;the optimum medium for rooting was 1/2MS+IBA 0.1-0.3 mg/L,rooting rate was 100.00%.The vitrification of the plant could be reduced by adding 6-BA or adding low concentration 6-BA or adding the appropriate amount of activated carbon in the medium.
Chirita tribracteata W.T.Wang;In vitro;Vitrification
S543
A
1001-4829(2017)1-0199-06
10.16213/j.cnki.scjas.2017.1.034
2016-08-21
国家林业局部门预算广西项目(桂林护预2015007);广西壮族自治区林业科学研究院基本科研业务费项目(林科201405号)
林茂(1980-),男,广西来宾人,工程师,主要从事花卉栽培、遗传育种以及园林工程研究,E-mail:49888178@qq.com,*为通讯作者,E-mail:1805507895@qq.com。

