小花棘豆中毒对家兔睾丸生精细胞凋亡的影响
[KH-*3D]王帅,贾琦珍,陈根元,王连群,张玲*
(1.塔里木大学动物科学学院,新疆阿拉尔843300;2.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔843300)
小花棘豆中毒对家兔睾丸生精细胞凋亡的影响
[KH-*3D]王帅1,2,贾琦珍2,陈根元2,王连群1,2,张玲1,2*
(1.塔里木大学动物科学学院,新疆阿拉尔843300;2.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔843300)
研究小花棘豆中毒对家兔睾丸生精细胞凋亡的影响,进一步探讨小花棘豆的中毒机理。将24只雄性家兔随机分为对照组和试验Ⅰ、Ⅱ、Ⅲ组,试验组分别按照Ⅰ组15%(苦马豆素含量30 mg/kg)、Ⅱ组30%(苦马豆素含量60 mg/kg)、Ⅲ组45%(苦马豆素含量90 mg/kg)的比例添加小花棘豆,对照组仅饲喂苜蓿干草,试验期70 d。分别于攻毒后第14、35、70天每次每组随机采集2只家兔的睾丸,通过TUNEL法定位,Hoechst 33258荧光染色细胞核,流式细胞仪测定细胞凋亡率和细胞周期。从第35天开始,试验组家兔生精细胞凋亡率均极显著升高(P﹤0.01),表现为细胞膜下陷,细胞器浓缩,细胞核碎裂等,并出现凋亡小体。试验组家兔睾丸单倍体细胞和二倍体细胞凋亡率均极显著升高(P﹤0.01),但四倍体细胞数量无显著变化。与对照组相比,中毒家兔睾丸生精细胞G0/G1期数量升高,S期细胞数量降低,而且G1期与S期细胞数量呈显著的负相关。小花棘豆中毒可导致家兔睾丸组织生精细胞凋亡,且与小花棘豆毒性成分呈现一定的时间-剂量效应。
小花棘豆;苦马豆素;生精细胞;细胞凋亡;细胞周期
小花棘豆(Oxytropis glabra DC)为豆科棘豆属植物,是南疆阿克苏、克州、和田等地区分布最广泛,危害最严重的有毒植物。据不完全统计,南疆地区已有近15%的天然草场中广泛丛生小花棘豆,其盖度均在50%左右,严重的盖度可达95%以上;放牧家畜每年采食小花棘豆中毒的数量约为50 000~100 000只(头),其中50%以上的中毒家畜死亡[1]。中毒家畜主要表现为繁殖系统和神经系统损伤,其中睾丸、卵巢、脑组织等器官均出现细胞空泡变性、细胞核萎缩等病理变化[2]。王帅等[3-4]研究发现,小花棘豆的主要毒性成分是苦马豆素(Swainsonine,SW),可导致中毒动物睾丸萎缩、精子数量与活性降低,最终导致雄性动物生精功能障碍。庞龙[5]通过建立大鼠大脑皮质神经元体外培养模型,检测了SW对大鼠大脑皮质神经细胞的毒性作用。其研究发现SW对神经细胞存在明显的剂量-效应毒性作用,并导致神经细胞的凋亡率显著增加。张樑[6]进一步研究发现SW可导致神经细胞胞核浓缩,DNA片段化,最终导致细胞凋亡。其作用机理为SW可影响caspase-8和caspase-3的级联反应,而不是经线粒体通路介导神经细胞凋亡。目前有关SW对细胞凋亡的影响的试验主要集中于其对癌细胞和神经细胞的作用上,对生精细胞的凋亡及基因表达未见报道。生精细胞正常情况下可通过细胞凋亡的方式清除异常细胞,但外源毒素诱导的生精细胞大量凋亡会导致睾丸细胞退化,其继发性损害可严重影响动物的生殖能力。本课题组前期研究[2]发现小花棘豆中毒家兔睾丸指数极显著升高,HE染色后镜检发现中毒家兔睾丸间质细胞、生精上皮细胞等出现空泡变性,但其中毒的分子作用机制尚不明确。本试验通过制备亚慢性小花棘豆中毒家兔模型,探讨小花棘豆中毒诱导家兔生精细胞凋亡的机制。
1 材料与方法
1.1 材料
原位凋亡检测试剂盒,德国Boechringer Mannheim公司;Hoechst 33258染液,Beyotime(中国)公司;Annexin V-FITC Apoptsis Detection KIT,美国BD公司,DNA-PERP STAIN细胞周期试剂盒,美国Beckman Coulter公司。其余试剂均为国产分析纯。
CKX41型倒置相差显微镜,IX71型倒置荧光显微镜,日本Olympus株式会社;FAC Scam型流式细胞仪,美国BD公司;5810 R型高速冷冻离心机,德国Eppendorff公司;DSC型切片机,HI1220型温控烤片台,德国Leica公司。
1.2 实验动物分组与处理
雄性家兔24只,体质量(2.0±0.1)kg,平均分为对照组和3个试验组,分笼饲养。对照组仅饲喂青苜蓿干草,3个试验组分别饲喂掺入小花棘豆15 %、30%和45%(按气相色谱法计算苦马豆素含量分别为30、60和90 mg/kg[7])的混合干草,试验期70 d。试验第14、第35和第70天各组分别剖杀2只家兔取睾丸,将家兔睾丸组织在4℃下沿横断面劈开,部分置于Bouin’s液中后固定24 h后常规方法脱水、透明,石蜡包埋后制作切片,片厚4 μm。切片贴于涂有3-氨丙基三乙氧基硅烷的载玻片上,37℃过夜后用于TUNEL染色;部分睾丸组织剪成1~2 mm大小,置于5 mL PBS液(pH 7.4)中,涡旋振荡3 min后使用200目尼龙滤网过滤,1500 r/min离心5 min后弃去上清,再置于5 mL PBS液中混匀。相同条件下重复3次即得到单细胞悬液,用于Hoechst 33258染色和细胞周期比例的检测。
1.3 TUNEL法检测小花棘豆中毒家兔生精细胞凋亡
将组织切片依次使用二甲苯、无水乙醇、95%乙醇和75%乙醇洗涤;然后使用3%H2O2处理10 min,去离子水洗涤;然后利用Proteinase K 37℃消化10 min,0.01 mol/L TBS洗涤;每个切片加标记缓冲液18 μl,TDT 1 μl,DIG-d-UTP1 μl,混匀后甩去切片上液体,加标记液20 μl,37℃反应2 h;0.01 mol/L TBS洗涤后加封闭液50 μl,室温反应30 min;弃去封闭液,用抗体稀释液将生物素化抗地高辛抗体稀释至1∶100,每片加50 μl,37℃反应30 min;0.01 mol/L TBS洗涤后加1∶100 SABC 50 μl,37℃反应30 min;然后DAB显色,自来水冲洗,苏木精复染,中性树胶封片。以细胞核中有棕黄色颗粒者为凋亡的细胞。
1.4 Hoechst 33258染色检测小花棘豆中毒家兔生精细胞细胞核的形态学变化
总之,本文首先分析了初中英语阅读教学中存在的问题,然后从注重提高英语阅读材料的新颖性,组织学生灵活学习英语阅读以及科学合理地安排英语阅读时间几个方面,提出了初中英语阅读教学的提升策略,希望本文的研究能够有助于初中英语阅读教学水平的提升。当然,由于本人的研究水平有限,本文的论述难免存在一定的不足,还希望相关领域专家学者给与本人批评与指正。
去除单细胞悬液中的PBS,加入4%甲醛1 mL固定15 min,然后弃去固定液,PBS洗涤3次,每次3 min,加入0.5 mL Hoechst 33258染色液,染色2 min,弃去染色液,加入1 mL PBS后于荧光显微镜下观察。激发波长350 nm,参比波长460 nm。
1.5 小花棘豆中毒对家兔生精细胞细胞周期的影响
使用PBS冲洗单细胞悬液1~2次,加入质量浓度为0.125%的胰蛋白酶消化2 min,含血清培养液终止消化后弃去上清,PBS漂洗3次后收集细胞于离心管中。4℃、2000 r/min离心10 min后弃去上清,加入1 mL 75%乙醇4℃固定过夜。然后4℃、2000 r/min条件下离心10 min后弃去上清,PBS漂洗3次后再于4℃、2000 r/min条件下离心10 min,将细胞重悬于200 μl PBS液中,加入5 μl RnaseA,37℃反应1 h,再加入10 μl Triton-X-100和5 μl PI,4℃下避光孵育30 min,1 h内使用流式细胞仪检测。
1.6 小花棘豆中毒家兔生精细胞凋亡率的测定
使用PBS冲洗单细胞悬液1~2次,加入质量浓度为0.125%的胰蛋白酶消化2 min,含血清培养液终止消化后弃去上清,PBS漂洗3次后收集细胞于离心管中。4℃、2000 r/min离心10 min后弃去上清,加入1 mL PBS重悬细胞,使用250目尼龙滤网过滤,然后4℃、2000 r/min条件下离心10 min后弃去上清,将细胞重悬于200 μl Binding Buffer中,加入10 μl AnnexinV-FITC和5 μl PI,4℃下避光孵育30 min,1 h内上机检测。
1.7 数据分析
试验数据使用SPSS 16.0软件中One-Way ANOVA方法进行单因素方差分析。
2 结果与分析
2.1 小花棘豆中毒家兔睾丸生精细胞凋亡的检测
由图1可见,对照家兔睾丸生精细胞排列整齐,清晰明显,各时期生殖细胞如精原细胞、初级精母细胞、次级精母细胞和精子均清晰可辨;TUNEL染色显示仅有极少数的生精细胞的凋亡(图1-A)。试验Ⅰ组家兔睾丸组织出现曲精细管排列不规则,生精细胞轻度异型,部分细胞核浓染,精子减少;凋亡细胞多表现为细胞膜完整,胞质空泡(图1-B),其数量明显升高。试验Ⅱ组和试验Ⅲ组家兔睾丸组织均出现曲精细管排列极度紊乱,各级生精细胞明显减少,异型细胞和凋亡细胞数量增多,凋亡细胞出现细胞膜下陷,细胞器浓缩,细胞核碎裂等,并形成凋亡小体,部分凋亡小体被邻近细胞吞噬(图1-C、D)。
2.2 小花棘豆中毒家兔睾丸生精细胞细胞核的形态学检测
Hoechst 33258染色发现,对照家兔睾丸生精细胞细胞核呈现圆形及卵圆形,且染色质均匀分布(图2-A)。小花棘豆中毒家兔生精细胞细胞核缩小,呈新月形或染色质浓缩。试验Ⅰ组家兔出现核固缩为均质团块(图2-B),试验Ⅱ组和试验Ⅲ组家兔生精细胞胞体也明显缩小,细胞核多碎裂,并伴有凋亡小体出现(图2-C,2-D)。
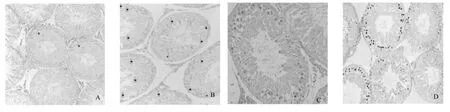
图1 对照家兔(A)与小花棘豆中毒家兔(B、C、D)生精细胞凋亡TUNEL染色Fig.1Spermatogenic cells apoptosis in control rabbit testis(A)and poisoning rabbit testis(B,C,D)by TUNEL

图2 对照家兔(A)与小花棘豆中毒家兔(B、C、D)生精细胞细胞核的形态学变化Fig.2The change of spermatogenic cells nucleus in control rabbit testis(A)and poisoning rabbit testis(B,C,D)
2.3 小花棘豆中毒对家兔睾丸生精细胞细胞周期的影响
由图3可知,小花棘豆中毒家兔睾丸生精细胞与对照家兔相比,G0/G1期细胞数量逐渐升高,S期细胞数量逐渐降低,而且G1期与S期细胞数量呈显著的负相关。其中高剂量小花棘豆中毒组家兔的变化最为明显。

图3 对照家兔(A)与小花棘豆中毒家兔(B、C、D)生精细胞细胞周期的检测Fig.3The cell cycle of spermatogenic cells nucleus in control rabbit testis(A)and poisoning rabbit testis(B,C,D)by FCM
2.4 小花棘豆中毒对家兔睾丸生精细胞凋亡率的影
家兔睾丸生精细胞主要分为单倍体细胞、二倍体细胞和四倍体细胞。与对照组相比,第14天时试验组家兔单倍体细胞凋亡率均显著高于对照家兔(P﹤0.05),但仅试验Ⅲ组家兔生精细胞凋亡率显著高于对照家兔(P﹤0.05)。第35 d时试验组单倍体细胞凋亡率和生精细胞凋亡率均极显著高于对照家兔(P﹤0.01),但二倍体细胞凋亡率均显著高于对照家兔(P﹤0.05)。第70 d时试验组单倍体细胞凋亡率、二倍体细胞凋亡率和生精细胞凋亡率均极显著高于对照家兔(P﹤0.01),但整个试验期内四倍体细胞凋亡率与对照差异不显著(P﹥0.05)。
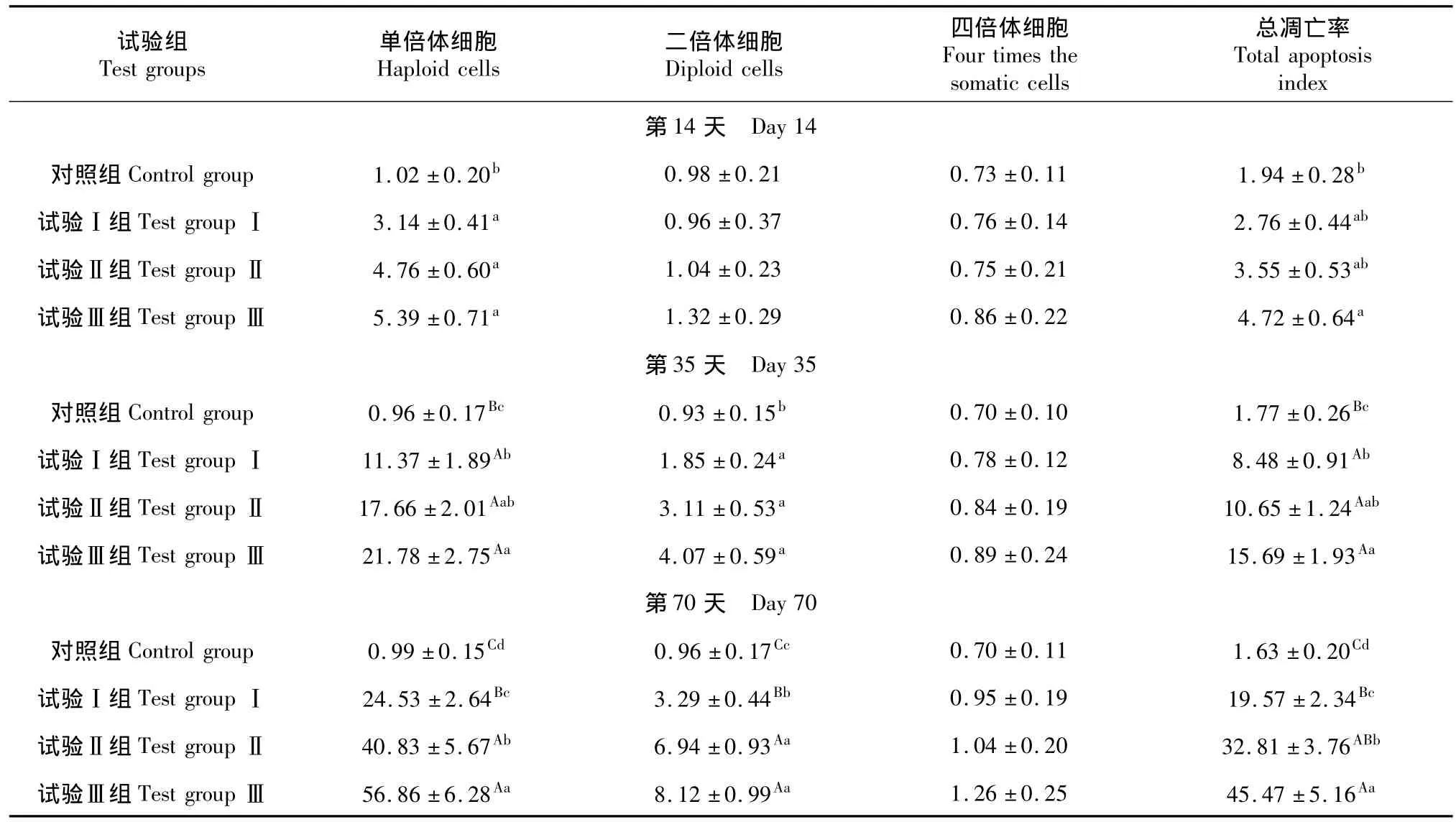
表1 小花棘豆中毒对家兔睾丸生精细胞凋亡率的影响(%)Table 1The effect of apoptosis index of O.glabra DC poisoning on spermatogenic cells

图4 对照家兔(A)与小花棘豆中毒家兔(B、C、D)生精细胞凋亡率的检测Fig.4The apoptosis index of spermatogenic cells in control rabbit testis(A)and poisoning rabbit testis(B,C,D)by FCM
3 讨论
细胞凋亡在细胞发育及疾病发生过程中均起着重要的作用。凋亡过程中,细胞不仅发生了生化变化,而且还具有凋亡的特征性形态和亚微结构。有核细胞凋亡的重要特征是DNA断裂,TUNEL法能特异性的标记断裂DNA,可有效检测细胞早期凋亡,是目前应用较广、可靠较高的标记凋亡细胞的方法。正常情况下,睾丸的精原细胞在促性腺激素和雄性激素作用下,依次经过精原细胞、初级精母细胞和次级精母细胞,最后转变成为高度分化的精子。张先平等[8]研究发现减数分裂前的精原细胞和精母细胞有较高的自发凋亡现象,但精子细胞很少发生凋亡,这是保证随后的精子正常生长所必需的。其意义在于维持成熟精子的质量和数量,清除染色体异常的生精细胞,保持生精细胞与支持细胞数量上的平衡。课题组前期研究发现,小花棘豆中毒主要影响动物的繁殖和神经系统,其中雄性中毒动物表现为性欲低下,无配种能力;雌性动物可造成流产、死胎、弱胎、畸形等。丁伯良等[9]研究发现甘肃棘豆(主要毒性物质SW)中毒山羊睾丸的精原细胞和初级精母细胞空泡化,次级精母细胞和精子细胞数量减少,附睾、精囊、输精管数量明显降低。本试验研究发现小花棘豆中毒家兔睾丸组织曲精细管排列紊乱,各级生精细胞和精子细胞数量明显减少,凋亡细胞数量增多,并可见凋亡小体形成及凋亡小体被吞噬细胞吞噬的现象。TUNEL染色发现小花棘豆中毒可显导致家兔生精细胞凋亡率极显著升高(P<0.01),Hoechst 33258染色发现凋亡细胞细胞核的染色质浓缩,核碎裂,并出现凋亡小体。其结果与丁伯良等的研究一致,表明小花棘豆毒性成分可诱导睾丸生精细胞凋亡。
睾丸细胞主要包括单倍体细胞(精子细胞和精子)、二倍体细胞(G0期精原细胞、次级精母细胞、支持细胞和间质细胞)以及四倍体细胞(粗线期、细线期、双线期的初级精母细胞和G2期的精原细胞等),另外还有一些较为分散的细胞由进行DNA合成的精原细胞和细线前期精母细胞组成。其中四倍体细胞与二倍体细胞的比率反映了精原细胞转化为初级精母细胞的效率,单倍体细胞与四倍体细胞的比率显示了减数分裂的效果,单倍体细胞与二倍体细胞的比率反映了精原细胞转化为精子细胞的效率。Jyothi等[10]研究表明睾丸生精细胞凋亡时精原细胞的凋亡比较严重,即多数生殖毒性物质的靶细胞是精原细胞。本试验通过流式细胞仪检测了家兔睾丸内各种生精细胞的比例,结果发现与对照组相比,小花棘豆中毒家兔睾丸单倍体细胞和二倍体细胞凋亡率均极显著升高,但四倍体细胞凋亡率无明显变化;说明小花棘豆中毒可显著影响家兔减数分裂及精原细胞转化为初级精母细胞的效率,即小花棘豆毒性成分主要影响精原细胞和次级精母细胞。
通过流式细胞仪检测小花棘豆中毒对家兔睾丸生精细胞细胞周期的影响,发现与对照组相比,中毒家兔睾丸生精细胞G0/G1期数量增多,S期细胞数量降低。表明小花棘豆毒性成分可能抑制了S期DNA的合成与修复过程,从而使S期细胞数量降低,并抑制了S期细胞进入G2/M期,另外还对细胞进入G1期有一定的促进作用。凋亡率检测发现处于分裂增殖阶段的精原细胞、精母细胞对小花棘豆的毒性作用较为敏感。其原因可能为精原细胞和精母细胞分别处于有丝分裂和减数分裂期,在S期需打开DNA双链以合成新的DNA,而裸露的DNA对小花棘豆毒性成分的作用较为敏感,容易产生DNA损伤[11]。当DNA损伤超过自身的修复能力时,将导致同源染色体配对、交换和分离的紊乱,从而引发细胞凋亡。但庞龙[4]研究发现SW主要抑制大鼠皮质神经细胞的G0/G1期数量,与本研究结果不太一致。表明小花棘豆中毒导致家兔睾丸生精细胞凋亡的机制还有待于进一步的研究。
4 结论
通过TUNEL染色、Hoechst 33258染色和流式细胞术检测,小花棘豆中毒可导致家兔睾丸生精细胞、单倍体细胞和二倍体细胞凋亡率极显著升高,且与小花棘豆毒性成分呈现一定的时间-剂量效应。凋亡细胞出现胞核缩小、碎裂,染色质浓缩等,高剂量中毒组出现凋亡小体。与对照组相比,中毒家兔睾丸生精细胞G0/G1期数量增多,S期细胞数量降低,表明小花棘豆中毒可能抑制了S期DNA的合成与修复过程。
[1]王帅,贾琦珍,陈根元,等.不同生长时期小花棘豆营养成分与苦马豆素含量比较[J].新疆农业科学,2015,52(8):1505-1509.
[2]贾琦珍,陈根元,廖秋萍,等.小花棘豆中毒对家兔脏器指标的影响[J].湖北农业科学,2014,53(12):2584-2586.
[3]王帅,吴书奇,胡建军,等.南疆地区小花棘豆中苦马豆素的分离与鉴定[J].草业科学,2011,28(6):1194-1197.
[4]王帅,陈根元,贾琦珍,等.小花棘豆中毒对家兔睾丸α-甘露糖苷酶的影响[J].中国兽医学报,2015,35(4):640-644.
[5]庞龙.苦马豆素体外诱导SD大鼠神经细胞凋亡研究[D].陕西杨凌:西北农林科技大学,2012.
[6]张樑.苦马豆素诱导新生SD大鼠大脑皮质神经细胞凋亡机制研究[D].陕西杨凌:西北农林科技大学,2013.
[7]王帅,陈根元,胡建军,等.气相色谱内标法测定南疆地区小花棘豆中苦马豆素的含量[J].新疆农业科学,2011,48(4):723-728.
[8]张先平,才秀莲,王乾兴,等.锰对大鼠生精细胞凋亡与增殖的影响[J].毒理学杂志,2007,21(3):176-179.
[9]丁伯良,王建辰,薛登民,等.山羊甘肃棘豆中毒睾丸、附睾的病理学研究[J].畜牧兽医学报,1994,25(4):368-374.
[10]Jyothi P,Jagetia G,Krishnamurthy H,et al.Evaluation of teniposide (VM-26)-induced toxicity on mouse spermatogenesis by flow cytometry[J].Toxicology,2001,163(2-3):163-174.
[11]Zhaocai Li,Yong Huang,Feng Dong,et al.Swainsonine promotes apoptosis in human oesophageal squamous cell carcinoma cells in vitro and in vivo through activation of mitochondrial pathway[J].Journal of Biosciences,2012,37(1):1005-1016.
(责任编辑 李洁)
Effect of Oxytropis glabra DC Poisoning on Spermatogenic Cells Apoptosis in Rabbit
WANG Shuai1,2,JIA Qi-zhen2,CHEN Gen-yuan2,WANG Lian-qun1,2,ZHANG Ling1,2*
(1.College of Animal Science,Tarim University,Xinjiang Alar 843300,China;2.Key Laboratory of Tarim Animal Husbandry Science and Technology,Xinjiang Production&Construction Corps,Xinjiang Alar 843300,China)
The aim of this study was to investigate the effects of Oxytropis glabra DC poisoning on spermatogenic cells apoptosis in rabbit testis,and reveal the toxicity mechanism of O.glabra DC in future.24 male rabbits were randomly and equally divided into blank control group and experimental groupⅠ,Ⅱ,Ⅲ,the dried plant of O.glabra DC was comminnuted,then different amounts of the grass powder(15%,30 %and 45%the corresponding swainsonine content was 30,60,90 mg/kg)were mixed with the forage in 3 experimental groups.The rabbits consumed the forages freely until typical symptoms were observed,the test period was 70 days.2 rabbits were selected randomly from each group on the 14th,35thand 70thday,respectively,the testis were collected and apoptosis of cardiomyocyte were measured by insitu end-labeled DNA(TUNEL),nuclear staining techniques by Hoechst 33258,flow cytometry determination of apoptosis rate and cell cycle.The results indicated that the apoptosis index of spermatogenic cell increased in experimental groups were very significantly higher than control group(P﹤0.01),with increasing concentration of swainsonine,the spermatogenic cell membrane caveolated,cell organelles narrow and cell nucleus broken,and in severe apoptotic bodies.The apoptosis index of haploid cells and diploid cells in test rabbit testis were very significantly higher than control group(P﹤0.01)from 35 d,but the contents of four times the somatic cells in test rabbit testis had no significant difference with control group.The G0/G1of the cell increased and S phase cells gradually decreased,there were significantly negative correlation with G1phase cells and S phase cells.The results showed that O.glabra DC has remarkable effects on spermatogenic cells apoptosis in rabbit testis,in a time-effect as a dose-effect relationship.
Oxytropis glabra DC;Swainsonine;Spermatogenic cell;Apoptosis;Cell cycle
S816.1
A
1001-4829(2017)1-0209-06
10.16213/j.cnki.scjas.2017.1.036
2016-02-25
国家自然科学基金(31460678);国家星火计划项目(2015GA891015);兵团塔里木畜牧科技重点实验室开放课题(HS201409)
王帅(1984-),男,高级实验师,硕士,山西长治人,主要从事动物中毒病及毒理学方面的研究,E-mail:wangshuaidky@126.com;*为通讯作者:张玲(1966-),女,高级实验师,本科,河北河间人,主要从事牧草生产与牧草加工方面的研究,E-mail:1044763025@qq.com。

