不同程度低温胁迫对凡纳滨对虾主要消化酶活性的影响
[KH-3D]何苹萍,韦嫔媛,赵永贞,李强勇,陈晓汉,彭金霞
(广西水产科学研究院,广西水产遗传育种与健康养殖重点实验室,广西南宁530021)
不同程度低温胁迫对凡纳滨对虾主要消化酶活性的影响
[KH-*3D]何苹萍,韦嫔媛,赵永贞,李强勇,陈晓汉,彭金霞*
(广西水产科学研究院,广西水产遗传育种与健康养殖重点实验室,广西南宁530021)
研究不同程度低温胁迫条件下凡纳滨对虾(Penaeus vannamei)主要消化酶活性的变化规律,以期为低温消化生理学及低温条件下投喂饵料成分配比的调整提供参考。试验设计20、16℃两个温度组,每组设计5个取样时间点,每组以28℃(常温)为对照组。对各组取样实验虾的肝胰腺及胃肠进行胃蛋白酶、胰蛋白酶、淀粉酶3种消化酶活性的测定。结果表明,3种消化酶在不同温度下的活性顺序均为28℃>20℃>16℃;3种消化酶活性顺序为胰蛋白酶>淀粉酶>胃蛋白酶。淀粉酶及胃蛋白酶的活性顺序为肝胰腺>胃肠,胰蛋白酶活性顺序为胃肠>肝胰腺。3种消化酶的活性均为低温处理24 h开始出现不同程度的降低,144 h活性达到最低值,回复常温24 h后活性有所回升。3种消化酶受低温影响程度为胃蛋白酶>淀粉酶>胰蛋白酶。20℃下消化酶活性与常温相比降幅最小的为淀粉酶,16℃下消化酶活性与常温相比降幅最小的为胰蛋白酶。生产中在不同温度情况下应根据消化酶的活性来决定饵料成分的配比及投饵量,应随着温度的持续降低不断减少总投饵量,降温初期(常温降至20℃)应以提高饵料的淀粉含量配比方式进行投喂;降温后期(20℃降至16℃)应以提高蛋白含量配比方式进行投喂。
凡纳滨对虾;温度;胃蛋白酶;胰蛋白酶;淀粉酶
凡纳滨对虾(Penaeus vannamei),俗称南美白对虾,占我国养殖对虾总产量80%以上。广西北部湾是我国凡纳滨对虾主产区之一,但凡纳滨对虾是暖水性品种,其存活、摄食及生长的适宜水温为18~35℃,水温18℃以下时,存活率降低,因此养殖效益受极端天气、季节和地域的限制。研究表明,水产动物在低温胁迫时,通过微效多基因表达调控,调整自身能量代谢水平和消化吸收能力等,从而适应低温环境甚至实现正生长,消化酶的活性水平正是反映对虾消化吸收能力的重要指标。目前对凡纳滨对虾成虾消化酶的研究报道较少,常见的为凡纳滨对虾及中国对虾幼体和仔虾消化酶的研究[1-3]。黄燕华[4]及沈文英[5]均使用酶学的方法进行凡纳滨对虾成虾几种主要消化酶体外最适反应温度的研究,但酶学研究存在一定的局限性及误差,生理生态学研究方法更具生产实践方面的指导意义。目前运用生理生态学方法对消化酶活性进行研究的有:温度对中华原钩虾消化酶活性的影响[6]、饥饿对克氏原螯虾消化酶活性的影响[7]、盐度对凡纳滨对虾幼虾消化酶活性的影响[1]等。本研究为国内首次采用生理生态学方法研究不同程度低温胁迫条件下凡纳滨对虾主要消化酶活性的变化规律,以期为凡纳滨对虾低温消化生理研究及低温条件下投喂饵料成分配比的调整提供参考。
1 材料与方法
1.1 实验用虾
实验所用虾为广西水产科学研究院南美白对虾遗传育种中心选育的耐寒家系虾。
1.2 低温实验
实验设计3个温度组,分别为28℃(常温组)、20℃(低温组)、16℃(低温组),每个低温组又设降温24、72、144 h和恢复常温24 h共5个实验组。每组实验用虾10只,取各组别实验虾的肝胰腺及胃肠组织冻存。
1.3 样品制备
1.3.1 肝胰腺将冻存的肝胰腺取出,称重,加5倍体积的4℃预冷生理盐水,在冰浴中用玻璃匀浆器匀浆2 min,匀浆液在4℃下2500 r/min离心10 min,取上清液备用。
1.3.2 胃肠将冻存的胃肠组织取出,称重,加10倍体积的4℃预冷生理盐水,在4℃冰浴的研钵里研磨,匀浆液在4℃下2500 r/min离心10 min,取上清液备用。
1.4 酶活性测定
采用南京建成生物工程研究所的试剂盒分定胃肠及肝胰腺的胃蛋白酶、胰蛋白酶、淀粉酶、蛋白总量。胃蛋白酶活性定义:每毫克组织蛋白在37℃每分钟分解蛋白生成1微克氨基酸相当于1个酶活力单位。胰蛋白酶活性定义:在pH 8.0,37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活力单位。淀粉酶活性定义:组织中每毫克蛋白在37℃与底物作用30 min,水解10 mg淀粉为1个淀粉酶活力单位。
随着研究的深入,网络舆情研究逐步扩展到思想政治教育、高校管理、政治发展、伦理文化及群体性事件的预防等方面。其成果有四个方面:
1.5 数据分析
试验数据以平均值±标准误差表示。在进行数据分析时,先将各组数据进行单因素方差分析,若结果差异显著,再采用Duncan,s多重比较检验组间差异。所有统计分析均使用SPSS 16.0软件处理,以P≤0.05作为差异显著性标准。
2 结果分析
2.1 温度对凡纳滨对虾胃蛋白酶活性的影响
不同低温处理时间下凡纳滨对虾胃蛋白酶活性呈现出一定的变化规律。随着低温处理时间的延长,凡纳滨对虾肝胰腺及胃肠组织胃蛋白酶均呈现逐渐下降的趋势。16℃低温处理144 h组肝胰腺组织胃蛋白酶[(1.35±0.19)U](图1),比常温组[(4.14±0.83)U]下降67.39%。同时,16℃低温处理144 h组胃肠组织胃蛋白酶[(1.03±0.25)U],比常温[(2.72±0.44)U]下降了62.13 %;20℃低温处理144 h组肝胰腺组织胃蛋白酶[(2.31±0.62)U](图2),比常温组[(4.24±0.84)U]下降了45.52%。同时,20℃低温处理144h组胃肠组织胃蛋白酶[(1.26±0.07)U],比常温组[(2.6±0.3)U]下降了51.54%。多重比较检验表明,肝胰腺胃蛋白酶活性及胃肠(16℃组)在处理24、72、144 h及回温组与常温组均存在显著差异(P<0.05),而胃肠组织(20℃组)胃蛋白酶活性在低温处理72、144 h及回温组与常温组存在显著差异(P<0.05)。多重比较检验表明,两组低温组的两种组织与常温组胃蛋白酶活性存在显著差异(P<0.05);16℃组与20℃组肝胰腺组织胃蛋白酶活性存在显著差异(P<0.05),而胃肠组织则差异不显著(P>0.05)。
2.2 温度对凡纳滨对虾胰蛋白酶活性的影响
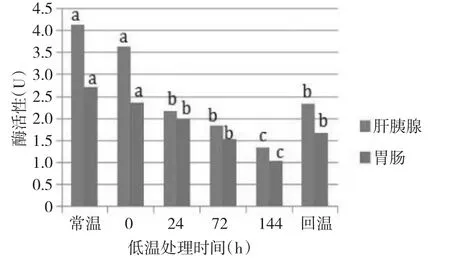
图1 16℃不同低温处理时间下胃蛋白酶活性的变化Fig.1The change of activities of pepsase at different time under 16℃
不同低温处理时间下凡纳滨对虾胰蛋白酶活性呈现出一定的变化规律。随着低温处理时间的延长,凡纳滨对虾肝胰腺及胃肠组织胰蛋白酶均呈现逐渐下降的趋势,16℃低温处理144 h组肝胰腺组织胰蛋白酶[(3605.31±298.38)U]最低(图3),比常温组[(5954.42±768.57)U]下降了39.45 %;同时,16℃低温处理144 h组胃肠组织胰蛋白酶[(5517.07±617.46)U]最低,比常温组[(7857.72±467.69)U]下降了29.88%;20℃低温处理144 h组肝胰腺组织胰蛋白酶[(3663.04±298.38)U](图4),比常温组[(5954.42±768.57)U]下降了38.48%;同时,20℃低温处理144 h组胃肠组织胰蛋白酶[(5660.43±946.33)U]比常温组[(7634.47±695.08)U]下降了25.86%。多重比较检验表明,肝胰腺胰蛋白酶活性在低温处理24、72、144 h及回温组与常温组均存在显著差异(P<0.05),而胃肠组织胰蛋白酶活性在低温处理72、144 h及回温组与常温组存在显著差异(P<0.05)。多重比较检验表明,2组低温组的2种组织与常温组胰蛋白酶活性均存在显著差异(P<0.05);而16℃组与20℃组胰蛋白酶活性则差异不显著(P>0.05)。

表1 不同温度下胃蛋白酶活性均值比较Table 1The activities of pepsase under different temperature

表2 不同温度下胰蛋白酶活性均值比较Table 2The activities of trypsase under different temperature
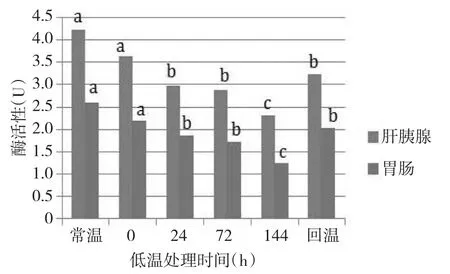
图2 20℃不同低温处理时间下胃蛋白酶活性的变化Fig.2The change of activities of pepsase at different time under 20℃

图3 16℃不同低温处理时间下胰蛋白酶活性的变化ig.3The change of activities of trypsase at different time under 16℃

图4 20℃不同低温处理时间下胰蛋白酶活性的变化ig.4The change of activities of trypsase at different time under 20℃
2.3 温度对凡纳滨对虾淀粉酶活性的影响
不同低温处理时间下凡纳滨对虾淀粉酶活性呈现出一定的变化规律。随着低温处理时间的延长,凡纳滨对虾肝胰腺及胃肠组织淀粉酶均呈现逐渐下降的趋势,16℃低温处理144 h组肝胰腺组织淀粉酶[(6.083±1.09)U](图5),比常温组[(10.22 ±1.21)U]下降了40.48%。同时,16℃低温处理144 h组胃肠组织淀粉酶[(4.38±0.61)U],比常温[(6.25±0.44)U]下降了29.92%;20℃低温处理144 h组肝胰腺组织淀粉酶[(8.2±0.93)U](图6),比常温组[(10.67±1.15)U]下降了23.15%。同时,20℃低温处理144 h组胃肠组织淀粉酶[(5.24±0.46)U]比常温组[(6.16±0.36) U]下降了14.94%。多重比较检验表明,肝胰腺淀粉酶活性(16℃组)在处理24、72、144 h及回温组与常温组均存在显著差异(P<0.05),肝胰腺淀粉酶活性(20℃组)在处理72 h、144 h及回温组与常温组存在显著差异(P<0.05),而胃肠组织淀粉酶活性仅仅在低温处理144 h及回温组与常温组存在显著差异(P<0.05)。多重比较检验表明,2组低温组的肝胰腺淀粉酶活性均与常温组存在显著差异(P<0.05),2组低温组淀粉酶活性之间也存在显著差异(P<0.05)。16℃组的胃肠组织淀粉酶活性与常温组存在显著差异(P<0.05);而20℃组胃肠组织淀粉酶活性与常温组差异不显著(P>0.05)。
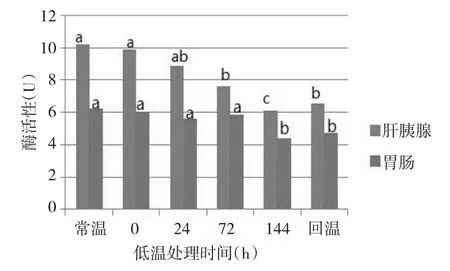
图5 16℃不同低温处理时间下淀粉酶活性的变化Fig.5The change of activities of amylase at different time under 16℃

表3 不同温度下淀粉酶活性均值比较Table 3The activities of amylase under different temperature

图6 20℃不同低温处理时间下淀粉酶活性的变化Fig.6The change of activities of amylase at different time under 20℃
2.4 不同组织器官消化酶活性比较
淀粉酶活性顺序为:肝胰腺>胃肠,胰蛋白酶活性顺序为:胃肠>肝胰腺,胃蛋白酶活性顺序为:肝胰腺>胃肠。3种消化酶活性顺序为:胰蛋白酶>淀粉酶>胃蛋白酶。2种组织的A/P1均小于1,两种组织的A/P2均大于1。
2.5 不同消化酶活性受低温影响程度
3种消化酶受低温影响程度为:胃蛋白酶>淀粉酶>胰蛋白酶。消化酶活性受低温影响程度通过2个指标判断:一是低温处理144 h消化酶比常温下降的幅度及回复常温后消化酶升高的幅度。胰蛋白酶在3种消化酶之中是降低幅度最小,回升幅度最大的一种酶。
2.6 不同组织器官受低温影响程度
2种组织受低温影响程度为:肝胰腺>胃肠。3种消化酶在低温处理144 h后均为肝胰腺组织下降的幅度高于胃肠,回复常温后均为肝胰腺组织消化酶升高的幅度低于胃肠。表明肝胰腺比胃肠更容易遭受低温下的组织及功能损伤。
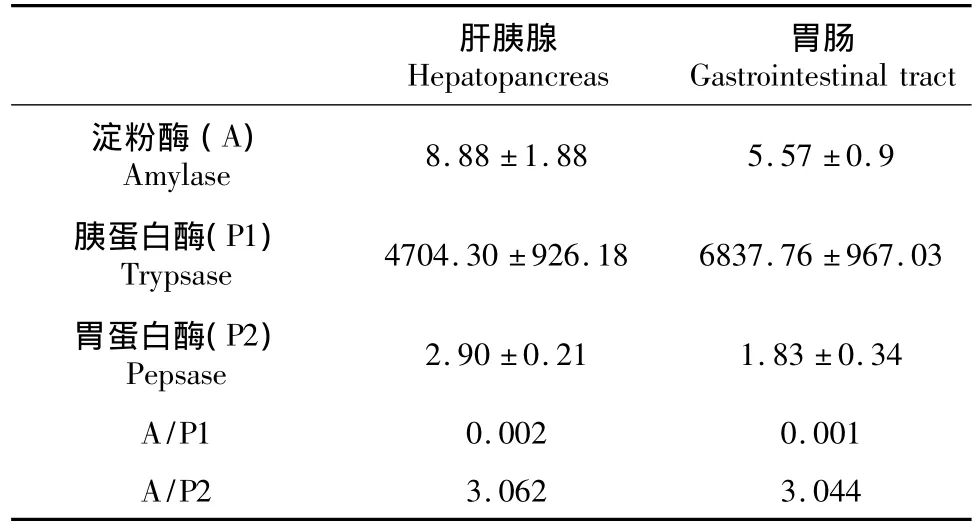
表4 不同器官主要消化酶活性及A/P值分析Table 4The activities of three digestive enzymes and the ratio of A/P in different organs
3 讨论
本研究3种消化酶中胰蛋白酶的活性最高,且受低温影响的程度最低;2种组织中胃肠组织受低温影响程度最低,且不同温度下胃肠组织的胰蛋白酶活性均显著高于肝胰腺,表明无论是常温还是低温下凡纳滨对虾对饲料的消化吸收均主要依靠胃肠组织分泌的胰蛋白酶。这与刘玉梅[2]、潘鲁青[3]、黄燕华[4]、李广丽[8]等报道的在各自最适pH条件下,不同部位蛋白酶活力为肝胰脏显著大于胃和肠的,蛋白酶主要分布于肝胰脏,肝胰脏蛋白酶分泌进入胃肠道后活力迅速下降的研究结论不相符,可能是研究方法的差异、种间差异或实验对虾生长阶段的差异导致的。而Das[9]等研究发现,肝胰脏主要分泌蛋白酶原,其蛋白酶活力微弱或几乎没有,肠道分泌肠激酶,能激活蛋白酶原,共同促进肠道对食物蛋白质的消化吸收,与本研究结论一致;沈文英[5]等研究发现蛋白酶比活力在消化酶中最大,说明凡纳滨对虾具有较高的蛋白质消化能力,建议配制凡纳滨对虾饲料时可适当提高蛋白质含量,与本研究结论一致。另外梅景良等[10]对黑鲷(Sparus macrocephalus)体内蛋白酶活力的研究结果与相类似道。
本研究中3种消化酶在不同温度下的活性顺序均为:28℃>20℃>16℃。胰蛋白酶活性的常温组与低温组差异显著,但2组低温组之间差异不显著;淀粉酶活性的常温组与低温组(20℃)差异不显著,与低温组(16℃)差异显著。表明从常温(28℃)降温至20℃的过程中淀粉酶活性的降幅最小,从20℃降温至16℃的过程中胰蛋白酶活性的降幅最小,换言之,在降温初始蛋白酶活性下降较快,对虾降低能量消耗及对蛋白的消化吸收,增强适应性。而淀粉酶没有显著下降,表明对虾主要靠对淀粉的消化吸收维持自身正常存活。此结论与芦光宇等[7]的研究结论一致。本研究3种消化酶随着低温处理时间变化的规律大致一致,均为低温处理0 h消化酶活性无显著变化,低温处理24 h开始呈现消化酶活性显著降低,低温处理144 h消化酶活性达到最低值,回温24 h后消化酶活性有所回升。区别在于淀粉酶活性在低温处理24 h与常温组及低温0 h组并无显著差异,直到低温处理72 h活性才显著降低,表明淀粉酶在凡纳滨对虾遭遇低温的初始变化不明显。李志华等[11]发现日本沼虾(Macrobrachium nipponense)分别饥饿2、4、8 d,胃蛋白酶和脂肪酶活性变化也均随着饥饿时间的延长而降低,这与本研究结果相似。王辉报道奥尼罗非鱼(Oreochromis niloticus×O.aureus)的幼鱼在饥饿状态下,体内胃蛋白酶、胰蛋白酶和脂肪酶的活性显著下降,但淀粉酶活性变化趋势不明显,与本研究结论相符[12]。这与在低温初始24 h时淀粉酶活性呈现升高的文献报道有所出入[13],可能是研究方法的不同及物种差异导致的。吴垠报道由于饲料中蛋白质水平的差异而造成日本对虾与中国对虾在消化酶活性方面的差异现象十分明显,表明可能是由于不同种类虾在长期的环境适应中,通过自身调节机制来调节酶的合成与分泌及其与其它酶的对应关系而形成的[14]。Kawai等用鱼粉和马铃薯淀粉含量不同的饲料饲养幼鲤75 d,发现在一个星期内,肠道麦芽糖酶、淀粉酶和蛋白酶活性对饲料呈现出适应性的变化规律[15]。因此不同温度情况下应根据消化酶的活性来决定饵料成分的配比及投饵量,生产中遭遇低温寒潮应随着温度的持续降低不断减少总投饵量,在降温初期(常温降至20℃)应以降低饲料中蛋白含量配比,提高淀粉含量配比的方式进行投喂;降温后期(20℃降至16℃)应以降低饵料的淀粉含量配比,提高蛋白含量配比的方式进行投喂。
甲壳动物消化酶活力在营养生理方面有重要作用,直接影响甲壳动物的生长、蜕皮和摄食[15]。目前,引起水生动物消化酶活力下降的原因主要有3个方面:①低温胁迫时,水生动物通过微效多基因表达调控,降低自身能量代谢水平和消化吸收能力,即降低消化酶的分泌,进而自主减少进食;②水生动物因为整个消化道受到食物蠕动的机械刺激减少,因而消化酶分泌量进一步明显下降[16];③由饥饿引起的肝胰脏萎缩、胃壁变薄、肠管收缩等消化器官的实质性变化,必将导致这些器官的消化酶分泌量进一步降低伤[17]。本研究中,低温处理7 d回复常温1 d以后消化酶活性较低温处理7 d时有所回升,表明低温处理7 d暂时没有对虾的肝胰腺、胃肠组织造成不可逆的损。
Biesiot等[18]提出采用淀粉酶/胃蛋白酶(A/ P1)比值和淀粉酶/胰蛋白酶(A/P2)比值作为食性和营养状况的指标来指导投饵,比值高为植物食性或偏植物食性,比值低为动物食性或偏动物食性,本试验测定凡纳滨对虾的A/P1小于1,A/P2比值大于1,但A/P1远小于1,而A/P2只是稍大于1,表明凡纳滨对虾的食性为动物食性或偏动物食性。因此在凡纳滨对虾的养殖过程中,投饵种类应以动物性饵料或蛋白含量高,而脂肪和淀粉含量低的配合性饲料。
[1]黄凯,杨鸿昆,战歌,等.盐度对凡纳滨对虾幼虾消化酶活性的影响[J].海洋科学,2007,31(3):37-40.
[2]刘玉梅,朱谨钊,吴厚余,等.中国对虾幼体和仔虾消化酶活力及氨基酸组成的研究[J].海洋与湖沼,1991,22(6):572-575.
[3]潘鲁青,王克行.中国对虾幼体消化酶活力的实验研究[J].水产学报,1997,21(1)1:26-31.
[4]黄燕华,王国霞,刘襄河,等.温度和pH对南美白对虾主要消化酶活性的影响[J].华南农业大学学报,2008,29(4):87-94.
[5]沈文英,胡洪国,潘雅娟.温度和pH值对南美白对虾(Penaeus vannmei)消化酶活性的影响[J].海洋与湖沼,2004,35(6):543-547.
[6]薛素燕,毛玉泽,赵法箴,等.温度对中华原钩虾(Eogammarus possjeticus)摄食率和消化酶活力的影响[J].渔业科学进展,2015,36(4):94-97.
[7]芦光宇,刘国兴,陈肖玮,等.饥饿对克氏原螯虾消化酶和抗氧化酶活性的影响[J].扬州大学学报(农业与生命科学版),2012,33 (4):34-37.
[8]李广丽,李思发,长江,等.长江、瓯江、辽河中华绒螯蟹消化酶的初步研究[J].上海水产大学学报,1996,5(2):134-137.
[9]DAS K M,TRIPATHI S D.Studies on the digestive enzymes of grass carp,Ctenopharyngodon idella(Val)[J].Aquac,1991,92:21-32.
[10]梅景良,马燕梅,王宏,等.pH值对黑鲷胃肠道及肝胰脏主要消化酶活力的影响[J].云南农业大学学报,2004,19(5):592-596.
[11]李志华,谢松,王军霞,等.间歇性饥饿对日本沼虾生长和几种消化酶的影响[J].水产学报,2007,31(4):456-462.
[12]王辉,强俊,李瑞伟,等.短期饥饿对奥尼罗非鱼幼鱼生长和几种消化酶的影响[J].广东海洋大学学报,2010,30(1):7-12.
[13]孟庆武,张秀梅,张沛东,等.饥饿对凡纳滨对虾仔虾摄食行为和消化酶活力的影响[J].海洋水产研究,2006,27(5):44-49.
[14]吴垠,孙建明,周遵春.温度对中国对虾、日本对虾主要消化酶活性的影响[J].大连水产学院学报,1997,12(2):16-21.
[15]Kawai S.Studies on digestive enzymes of fish.Ⅱ.Effect of dietary change on the activities of digestive en zymes in carp intestine.Bul l Jap Soc Sci Fish,1972,38(3):265-270.
[16]钱云霞.饥饿对养殖鲈蛋白酶活力的影响[J].水产科学,2002,21(3):6-7.
[17]李霞,姜志强,谭晓珍,等.饥饿和再投喂对美国红鱼消化器官组织学的影响[J].中国水产科学,2002,9(3):211-214.
[18]Biesiot P M,Capuzzo J M.Changes in digestive enzyme activities during early development of the American lobster Homarus americanus[J].Journal of Experimental Marine Biology and Ecology,1990,136(2):107-122.
(责任编辑 温国泉)
Effects of Different Low Temperature Stress on Activities of Digestive Enzymes in Penaeus vannamei
HE Ping-ping1,WEI Pin-yuan,ZHAO Yong-zhen,LI Qiang-yong,CHEN Xiao-han,PENG Jin-xia*
(Guangxi Academy of Fisheries Science,Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture,Guangxi Nanning 530021,China)
The change rule of activities of digestive enzyme in Penaeus vannamei under different low temperature stress was researched to provide reference for cold digestion physiology and the change of proportioning of bait under low temperature.The experiments were conducted at 2 different low temperature,20℃and 16℃,each group was designed for five sampling time point,and 28℃was control for each group.The pepsase,trypsase and amylase in the hepatopancrea and gastrointestinal tract of each group of experimental prawn were test.The results showed that the activity order of digestive enzymes under different temperature was 28℃>20℃>16℃.The activity order of digestive enzymes was trypsase>amylase>pepsase.The activity order of pepsase and amylase was hepatopancreas>gastrointestinal tract,the activity order of trypsase was gastrointestinal tract>hepatopancreas.The activities of three digestive enzymes began to reduced significantly at low temperature for 24 hours(P<0.05),reduced to minimum until 144 h,and rose affer restore normal temperature 24 h.The degree of digestive enzymes affected by low temperature were pepsase>amylase>trypsase.The activities of amylase decrease least from nomal among the digestive enzyme under 20℃,and trypsase under 16℃.In a word,the proportioning of bait and feeding quantity should depends on the activity of digestive enzymes under different temperature.Indicate that the feeding quantity should be reduced along with the continuous falling of temperature,the proportioning of amylum should be raised during the initial stage of cooling and the proportioning of protein should be raised during the later stage of cooling.
Penaeus vannamei;Temperature;Pepsase trypsase;Amylase
S985.2+1
A
1001-4829(2017)1-0233-05
10.16213/j.cnki.scjas.2017.1.040
2016-09-09
国家自然科学基金项目(31460690);八桂学者建设专项资金(BGXZ-NMBDX-05);现代农业产业技术体系建设专项(CARS-47);广西壮族自治区直属公益性科研院所基本科研业务专项(GXIF-2014-002)
何苹萍(1984-),女,硕士,广西柳州人,助理研究员,主要从事水产遗传育种与分子辅助选育研究,*为通讯作者,E-mail:269679250@qq.com。

