金钱鱼雌激素受体erα、erβ1和erβ2克隆及表达分析
李 红, 张金鹏, 廉 颖, 张俊彬
(上海海洋大学 水产与生命学院,上海 201306)
金钱鱼雌激素受体erα、erβ1和erβ2克隆及表达分析
李 红, 张金鹏, 廉 颖, 张俊彬
(上海海洋大学 水产与生命学院,上海 201306)
克隆到金钱鱼(Scatophagusargus)3种雌激素受体(erα,erβ1和erβ2)cDNA全长。其中,erα全长2621 bp,编码635个氨基酸;erβ1全长2891 bp,编码560个氨基酸;erβ2全长2410 bp,编码657个氨基酸。同源性分析表明,金钱鱼ERα,ERβ1和ERβ2与欧洲鲈(Dicentrarchuslabrax),黑棘鲷(Acanthopagrusschlegelii),大口黑鲈(Micropterussalmoides)同源性最高,分别为91.7%、89.9%和88.4%。半定量结果显示,erα和erβ1主要在垂体、脑、性腺中表达,erβ2主要在肝脏、垂体、精巢中表达,其他组织表达量很低。就脑、垂体、性腺等组织而言,erα表达量高于erβ1和erβ2,肝脏中erβ2要高于erα。实时荧光定量结果表明,精巢中,erα在精子成熟时期显著升高,erβ1和erβ2则在精巢发育早期表达最高。卵巢中,金钱鱼雌激素受体主要在卵原细胞增长期和卵黄充满期表达。上述结果表明金钱鱼雌激素受体可能在精巢和卵巢发育中具有重要作用。
金钱鱼;雌激素受体;序列分析;基因表达
雌激素是由性腺产生的,与雌激素受体(estrogen receptor)特异性结合,调节生殖机能相关基因的表达,进而影响动物卵子发生,卵黄形成,精巢发育,脑组织内分泌等生理活动[1-3]。自1986年,在人乳腺癌细胞系中Green克隆到第一种雌激素受体erα之后,哺乳动物中共发现了两种雌激素受体,erα和erβ。而从1989年,Pakdel在虹鳟中克隆得到鱼类第一个雌激素受体erα后,研究发现鱼类雌激素受体存在多种亚型,虹鳟[4]和倒刺耙[5]中存在4种(erα1/erα2和erβ1/erβ2),斑马鱼[6]和大黄鱼[7]存在3种(erα和erβ1/erβ2)。
Couse等[8]指出,敲除erα对小鼠卵巢分化无明显影响,但是不能排卵,敲除erβ后,排卵次数和数目减少。Eddy等[9]指出,敲除雄性成年小鼠erα,小鼠出现睾丸萎缩,精子数量减少,生殖力下降等现象。方永强等[10]利用免疫组化技术,证实了鲻鱼精巢和卵巢中均有ERα和ERβ蛋白的表达;Chen等[7]通过原位杂交技术发现,大黄鱼erα和erβ1存在于卵母细胞、滤泡细胞以及精子发生各阶段细胞中,而erβ2仅在早期卵母细胞中有信号,滤泡细胞和精子发生中不表达,Chen推测erα和erβ1可能参与卵巢发育和排卵等过程,且不同的受体可能在性腺发育过程中作用各不相同。对鱼类雌激素受体的研究,将有助于了解鱼类性腺发育机制,丰富动物繁殖生理学,提高人工繁殖效率。
金钱鱼(Scatophagusargus),隶属鲈形目(Perciformes),金钱鱼科(Scatophagidae),具有观赏价值,并且近年来也成为我国南方海水养殖的新对象。迄今为止,国内外对金钱鱼生殖发育方面的研究还比较少,与金钱鱼中性腺发育直接相关的雌激素以及雌激素受体研究还不完善,且人工养殖中金钱鱼还存在着雌雄性成熟不同步,卵泡发育不完全等问题,因此研究金钱鱼雌激素受体作用机制,探究其表达模式,既能丰富金钱鱼基因信息,同时也有助于为人工繁殖提供理论基础,指导生产实践活动。
1 材料与方法
1.1 实验材料
实验所用金钱鱼均采自广东珠海养殖基地。甲烷磺酸盐(MS-222,100 mg/L)将鱼麻醉,采集金钱鱼心、肝、脾、肾、腮、肠、脑、垂体、卵巢和精巢等组织,液氮速冻,-80℃冰箱中保存备用。取不同时期性腺,波恩试剂固定,依据崔丹等[11]实验方法进行石蜡切片和HE染色。
1.2 总RNA提取和cDNA第一链的合成
液氮中将组织磨粉,按照Trizol(Invitrogen)法提取组织总RNA,1%甲醛变性凝胶电泳检测RNA质量,同时微量分光光度计NanoDrop 2000(Thermo Fisher Scientific)测定总RNA的浓度及纯度,D260 nm/D280 nm比值在1.9~2.0之间。DNase I(TaKaRa)处理总RNA样品。以Oligod(T)16 Primer引物,按照PrimeScript 1st Strand cDNA Synthesis Kit(TaKaRa)操作说明书进行反转。
1.3 金钱鱼erα、erβ1和erβ2全长cDNA序列克隆
根据金钱鱼转录组文库,查找erα、erβ1和erβ2序列,设计引物(表1),以卵巢cDNA为模板,扩增雌激素受体中间片段,反应体系25 μL:10× PCR Buffer 2.5 μL,MgCl22.5 μL,dNTPs 1 μL,上下游引物(10 μmol/L)各0.5 μL,模板cDNA 1 μL,ddH2O 16.7 μL,Taq酶(thermo)0.3 μL。反应程序:94℃预变性2 min;94℃变性30 s,60℃退火30 s,72℃延伸50 s,30个循环;72℃再延伸10 min,4℃保存。1%琼脂糖凝胶电泳检测PCR产物并回收,pMD-18T载体连接,转化至感受态细胞DH5α(天根),挑选阳性克隆送由上海迈浦生物公司测序。
根据中间片段设计3′RACE和5′RACE引物。3′RNA反转以oligo(dT)-AP为引物,反转产物稀释10倍作为RACE模板,以AP和3′RACE特异引物(表1)按照扩增中间片段反应体系做PCR反应,退火温度为60℃。5′RACE模板按照SMART (Clontech)说明书,以SMART II A oligo 和5′-CDS为引物反转合成,以UPM和5′RACE特异性引物进行PCR反应。反应条件与3′RACE相同。产物经1.5%琼脂糖凝胶电泳检测回收,连接,送测。

表1 实验所用引物及其序列
1.4 序列比较分析与结构预测
利用DNAstar7.0对3′RACE和5′RACE测序序列比对拼接,分别得到erα、erβ1和erβ2 cDNA全长。NCBI BLAST(http://blast.ncbi.nlm.nih.gov/Blast)同源性分析,应用NCBI中ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/)查找基因序列开放阅读框,推导出相应的氨基酸序列。利用SMART(http://smart.embl-heidelberg.de/smart)分析蛋白结构与功能。Clustalw2 (http://www.ebi.ac.uk/Tools/msa/clustalw2/)比对金钱鱼和其他物种雌激素受体氨基酸序列。应用MEGA6.0邻接法构建系统发生树,bootstraps验证值为1000。
1.5 金钱鱼雌激素受体组织分布
利用半定量PCR实验检测金钱鱼雌激素受体在不同组织中的分布。设计引物(表1),β-actin为内参基因。反应条件:β-actin26个循环,雌激素受体为33个循环;94℃预变性2 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s;最后72℃延伸10 min。PCR扩增体系与中间片段扩增相同。
1.6 金钱鱼雌激素受体基因表达分析
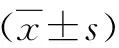
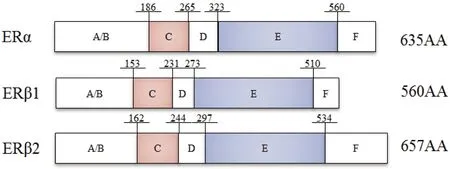
图1 金钱鱼ERα,ERβ1和ERβ2结构域比较
GenBank 登录号:Sa为金钱鱼;Lc:大黄鱼;SaERα: KU845212;SaERβ1: KU845213;SaERβ2: KU845214;LcERα: AIJ10715.1;LcERβ1: ADP09645.1;LcERβ2: AIJ10716.1。 黑框代表AF-1; 红框依次代表P-box、D-box、PKA、AF-2,代表半胱氨酸
在雨季来临之际,突降暴雨或阴雨持续不停的情况下,居民对内涝的发生是否有心理准备对防灾减灾也很重要。在接受访谈的人群中,有62%的居民表示没有心理准备,仅有38%的居民由于经历过多次的内涝灾害,一旦有类似降雨情况出现便有很强的心理暗示,因而会相应地采取一些预防措施,比如时刻关注天气情况,关掉电器,叮嘱亲朋好友出门时做安全防护等。对于大的内涝灾难来临时,70%的居民第一反应是先跑到高处,保护生命,但仍有30%的居民认为内涝灾害不会伤及生命,最重要的是抢救贵重物品,然后再躲避到安全区域。可见,大多数居民的自我保护意识很强,能够做到爱护生命,但仍有少数居民缺乏自保意识。
2 结果与分析
2.1 金钱鱼雌激素受体基因克隆及氨基酸序列预测
实验获得erα全长共2621 bp,其中包括5′-UTR(非编码区)241 bp,3′-UTR 472 bp,共编码635个氨基酸,蛋白分子质量为69.38 ku,GenBank登录号KU845212。erβ1全长共2891 bp,5′-UTR 597 bp,3′-UTR 611 bp,编码560个氨基酸,分子质量63.02 ku,登录号KU845213。erβ2全长2410 bp,5′-UTR 281 bp,3′-UTR 168 bp,编码氨基酸657个,分子质量72.44 ku,登录号为KU845214。金钱鱼雌激素受体基因序列3′端均含有加尾信号AATAA和poly A尾,同时还包括6个基本的功能域(图1)。ERα序列含有转录激活结构域AF-1,即MAPK激酶磷酸化位点。3种受体 C区长度基本一致,都包含由8个半胱氨酸残基组成的两个锌指结构(CI和CII),CI含P-box(EGCKA),CII含D-box(PATNQ/A)。E区含有转录激活结构域AF-2(DLLLEMLDA)。由氨基酸序列相似性可知(图2),雌激素受体C区和E区序列在鱼类间相似度很高。
2.2 金钱鱼雌激素受体编码的氨基酸比对以及系统进化分析
金钱鱼雌激素受体与欧洲鲈、黑棘鲷、大口黑鲈、斑马鱼、大黄鱼同源性比对(表2),金钱鱼ERα、ERβ1和ERβ2与欧洲鲈、黑棘鲷、大口黑鲈同源性最高。金钱鱼ERα、ERβ1和ERβ2与尼罗罗非鱼、欧洲鲈、黑棘鲷、大口黑鲈相似性分别为80.1%~91.7%,83.4%~89.9%和82.7%~88.4%,表明雌激素受体在物种间保守性较高。MEGA6邻接法(NJ)构建进化树(图3),结果显示,金钱鱼3种受体各自与其他物种同亚型聚为一支,ERβ1与ERβ2较ERα同源性更高,且金钱鱼与鲈形目鱼类亲缘关系最近。
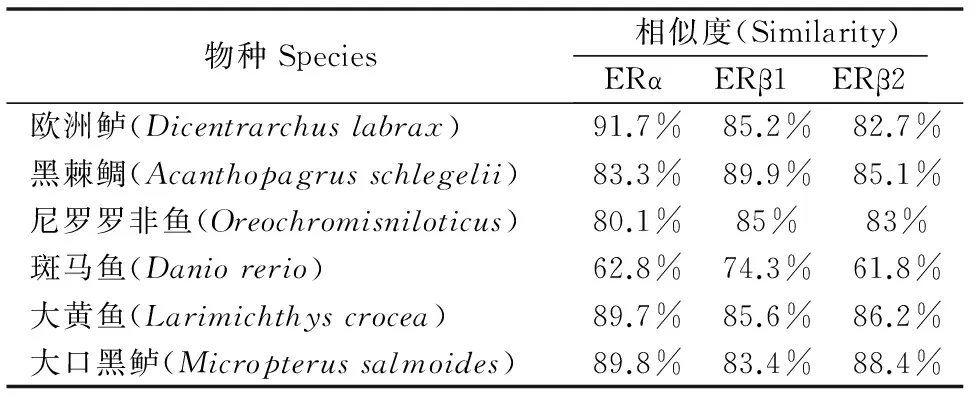
表2 金钱鱼雌激素受体与其他物种氨基酸相似度
2.3 金钱鱼雌激素受体在不同组织中的表达
2.4 金钱鱼性腺发育不同时期的雌激素受体表达水平
图3 NJ法构建金钱鱼雌激素受体与其他脊椎动物系统进化树
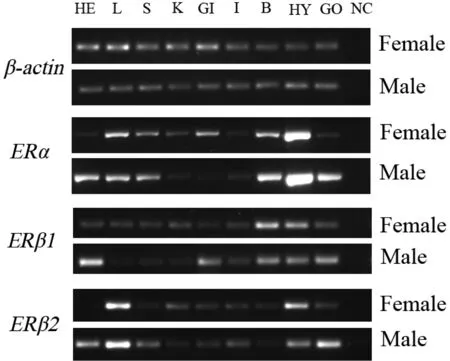
图4 雌雄金钱鱼各组织中雌激素受体的mRNA表达水平
HE:心脏;L:肝;S:脾;K:肾;GI:鳃;I:肠;B:脑;HY:垂体;GO:性腺;NC:对照
根据HE染色结果(图5),将精巢分为I期(精原细胞增殖期,图5-1) 、II期(精母细胞生长期,图5-2)、III期(精母细胞成熟期,图5-3)、IV 期(精子细胞变态期,图5-4);卵巢分为I期(卵原细胞增殖期,图5-5)、II期(卵母细胞生长期图5-6)、III期(卵黄发生期,图5-7)、IV期(卵黄成熟期,图5-8)。实时定量PCR结果显示, 卵巢中ERα基因mRNA相对表达量在I期(0.93±0.09)和IV期(1.00±0.12)较高,II期(0.17±0.03)和III期(0.20±0.06)表达量显著低于I和IV期(P<0.05),图6-A;ERβ1表达模式与ERα相似,I期(0.95±0.29)和IV期(1.04±0.17)表达量较高,II期(0.25±0.05)和III期(0.41±0.13)表达量逐渐增高,但显著低于I期和IV期(P<0.05),图6-C;ERβ2在I期(2.53±0.85)、II期(1.15±0.20)和IV期(0.98±0.13)表达量较高,相比于I期、II期、III期(0.33±0.09)和IV期表达量显著降低(图6-E)。而在精巢发育中雌激素受体均有较高表达。ERα表达量逐渐升高,IV期表达量显著升高,相对表达量分别为I期(2.02±0.27)、II期(2.63±0.41)、III期(3.58±0.83)、IV期(5.67±1.02),图6-B。ERβ1表达量先升高后下降,II期达到最大值,之后显著下降,相对表达量分别为I期(2.12±0.49)、II期(5.28±0.42)、III期(3.10±0.89)、IV期(1.43±0.21),图6-D。ERβ2在I期(4.62±1.25)、II期(5.66±0.71)、III期(5.78±1.41)相对表达水平较高,但三者之间无显著差异(P>0.05),IV期(3.15±0.48)表达水平显著下降(P<0.05),图6-F。以上统计分析利用SPSS 19.0软件中单因素Duncan法检验,n=3,当P<0.05时显著差异。
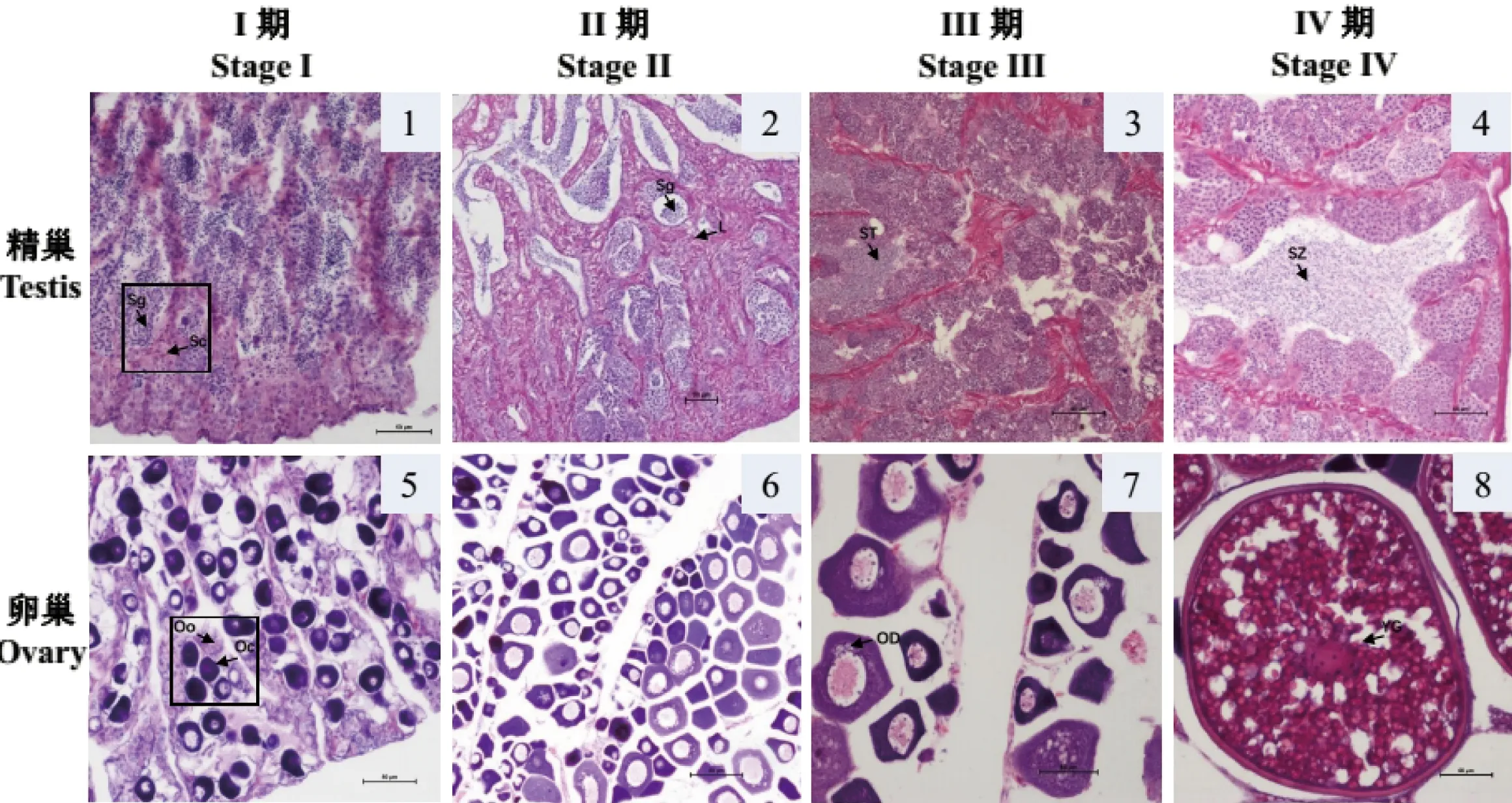
图5 金钱鱼性腺发育不同时期形态特征(×200)
1~4为I、II、III、IV期精巢结构; 5~8为I、II、III、IV期卵巢结构。Sg:精原细胞;Sc:精母细胞;ST:精子细胞;SZ:精子;Oo:卵原细胞;Oc:卵母细胞;OD:油滴;YG:卵黄颗粒
3 讨论
本研究克隆到金钱鱼3种雌激素受体cDNA全长,分别编码635、560和657个氨基酸。ERα和ERβ氨基酸序列从5′N端到3′C端可分为6个功能域:A/B区具有转录激活作用;C区含有锌指结构,参与DNA结合;D区为铰链区,维持雌激素受体三维结构[12];E区具有结合配体、配体二聚体化以及配体依赖的转录激活作用[13]。F区可影响抗雌激素抑制剂和激活剂的效力以及配体-受体复合体转录活性[14]。氨基酸序列比对结果表明,金钱鱼ERα的A/B 区中有转录激活结构域AF-1,即MAPK激酶磷酸化位点,提示ERα的转录活性可能是在MAPK信号通路中以非配体依赖性的方式激活的,这也是ERα的通常特征[15]。金钱鱼雌激素受体的C区均含有两个锌指结构(CI和CII),CI中的P-box控制雌激素受体对靶基因特异性选择,CII中的D-box控制非特异性结合靶基因,同时参与受体二聚体化[16]。C区和E区是ER核心功能域,从鱼类到哺乳类都很保守,这与大黄鱼[7],点带石斑鱼[17-18]结果一致,表明雌激素在鱼类和哺乳类动物中主要功能相近。氨基酸比对和系统进化树结果显示,金钱鱼雌激素受体分别与其他物种ERα,ERβ1和ERβ2各自聚为一支,且金钱鱼雌激素受体与鲈形目鱼类亲缘关系最近,表明雌激素受体在进化上具有很高的保守性。
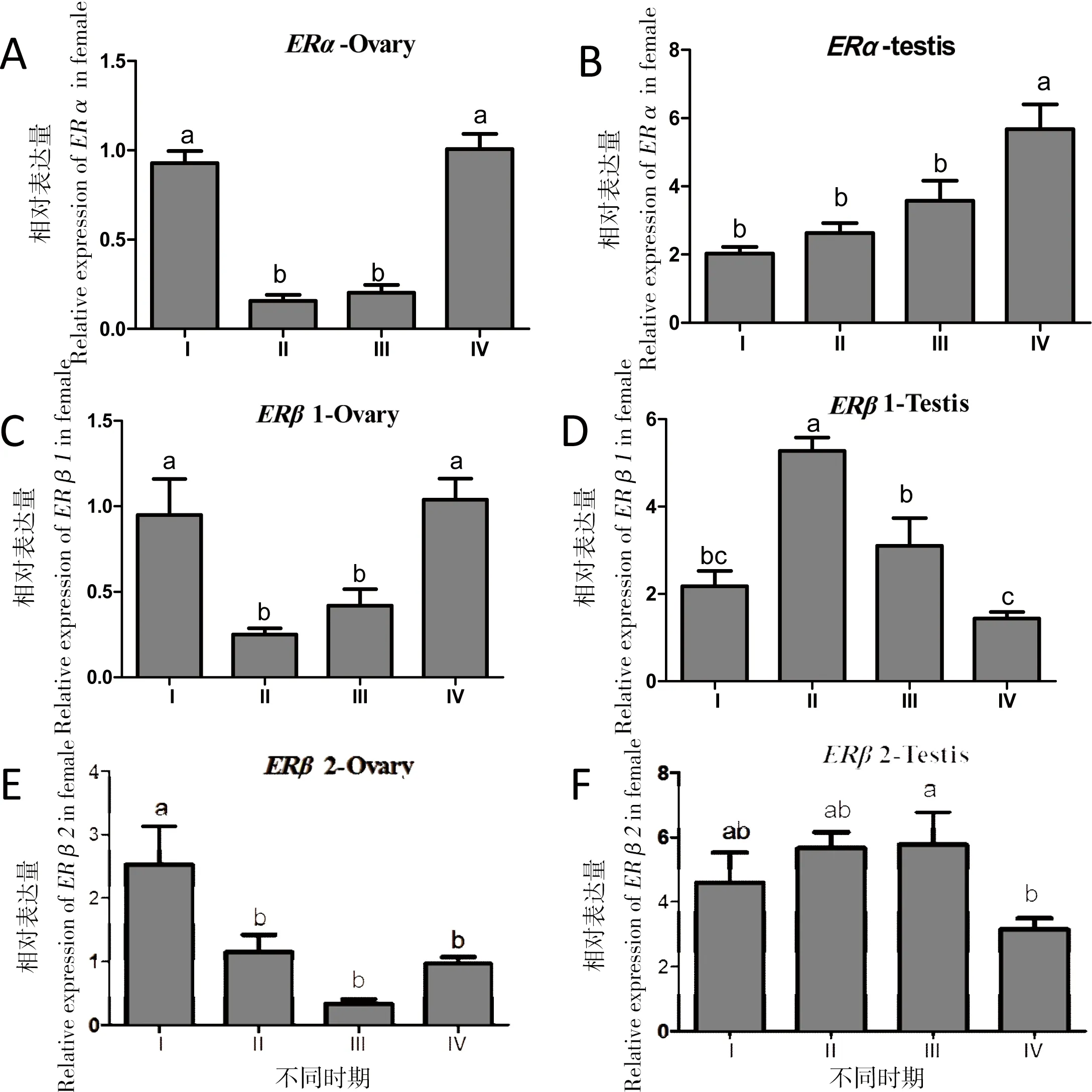
图6 金钱鱼雌激素受体在性腺不同发育时期mRNA相对表达水平
A、C、E分别代表erα、erβ1和erβ2卵巢中表达量;B、D、F代表erα、erβ1和erβ2精巢中表达量
组织分布显示,金钱鱼雌激素受体在脑、垂体、性腺、肝脏等器官中高表达,在其他组织表达量较低,且存在雌雄差异,说明雌激素主要参与调控生殖系统的生长和发育。雌激素受体各亚型在单一性别不同组织以及同一组织不同性别间丰度不同,表明雌激素受体不同亚型在不同的组织中可能主导作用不同。雌雄金钱鱼肝脏中erα和erβ2均有表达,且erβ2表达量高于erα,这与前人研究结果相似[19]。Nelson等[20]指出,敲除金鱼erα,雌雄鱼肝脏中卵黄蛋白原表达量均降低,而erβ1和erβ2被敲除后,雄鱼肝脏卵黄蛋白原完全抑制而雌鱼中仅仅降低,因此Nelson推测雄鱼中erβ1和erβ2对合成卵黄蛋白原至关重要,而雌鱼需要erα和erβ共同参与,硬骨鱼erβ与雌二醇的亲和力比erα强,推测erβ可能是雌激素感应器,erα通过erβ参与肝脏中卵黄蛋白原合成,进而参与卵巢发育。雌激素受体在脑、垂体中表达量较高,表明雌激素受体可能通过负反馈调节调控性腺发育[8]。
性腺不同发育时期分析表明,金钱鱼雌激素受体在精巢中表达量很高,表明雌激素可能直接作用于精巢调控生殖[21]。Eddy等[9]指出,敲除雄性成年小鼠erα,小鼠出现睾丸萎缩,精子数量减少,生殖力下降等现象,而Wu等[22]对斑点叉尾鮰erα定位显示,其在精子中表达。而金钱鱼erα在精子成熟时期显著升高,推测erα不仅在维持精巢正常功能等方面有重要的作用,同时也可能促进雄性配子最终成熟[23]。Miura研究发现,E2可以使日本鳗鲡精原干细胞有丝分裂速度加快,促进精原干细胞自我更新[24],大黄鱼中,erβ1和erβ2均存在于性腺发育早期精原细胞和精母细胞中[7],而金钱鱼erβ1和erβ2以极高的丰度存在于早期发育的精巢组织中,HE染色结果显示,这一时期精巢中生殖细胞主要包括精原细胞和初级精母细胞,推测金钱鱼erβ1和erβ2可能通过促进生殖细胞增殖参与调控精巢发育。
金钱鱼3种雌激素受体在卵原细胞增长期表达量较高,推测雌激素受体可能调控参与早期滤泡细胞生长的基因[25]。鱼类内源性E2可以促进颗粒细胞以及卵泡膜细胞生长和发育[26],而虹鳟中E2能抑制卵黄充满期卵母细胞滤泡闭锁[27],金钱鱼雌激素受体在卵黄充满期也有较高表达,推测金钱鱼雌激素受体在维持卵巢正常功能以及卵巢发育中具有重要的作用。但是,目前硬骨鱼中关于雌激素受体在卵巢发育过程中的具体作用机制还不明确。本文初步对金钱鱼雌激素受体在性腺发育中的作用进行探讨,但具体机制以及各亚型的具体作用还需通过原位杂交,基因敲除等技术进一步研究。
[1]EICK G N, THORNTON J W. Evolution of steroid receptors from an estrogen-sensitive ancestral receptor[J]. Molecular and Cellular Endocrinology, 2011, 334(1-2): 31-38.
[2]MCCARTHY M M. How it's made: organisational effects of hormones on the developing brain[J]. J Neuroendocrinol, 2010, 22(7): 736-742.
[3]LUBZENS E, YOUNG G, BOBE J, et al. Oogenesis in teleosts: how eggs are formed[J]. General and comparative endocrinology, 2010, 165(3): 367-389.
[4]NAGLER J J, CAVILEER T, SULLIVAN J, et al. The complete nuclear estrogen receptor family in the rainbow trout: discovery of the novel ERalpha2 and both ERbeta isoforms[J]. Gene, 2007, 392(1-2): 164-173.
[5]ZHU P, ZHANG Y, ZHUO Q, et al. Discovery of four estrogen receptors and their expression profiles during testis recrudescence in maleSpinibarbusdenticulatus[J]. General and Comparative Endocrinology, 2008, 156(2): 265-276.
[6]GRIFFIN L B, JANUARY KE, HO K W, et al. Morpholino-mediated knockdown ofERalpha,ERbetaa, andERbetabmRNAs in zebrafish (Daniorerio) embryos reveals differential regulation of estrogen-inducible genes[J]. Endocrinology, 2013, 154(11): 4158-4169.
[7]CHEN S, PU L, XIE F, et al. Differential expression of three estrogen receptors mRNAs in tissues, growth development, embryogenesis and gametogenesis from large yellow croaker,Larimichthyscrocea[J]. General and Comparative Endocrinology, 2015, 216:134-151.
[8]COUSE J F, YATES M M, SANFORD R, et al. Formation of cystic ovarian follicles associated with elevated luteinizing hormone requires estrogen receptor-beta[J]. Endocrinology, 2004, 145(10): 4693-4702.
[9]EDDY E M, WASHBURN T F, BUNCH D O, et al. Targeted disruption of the estrogen receptor gene in male mice causes alteration of spermatogenesis and infertility[J]. Endocrinology, 1996, 137(11): 4796-4805.
[10]方永强, 张为民, 翁幼竹. 17β-雌二醇促进鲻鱼性腺发育的作用机制:雌激素受体的定位[J]. 台湾海峡, 2003, 22(4): 422-425.
[11]崔 丹, 刘志伟, 刘南希, 等. 金钱鱼性腺发育及其组织结构观察[J]. 水产学报, 2013, 37(5): 696-704.
[12]HUYET J, PINON G M, FAY M R, et al. Structural determinants of ligand binding to the mineralocorticoid receptor[J]. Molecular and Cellular Endocrinology, 2012, 350(2): 187-195.
[13]PINTO P I, PASSOS A L, MARTINS DEBORAH M P R S, et al. Characterization of estrogen receptor betab in sea bream (Sparusauratus): phylogeny, ligand-binding, and comparative analysis of expression[J]. General and Comparative Endocrinology, 2006, 145(2): 197-207.
[14]MOSSELMAN S, POLMAN J, DIJKEMA R. ER beta: identification and characterization of a novel human estrogen receptor[J]. FEBS Lett, 1996, 392(1): 49-53.
[15]SHI D, WEN H S, HE F, et al. The physiology functions of estrogen receptor alpha (ERalpha) in reproduction cycle of ovoviviparous black rockfish,SebastesschlegeliHilgendorf[J]. Steroids, 2011, 76(14): 1597-1608.
[16]FAIRALL L, SCHWABE J W, CHAPMAN L, et al. The crystal structure of a two zinc-finger peptide reveals an extension to the rules for zinc-finger/DNA recognition[J]. Nature, 1993, 366(6454): 483-487.
[17]CHEN H, ZHANG Y, LI S, et al. Molecular cloning, characterization and expression profiles of three estrogen receptors in protogynous hermaphroditic orange-spotted grouper (Epinepheluscoioides)[J]. General and Comparative Endocrinology, 2011, 172(3): 371-381.
[18]FU M, XIONG X R, LAN D L, et al. Molecular characterization and tissue distribution of estrogen receptor genes in domestic yak[J]. Asian-Australas J Anim Sci, 2014, 27(12): 1684-1690.
[19]NELSON E R, HABIBI H R. Functional significance of nuclear estrogen receptor subtypes in the liver of goldfish[J]. Endocrinology, 2010, 151(4): 1668-1676.
[20]NELSON E R, HABIBI H R. Estrogen receptor function and regulation in fish and other vertebrates[J]. General and Comparative Endocrinology, 2013, 192:15-24.
[21]NILSSON S, MAKELA S, TREUTER E, et al. Mechanisms of estrogen action[J]. Physiological Reviews, 2001, 81(4): 1535-1565.
[23]DELALANDE C, GOUPIL A S, LAREYRE J J, et al. Differential expression patterns of three aromatase genes and of four estrogen receptors genes in the testes of trout (Oncorhynchusmykiss)[J]. Molecular Reproduction and Development, 2015, 82(9): 694-708.
[24]MIURA T, MIURA C, OHTA T, et al. Estradiol-17beta stimulates the renewal of spermatogonial stem cells in males[J]. Biochemical and Biophysical Research Communications, 1999, 264(1): 230-234.
[25]SABO-ATTWOOD T, KROLL K J, DENSLOW N D. Differential expression of largemouth bass (Micropterussalmoides) estrogen receptor isotypes alpha, beta, and gamma by estradiol[J]. Molecular and Cellular Endocrinology, 2004, 218(1-2): 107-118.
[26]RICHARDS J S. Hormonal control of gene expression in the ovary[J]. Endocrine Reviews, 1994, 15(6): 725-751.
[27]WOOD A W, VAN DER KRAAK G. Inhibition of apoptosis in vitellogenic ovarian follicles of rainbow trout (Oncorhynchusmykiss) by salmon gonadotropin, epidermal growth factor, and 17beta-estradiol[J]. Molecular Reproduction and Development, 2002, 61(4): 511-518.
Cloning and expression analysis oferα,erβ1 anderβ2 genes fromScatophagusargus
LI Hong, ZHANG Jin-peng, LIAN Ying, ZHANG Jun-bin
(College of Aquaculture and Life, Shanghai Ocean University, Shanghai 201306, China)
Three estrogen receptors (erα,erβ1 anderβ2) ofScatophagusarguswere cloned in this study. The lengths oferα, erβ1 and erβ2 were 2621 bp, 2891 bp and 2410 bp, respectinvely, encoding of 635, 560 and 657 arnino avids, corespondingly. The similarity analysis of amino acid sequences showed that ERα, ERβ1 and ERβ2 ofScatophagusargusshared the highest similarity withDicentrarchuslabrax,AcanthopagrusschlegeliiandMicropterussalmoides, and the similarity was 91.7%, 89.9% and 88.4%, respectively. Semi-quantitative RT-PCR showed thatERαandERβ1 were mainly expressed in hypophysis, brain and testis. The high expression oferβ2 was found in the liver, hypophysis and testis, while low expression was found in other tissues.erαexpression was higher thanerβ1 anderβ2 in these tissues of brain, hypophysis and gonad, but theerβ2 expression in liver was higher contrary to erα. Results of Real-time PCR showed thaterαexpression significantly increased in sperm maturation period, buterβ1 anderβ2 had highest expression in the early development in testis. In the ovary, estrogen receptor ofScatophagusarguswas mainly expressed in oogonium and oocyte with full of yolk. These results demonstrated that the three estrogen receptors have important functions in the development of testis and ovary.
Scatophagusargus; estrogen receptor; sequence analysis; gene expression
2016-04-28;
2016-05-12
国家自然科学基金委项目(31272662)
李 红,硕士研究生,研究方向为分子生物学,E-mail:nlxxlh@126.com
张俊彬,博士,教授,从事海水鱼类繁育生物学和分子生态学研究,E-mail:jb-zhang@shou.edu.cn
Q78;S917.4
A
2095-1736(2017)02-0040-06
doi∶10.3969/j.issn.2095-1736.2017.02.040

