广西巴马小型猪皮肤成纤维细胞的分离培养体系优化
张大鹏, 李跃民, 栗 楠, 邱小燕, 杨 波, 肖 雄
(西南大学 动物科技学院, 重庆 400715)
广西巴马小型猪皮肤成纤维细胞的分离培养体系优化
张大鹏, 李跃民, 栗 楠, 邱小燕, 杨 波, 肖 雄
(西南大学 动物科技学院, 重庆 400715)
通过比较6种方法和5个部位分离成纤维细胞的效率,旨在优化广西巴马小型猪皮肤成纤维细胞的分离培养体系。结果表明:1)采用酶消化法Ⅰ所得成纤维细胞的密度显著高于其他处理组(P<0.05),其死亡率与方法Ⅳ处理组之间差异不显著(P>0.05),但显著低于其余处理组(P<0.05);2)冷冻保存10 d后复苏的耳部皮肤组织,经方法Ⅰ酶消化后所得成纤维细胞的密度和存活率均分别极显著低于新鲜组织方法Ⅰ处理组(P<0.01);3)组织块培养4 d后即可从其边缘长出成纤维细胞,再经过8 d培养,细胞汇合率可达100%;4)耳部皮肤组织所获成纤维细胞的密度显著高于其他部位处理组(P<0.05),而且贴壁生长效果良好;5)所得耳部皮肤成纤维细胞可传至10代以上,其中第3代和第4代生长最为迅速;6)生长曲线显示第3代耳部皮肤成纤维细胞呈典型的“S形”生长。因此,宜选用先加0.25%胰蛋白酶+0.04% EDTA消化30 min,再用0.2%胶原蛋白酶消化30 min的方法分离广西巴马小型猪的耳部皮肤成纤维细胞。
广西巴马小型猪;皮肤成纤维细胞;酶消化法;组织块培养法
猪在解剖结构、生理特征、营养代谢、疾病发生机理等方面与人类颇为相似,在生命科学领域中具有重要的研究和应用价值。小型猪作为异种移植的供体具有诸多优点,既能提供充足的供体器官、组织和细胞,又可克服灵长类动物带来的伦理道德、烈性病毒传染病等问题,还可作为生物反应器生产人类的重要蛋白,有望取代实验猴、犬而成为被大量使用的新型大型实验动物[1]。广西巴马小型猪因具有体型小、两头乌毛色整齐、繁殖性能好、遗传性稳定、生物学特性明确等特点而成为适于实验应用的小型猪品系[2]。克隆、转基因、干细胞和重编程等的发展为小型猪的开发应用提供了技术支持,皮肤成纤维细胞因来源充足、取材方便、便于保存、增殖能力强等优点,现已成为良好的供体细胞,而细胞的分离、培养和保存直接影响这些技术的效率,因此,本研究探讨了广西巴马小型猪皮肤成纤维细胞的分离及培养体系,旨在提高其分离效率和培养质量,为借助生物学技术推动小型猪的应用奠定基础。
1 材料与方法
1.1 实验动物
3月龄广西巴马小型猪,购自重庆鑫宜居生态农业发展有限公司。
1.2 耳部皮肤成纤维细胞的分离和原代培养
采用颈动脉放血法处死小型猪,剪取耳朵,经生理盐水反复冲洗、手术刀片刮除被毛和再次清洗后,浸入75%酒精内消毒1 min,立即置入PBS内充分清洗,采用眼科剪于无菌平皿内取其耳部皮肤组织,称重后装于青霉素瓶内(0.1g组织/瓶),将组织剪碎至1 mm3大小,然后按照表1的不同方法处理。经反复吹打和300目细胞筛过滤后,收集滤液转入10 mL离心管内,1000 r/min离心5 min,弃上清后,加入2 mL DMEM培养液(高糖DMEM 840 mL + 胎牛血清150 mL + 非必需氨基酸10 mL + 碳酸氢钠3.7 g+丙酮酸钠0.11 g+青霉素0.0313 g+链霉素0.0643 g)重悬细胞,细胞计数计算密度,0.4%台盼蓝染色统计细胞死亡率,调整细胞密度为5×105个/mL,37℃、饱和湿度、5%CO2培养箱内培养。
1.3 不同部位皮肤成纤维细胞的分离和原代培养
充分清洗已处死的小型猪体表后,采用手术刀片刮除耳部、腿部、腹部、背部和尾部的被毛,剪取适量不同部位的皮肤组织块,于75%酒精内消毒1 min,经PBS充分清洗后,剪取每个部位组织样品0.1g,置于青霉素瓶内,将其剪碎至1 mm3大小。采用1.2试验中所得最佳处理方法分离细胞,最后加入2 mL DMEM培养液重悬细胞,计算细胞密度和存活率,以5×105个/mL的细胞密度于37℃、饱和湿度、5%CO2培养箱内培养。
1.4 传代培养
原代培养的细胞,每24 h半量换液1次,待细胞汇合率达到85%~90%时进行传代培养。即吸弃培养液后PBS清洗2次,加入0.125%胰蛋白酶+0.02% EDTA消化细胞,待绝大部分细胞变圆后,立即加入等量DMEM培养液终止消化。收集细胞液至10 mL离心管内,1000 r/min离心5 min,弃上清后,加入2 mL DMEM培养液,以5×105个/mL的密度分装入培养瓶中,于37℃、饱和湿度、5%CO2培养箱内进行传代培养。长梭形贴壁生长细胞即为成纤维细胞。

表1 广西巴马小型猪耳部皮肤成纤维细胞原代分离培养的不同处理方法
Ⅰ:0.25%胰蛋白酶+0.04% EDTA消化30 min + 0.2%胶原蛋白酶消化30 min;Ⅱ:0.2%胶原蛋白酶消化30 min + 0.25%胰蛋白酶+0.04% EDTA消化30 min;Ⅲ:0.25%胰蛋白酶+0.04% EDTA消化60 min;Ⅳ:0.125%胰蛋白酶+0.02% EDTA消化60 min;Ⅴ:组织块经冷冻保存、复苏后进行分离;Ⅵ:组织块培养法
1.5 生长曲线的绘制
待成纤维细胞传代至生长旺盛期时,按5×104个/mL的密度接种于12孔培养板内,每孔加入1 mL细胞悬液后进行培养。每24 h消化细胞并加入1 mL DMEM培养液重悬细胞,0.4%台盼蓝染色统计活细胞数量,连续统计12 d,绘制生长曲线图。
1.6 冷冻保存与复苏
传代纯化的细胞经离心和弃除上清液后,加入1.5 mL细胞冻存液(DMEM+20%胎牛血清+10%二甲基亚砜),制成细胞重悬液,移入1.8 mL的冷冻管中。4℃冰箱预冷30 min、-20℃冰箱冷冻2 h、液氮上方预冷过夜后浸入液氮中进行冷冻保存。细胞复苏时,取出冻存管并迅速置于40℃水浴锅内使其快速解冻,然后离心、重悬细胞,调整密度后体外培养。
1.7 数据统计
成纤维细胞的密度和死亡率数据采用“平均值±标准差”的形式表示,采用SPSS 17.0统计软件进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 不同酶消化方法对广西巴马小型猪耳部皮肤成纤维细胞分离效率的影响
由图1可知,方法Ⅰ所得成纤维细胞的密度显著高于其他各处理组(P<0.05);方法Ⅱ所得细胞密度显著高于方法Ⅲ(P<0.05);方法Ⅳ与方法Ⅴ所得细胞密度均明显低于其余各处理组(P<0.05)。如图2所示,方法Ⅰ分离所得细胞的死亡率与方法Ⅳ差异不显著(P>0.05),但均显著低于其他各处理组(P<0.05)。因此,宜选用方法Ⅰ分离广西巴马小型猪的耳部皮肤成纤维细胞,这些细胞可快速贴壁,培养2 d后汇合率可达50%,5 d后达到100%(见图3);冷冻保存耳部皮肤组织块经解冻复苏、方法Ⅰ消化后所得原代成纤维细胞的生长速度变慢,培养2 d后细胞汇合率仅有5%左右,培养5 d可达到50%(见图4)。

图1 不同方法分离所得广西巴马小型猪耳部皮肤成纤维细胞的细胞密度
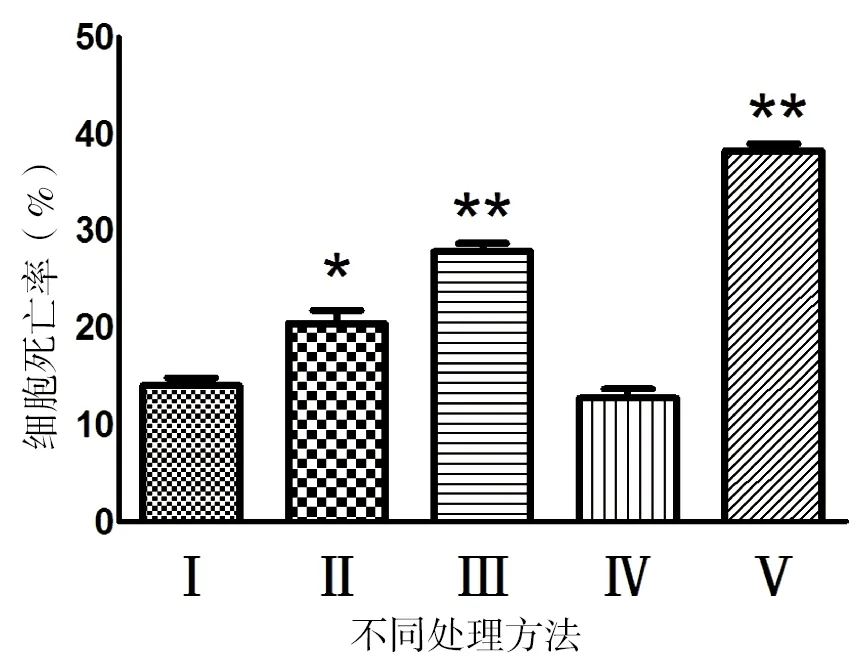
图2 不同分离方法对广西巴马小型猪耳部皮肤成纤维细胞死亡率的影响
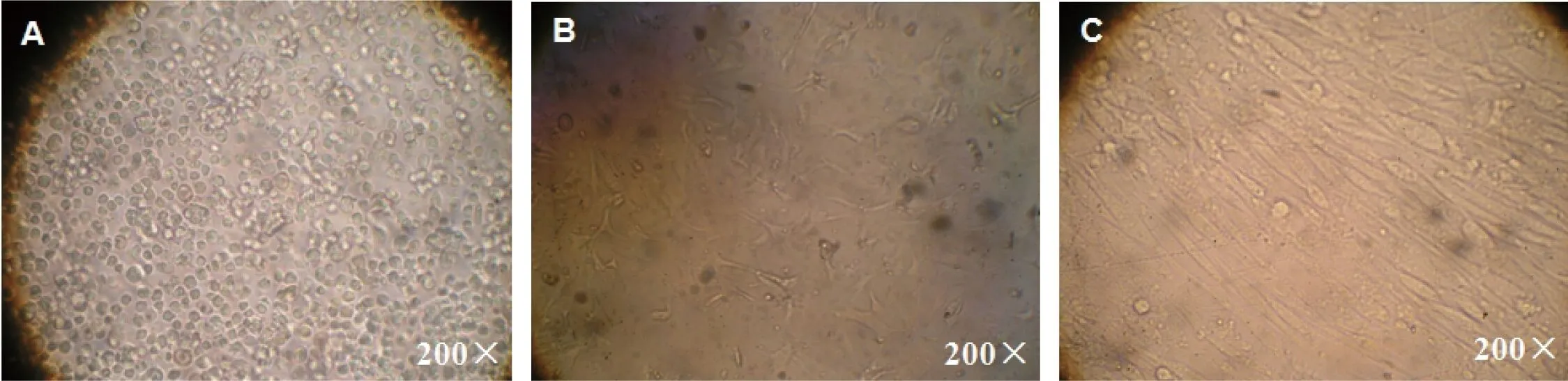
图3 采用方法Ⅰ分离所得广西巴马小型猪耳部皮肤成纤维细胞原代培养的贴壁生长情况
A: 分离所得原代细胞;B: 培养2 d后;C:培养5 d后

图4 冷冻保存和解冻复苏后的广西巴马小型猪耳部皮肤组织块经方法Ⅰ分离所得成纤维细胞原代培养的贴壁情况
A: 分离所得原代细胞;B:培养2 d后;C:培养5 d后
2.2 广西巴马小型猪耳部皮肤成纤维细胞的组织块培养
经组织块培养后,第4天可见从组织块周围长出成纤维细胞(见图5-A),此后,于第6天时去除组织块,细胞可进一步扩增(见图5-B),但由于细胞基数小,生长较缓慢,待细胞生长至汇合率达培养瓶底100%时需要12 d左右的时间(见图5-C),因此,相对于酶消化法而言,该方法耗时较长。
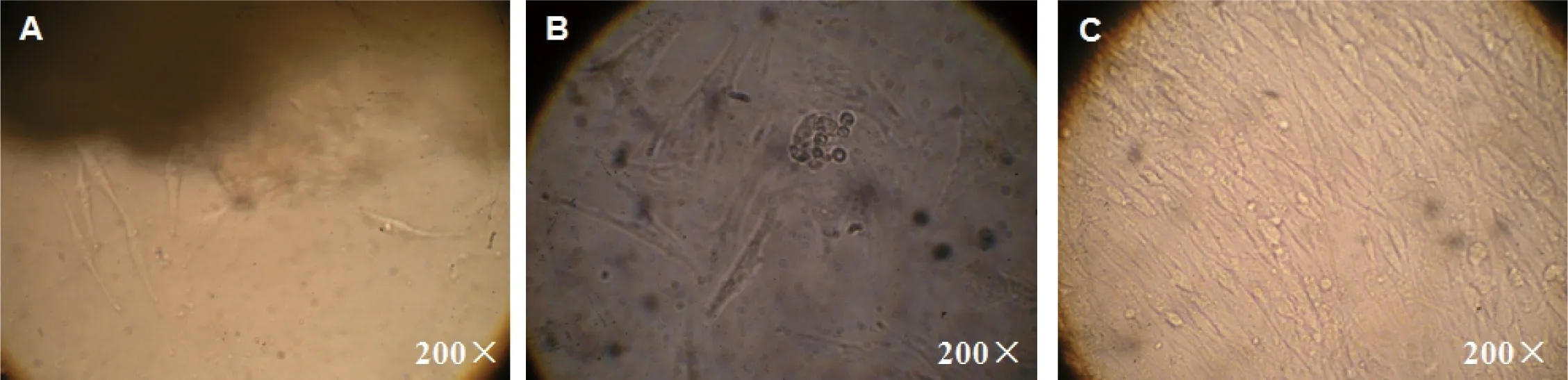
图5 组织块培养法所得广西巴马小型猪耳部皮肤成纤维细胞的生长情况
A: 第4天;B: 第6天;C: 第12天
2.3 不同部位组织对广西巴马小型猪皮肤成纤维细胞分离效率的影响
采集广西巴马小型猪5个不同部位(耳部、腿部、腹部、背部和尾部)的皮肤组织,应用方法Ⅰ分离皮肤成纤维细胞。由图6可知,耳部皮肤组织所获成纤维细胞的密度显著高于其他部位处理组(P<0.05),而且细胞贴壁生长效果良好(见图7);因此,宜选用耳部皮肤组织分离成纤维细胞。
2.4 广西巴马小型猪耳部皮肤成纤维细胞的传代培养
广西巴马小型猪耳部皮肤成纤维细胞可传至10代以上,其中第3代和第4代成纤维细胞生长最为迅速,呈旋涡状生长;第8代细胞的生长活力开始下降,生长速度变缓;第10代细胞很多贴壁后形态畸变,呈星型分叉;细胞传至第12代时,贴壁生长变得非常迟缓(约24 h后才可贴壁),且贴壁后容易脱落浮起(见图8)。

图7 广西巴马小型猪不同部位皮肤组织成纤维细胞原代培养贴壁情况
Fig 7 The adherent growth of primary skin fibroblasts from different parts of Guangxi Bama mini-pig
A、a:耳部;B、b:腿部;C、c:腹部;D、d:背部;E、e:尾部

图8 不同传代次数的广西巴马小型猪耳部皮肤成纤维细胞的贴壁生长情况
A: 第2代;B: 第3代;C: 第4代;D: 第8代;E:第10代;F:第12代
2.5 广西巴马小型猪耳部皮肤成纤维细胞的解冻复苏培养
第3代广西巴马小型猪耳部皮肤成纤维细胞经解冻复苏后,细胞生长速度较冷冻保存前略为迟缓,经过5 d培养其汇合率才可达到75%(见图9),但通过再次传代培养后,细胞活力即可得到恢复。
2.6 广西巴马小型猪耳部皮肤成纤维细胞生长曲线的绘制
由图10可知,第3代广西巴马小型猪耳部皮肤成纤维细胞呈典型的“S形”生长,即第0~3天内细胞处于生长沉默期,增殖缓慢;第3~8天内细胞呈对数生长;第8~10天细胞进入生长平台期;第10天后细胞贴壁能力下降,呈负增长。
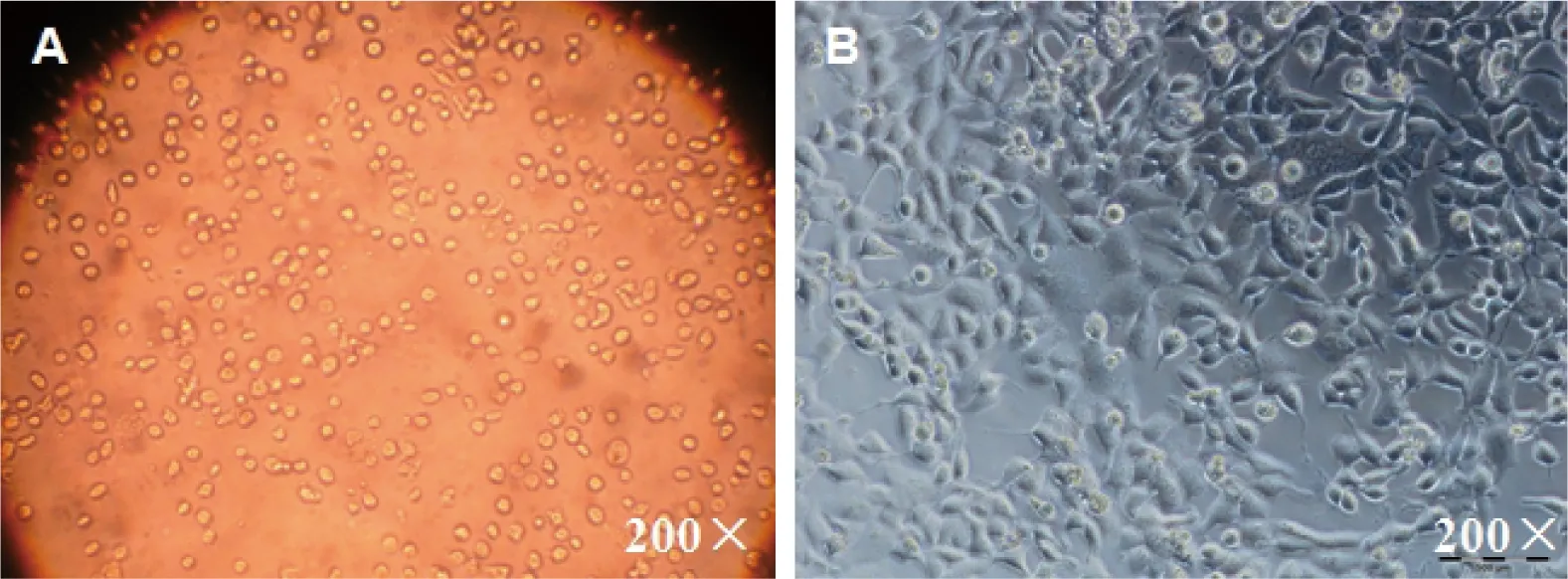
图9 广西巴马小型猪耳部皮肤成纤维细胞冷冻复苏后的生长情况
A:耳皮肤成纤维细胞复苏后;B:耳皮肤成纤维细胞培养5 d后

图10 广西巴马小型猪耳部皮肤成纤维细胞的生长曲线
3 讨论与结论
广西巴马小型猪是一种原产于广西巴马县的小型猪品种,经以基础群内闭锁纯繁选育及半同胞为主的近交方式选育而成,其微型体型、生长缓慢、独特毛色、早熟多产、遗传特性稳定等特点使之非常适于实验动物化,可用于异种器官移植、疾病模型(如肿瘤、心脑血管疾病、糖尿病、皮肤烧伤、遗传病、营养代谢病等)构建、新药安全性评价、生物反应器、生产性状改良、肉品生产、伴侣动物等领域。转基因、核移植、干细胞、体细胞重编程等技术也开始应用于该新型实验动物,皮肤成纤维细胞是这些技术的常用供体细胞,鉴于广西巴马小型猪皮肤组织的特点以及不同部位存在的差异,本研究比较了6种方法和5个部位分离皮肤成纤维细胞的效率,从而优化了其分离培养体系,为采用新兴技术研究广西巴马小型猪提供充足的靶细胞,同时也为其他品种猪成纤维细胞的分离培养提供参考。
本研究比较了5种酶消化法分离广西巴马小型猪皮肤成纤维细胞的效率,结果表明采用方法Ⅰ所得细胞密度显著高于其他各处理组,且细胞死亡率较低。这与杨素芳等[3]的研究结果类似。基于猪皮肤组织的特点,单独使用胰蛋白酶处理,因无法消化结缔组织形成的纤维状黏稠团,致使已分离的细胞包裹和吸附其内,无法分散,如再加入胶原蛋白酶,则可“打散”纤维状黏稠团,释放细胞,提高成纤维细胞的分离效率;如若调换两种酶的加入顺序,则未分离的细胞致使胶原蛋白酶消化其间的结缔组织不完全,使得胰蛋白酶消化分离出的有些细胞又网络其中,降低细胞分离效率;细胞筛过滤之前适当降低酶消化细胞悬液的浓度也有利于获得更多的细胞;酶作用时间越长对细胞的损伤越大。
广西巴马小型猪耳部皮肤组织块经冷冻保存、解冻复苏后采用方法Ⅰ分离成纤维细胞,所获细胞密度及存活率均显著低于冻存前组织。这可能与冻存过程中大量处于组织块内部的细胞无法与冷冻保护剂充分接触,从而形成很多胞内冰晶,造成细胞损伤;以及组织块中的很多胶原组织在冻存中产生凝聚,致使胰蛋白酶和胶原蛋白酶难以从中消化出细胞等有关。因此,在组织块冷冻保存时,逐级递减冷冻温度[4-5]以及选取适宜的组织块大小[6]均有利于提高细胞的分离效率。目前已有不少经组织冷冻保存后成功使其重新恢复功能的研究[7-8],该方法在许多珍贵动物组织、器官的保存以及细胞研究等方面具有重要意义。
采用组织块培养法获取原代成纤维细胞时,细胞生长周期较酶消化法长,这主要是由于组织块中成纤维细胞堆积紧密,以及大量胶原组织的存在,致使内部细胞无法向四周扩增所致;此外,还与所选动物的日龄和取材部位[9]等有关,通常幼龄动物组织块长出细胞的速度快于成年动物组织[10-12]。
由于机体各部位中的组织成分以及细胞种类和含量不同,故所获成纤维细胞也存在差异性[9,13]。相比较广西巴马小型猪的耳部、腹部和腿部,尾部和背部的皮肤组织质地较硬,剪碎及消化过程较为困难,降低分离效率;腹部和腿部虽容易获取细胞,但在分离所得细胞中有很多杂细胞(如上皮细胞),从而影响原代成纤维细胞的贴壁和生长;耳部皮肤组织相对较薄、柔软、皮下组织少,易于剪碎和酶消化,采用先胰蛋白酶后胶原蛋白酶的消化方法可以获取较高的原代细胞密度,经传代培养前反复使用D-PBS清洗培养瓶内的贴壁细胞,可以将绝大部分杂细胞去除,至第3代时,成纤维细胞呈现出均一的长梭形贴壁生长。第3代成纤维细胞的生长曲线与赵彦玲等[14]和杨素芳等[3]的结果类似。
因此,宜采用先经0.25%胰蛋白酶+0.04% EDTA消化30 min,再用0.2%胶原蛋白酶消化30 min的方法分离广西巴马小型猪耳部皮肤成纤维细胞,其传代培养及冷冻保存效果良好,呈典型的“S”型生长。
[1]张德福,戴建军,吴彩凤. 小型猪实验动物化研究现状及其应用前景[J]. 猪业科学,2009,26(3):74-76.
[2]王爱德,兰干球,郭亚芬. 广西巴马小型猪的培育[J]. 实验动物科学,2010,27(1):60-63.
[3]杨素芳,汪彩珠,陈凌声,等. 广西巴马香猪耳皮成纤维细胞的分离与培养[J]. 湖北农业科学,2009,48(3):547-552.
[4]顾 峥,黄靖香. 活组织块保存与存活的实验观察[J]. 诊断病理学杂志,2004, 11(4):281.
[5]程旭梅,倪黎纲,吴晓伟,等. 猪皮肤组织块冷冻保存方法的研究[J]. 扬州大学学报(农业与生命科学版),2008,29(3):67-71.
[6]FERREIRA M, BOS-MIKICH A, FRANTZ N, et al. The effects of sample size on the outcome of ovarian tissue cryopreservation[J]. Reproduction in Domestic Animals, 2010, 45(1): 99-102.
[7]OKTAY K. Ovarian tissue cryopreservation and transplantation: preliminary findings and implications for cancer patients[J]. Human Reproduction Update, 2001, 7(6): 526-534.
[8]YOKONISHI T, SATO T, KOMEYA M, et al. Offspring production with sperm grown in vitro from cryopreserved testis tissues[J]. Nature Communications, 2014, 5: 4320.
[9]王献伟,卢晟盛,卢克焕. 广西巴马小型猪成纤维细胞体外培养体系的建立[J]. 西南农业学报, 2011, 24(5):1955-1961.
[10]丁国杰,王丹娜,柴 华,等. 不同方法培养猪胎儿成纤维细胞的研究[J]. 畜牧兽医科技信息, 2007,4:33-34.
[11]信吉阁,成文敏,潘伟荣,等. 猪胎儿成纤维细胞和耳皮肤成纤维细胞培养方法的研究[J]. 黑龙江畜牧兽医, 2013,5:1-4.
[12]刘 伟,吴华莉,张德福. 猪耳成纤维细胞的体外培养及EGFP基因的转染[J]. 上海农业学报, 2007, 23(4):10-13.
[13]孙焕林,方南洙,胡艳明,等. 不同来源的牛皮肤成纤维细胞原代培养效果对核移殖胚发育的影响[J]. 中国畜牧杂志,2009,45(19):21-24.
[14]赵彦玲,吴庆侠,强巴央宗,等. 藏猪耳部成纤维细胞的分离与培养[J]. 广东农业科学, 2013, 40(17):130-132.
Isolation and culture of skin fibroblasts in Guangxi Bama mini-pig
ZHANG Da-peng, LI Yue-min, LI Nan, QIU Xiao-yan, YANG Bo, XIAO Xiong
(College of Animal Science and Technology, Southwest University, Chongqing 400715, China)
In order to screen appropriate methods for the isolation and culture of the skin fibroblasts from Guangxi Bama mini-pig, five enzyme digestion methods and a tissue culture method were compared in the isolation of fibroblasts of skins from different parts of mini-pig including ear, leg, abdomen, back, and tail . The results indicated that the density of fibroblasts isolated with enzyme digestion methodⅠwas significantly higher than that in other treatment groups (P<0.05), and there was no significant difference in the cell death rates between fibroblasts from the shin treated with enzyme digestion methodⅠand that with enzyme digestion method Ⅳ (P>0.05), but the cell death rates in those two treatment groups were significantly lower than that in other groups, respectively (P<0.05). Fibroblast could be isolated from the thawed ear shin tissues after frozen for 10 days with enzyme digestion methodⅠ, but the density of fibroblasts and their survival rate were significantly lower than that from the fresh ear shin tissues with the same method (p<0.01). The cell confluency rate of fibroblasts would not reach to about 100% until being cultured for 12 days. Compared to other parts of mini-pig, ear skin was more suitable to isolate the fibroblasts, because the density of fibroblasts isolated from ear skin tissues was significantly higher than that from other parts of mini-pig (P<0.05), and the attachment and growth of those fibroblasts were very well. Ear skin fibroblasts were able be passaged up to more than passage 10, but the viability of cells at passage 3 to 4 was higher than that of cells at other passage. The cell growth curve of ear skin fibroblasts at passage 3 was a typical "S" shape. Therefore, it is better to isolate the fibroblasts from the ear skin of Guangxi Bama mini-pig with the digestion of 0.25% trypsase and 0.04% EDTA for 30 min, follow by 0.2% collagenase for 30 min.
Guangxi Bama mini-pig; skin fibroblasts; enzyme digestion method; tissue culture method
2016-04-29;
2016-05-12
国家自然科学基金项目(31572488);重庆市基础与前沿研究计划项目(cstc2013jcyjA10110);中央高校基本科研业务费项目(XDJK2014C022);西南大学博士基金项目(SWU13002)
张大鹏,硕士研究生,主要从事动物胚胎工程和临床兽医学方面的研究,E-mail:522672133@qq.com
肖 雄,博士,副教授,主要从事动物胚胎工程、细胞生物学和兽医产科学方面的研究,E-mail: y1982@swu.edu.cn
Q813.1;S828
B
2095-1736(2017)02-0099-05
doi∶10.3969/j.issn.2095-1736.2017.02.099

