小鼠生物法检测麻痹性贝类毒素技术探讨及应用
朱敬萍,金雷,张小军,陈瑜,顾蓓乔,梅光明
(浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江 舟山316021)
小鼠生物法检测麻痹性贝类毒素技术探讨及应用
朱敬萍,金雷,张小军,陈瑜,顾蓓乔*,梅光明
(浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江 舟山316021)
为了确保贝类毒素监测结果的有效性和可信性,建立和规范快速准确的麻痹性贝类毒素(PSP)检测方法,本研究梳理了小鼠生物法(MBA)快速准确检测PSP的实验室规范要求、影响因素及操作要点。并运用MBA法,对浙江沿岸海域养殖区采集的贝类样品进行3个批次的PSP应急监测分析,结果表明,赤潮高发对贝类富集PSP有很大影响。此外,结合对浙江沿岸养殖区PSP的现状分析,提出了养殖贝类质量安全相关监管意见。[中国渔业质量与标准,2017,7(2):30-35]
麻痹性贝类毒素;小鼠生物法;质量控制;监测;能力验证
近年来,随着近岸水体污染日益严重和生态环境的持续恶化,中国海域赤潮发生频率呈上升趋势,而且有毒赤潮记录也大幅上升[1],这不仅对渔业、滨海旅游业造成了严重的破坏,同时也对海洋生态系统以及人类健康产生影响[2-3]。海洋藻毒素是由海洋中的有毒赤潮藻类通过食物链传递给藻食性的鱼、虾及贝类等生物,并在其体内蓄积形成的有毒高分子化合物[4-5],人类食用了含有藻毒素的海产品时可能会引起中毒,严重可致其死亡[6]。赤潮毒素中的麻痹性贝类毒素(paralytic shellfish poisoning,PSP)因对人类危害严重而受到广泛关注,已成为全球水产养殖业和海洋食品进出口部门的重点检测对象。现已证实亚历山大藻(Alexandrium)、膝沟藻属(Gonyaularx)、原甲藻属(Prorocentrum)等甲藻是PSP的直接生产者[7]。PSP具有毒性大、中毒范围广、反应快等特点,其毒性与河豚毒素相当[8]。
贝类产品面临着很大的PSP污染风险,因此在赤潮研究中也倍受重视。近30年来,随着各项生物技术和化学分析技术的发展和成熟,对麻痹性贝毒的相关检测技术研究也越来越深入,并逐渐形成了小鼠生物测定法(MBA)[9]、化学仪器分析法(如HPLC法)[10]和免疫化学分析法(如ELISA法)[11]等成熟的检测方法。然而,HPLC方法存在PSP分析标准品普遍缺乏,而且PSP类似物相互转化,干扰检测结果,最终影响对总毒性的判断。ELISA法由于往往只针对主要成分建立抗体,而对其他成分的敏感性较低,在一定程度上影响了结果的准确性,而且检测试剂盒成本高,开展检测有困难。在诸多方法中,小鼠生物测定法(MBA)作为PSP的半定量分析方法,具有可靠性强、表达毒性直接、使用广泛等优点,是目前唯一国际大多数国家普遍接受的方法[12-18],也被美国公职分析化学家协会(AOAC)推广为PSP的标准检测方法。AOAC定义一个鼠单位为给予20 g小鼠注射1 mL贝类提取物,使其在15 min内致死的最小剂量。
为进一步加强水产品质检机构贝类毒素检测能力建设,全面提高质检机构整体素质和技术水平,确保贝类毒素监测结果的有效性和可信性,很有必要去建立和规范快速准确的PSP检测方法。本研究采用MBA检测贝类样品中的PSP,并结合2010—2016年农业部渔业渔政管理局组织的能力验证考核结果,总结了MBA快速准确检测PSP的实验室规范要求、影响因素及操作要点等。同时对浙江沿岸海域养殖区采集的贝类样品进行PSP应急监测分析,得到了贝类产品中PSP的污染含量,了解和掌握浙江沿岸养殖贝类质量安全状况,以期为深入开展有害赤潮毒素的研究提供参考。
1 材料与方法
1.1 主要仪器、试剂及实验小鼠
主要仪器及耗材:均质器(型号SQ2119N,上海帅佳电子科技有限公司);高速离心机(型号Centrifuge 5810,德国Eppendorf公司);电子天平(型号JY6001,上海民桥精密科学仪器有限公司);1 mL注射器;秒表等。
主要试剂:0.1和5.0 mol /L盐酸溶液,0.1 mol/L氢氧化钠溶液,pH试纸0.5~5,实验用水为去离子水。以上试剂均为国药集团化学试剂有限公司生产。
实验小鼠为ICR级雄性小鼠,重量在18~22 g,从浙江省实验动物中心购买。
1.2 小鼠生物测定法
1.2.1 PSP的制备
用清水将贝类外壳洗净,挑出贝肉,并用清水去除泥沙及其他杂质。收集100 g贝肉置于均质杯内,均质2 min后,加入100 mL 0.1 mol /L盐酸中充分搅拌,调节pH至2.0~4.0。徐徐煮沸5 min,充分提取贝肉中PSP毒素;冷却至室温,调节pH至2.0~4.0。将混合物移至量筒中,并稀释至200 mL。然后把混合物倒回烧杯,搅拌至均质状,使其沉降至上清液呈半透明状,不会堵塞注射针头即可,必要时可将混合物或上清液以3 000 r/min离心5 min,或用滤纸过滤。保留进行小鼠注射用的足量液体,如不能及时注射,需冰箱冷藏。
1.2.2 注射与测定
将上清提取液按每只小鼠1 mL注射量分别对3只实验小鼠进行腹腔注射,记录小鼠死亡时间。若小鼠的死亡时间大于60 min,则待测样品的鼠单位即相当于小于0.875 MU;若小鼠的死亡时间小于5 min,则要稀释样品提取液再注射另一组小鼠3只,直至其死亡时间为5~7 min。最后,根据小鼠死亡时间,查“PSP死亡时间-鼠单位的关系表”和“小鼠体重校正表”,计算得出100 g贝肉中含PSP的鼠单位值[19]。PSP的含量按公式(1)计算。
式(1)
式(1)中:X为样品中PSP含量,MU/100g;ki为每只小鼠的重量校正系数;Mi为每只小鼠的鼠单位数,MU;D为样品提取液的稀释倍数;i为每组小鼠的数量;200为样品量,g。
注射前需先将小鼠做好标记。在抽取时切勿使针管的针头堵塞,并保证针管中无气泡,然后将试液注射到小鼠腹腔中,详见图1。在对小鼠进行腹腔注射时,若有一滴以上提取液溢出,需将该只小鼠丢弃,并重新注射一只小鼠。
图1 样品提取液注射(a)和实验小鼠标记(b)Fig.1 Sample extract injection (a) and experimental mouse markers (b)
1.3 毒性大小观察及记时
将注射完的小鼠放入无菌通风笼具中,平放于实验台面,并用秒表记录时间。实验开始时间以注射完1 mL提取液时间为准。仔细观察小鼠存活状态,直至小鼠呼出最后一口气为止(图2),用计时器记录小鼠停止呼吸时的死亡时间,即结束时间。小鼠注射含PSP的提取液后反应剧烈,出现运动速率加快并伴有弹跳等症状,且致死时间短。

图2 毒素注射后小鼠最初状态(a)及致死反应(b)Fig.2 The initial state (a) and death reaction (b) of mice after injection of toxins
2 结果与讨论
2.1 小鼠生物法建立及优化
2.1.1 动物实验室操作规范要求
PSP小鼠生物法实验必须实施优良实验室操作规范(good laboratory practice,GLP)。GLP实验室的正常运行人员素质是关键,实验设施是基础,标准操作规程(SOP)是手段,质量监督是保证;硬件是外壳,软件是核心。只有推进GLP规范,才能做到动物实验的规范化。按相应标准和规范对实验动物饲料、饮水、设施、环境质量进行有效的调控,保证给予实验动物舒适的生活环境和待遇,维持实验动物的质量标准;以合理的设计、周密的安排、熟练的技能开展动物实验,并对动物的行为、表现、反应进行细致的观察和记录,保证实验结果有高度的可靠性和重复性。
2.1.2 环境因素对小鼠生物法实验的影响
小鼠生物法实验结果受多种环境因素影响,如温度、湿度、气流、光照及噪声等。
1)温度
实验小鼠的最适宜温度20~26 ℃,最大日温差≤4 ℃[20]。环境温度不同,常使动物实验出现差异。比如在小鼠急性毒理实验中,LD50(mg/kg) 在15.5 ℃时值为111.0,在27.0 ℃时则为33.2[21],结果完全不同。
2)湿度
屏障系统内相对湿度应控制在40%~70%之间[20],长期饲养相对湿度应在(50±5)%范围最佳[22]。相对湿度过高或者过低时,会导致实验小鼠新陈代谢等生理功能紊乱,抵抗力降低,烦躁异常,进而影响实验结果[23]。
3)气流与风速
气流与风速影响动物机体的散热。在气温较高环境下,气流有助于对流散热,有利于实验小鼠降温;但在较低温度下,随风速的增加实验小鼠体温明显下降。通常,屏障系统在适宜温度时,气流控制在0.25 m/s以下。
4)光照及噪声
光照通过影响小鼠的活动和一般行为来影响实验结果[24],通常在10~20 lx (动物照度)或150~300 lx (工作照度)比较适中。噪声能引起实验小鼠生理功能异常,表现为神经功能紊乱、烦躁不安、呼吸和心跳加快、血压升高等症状。通常实验环境要求控制在40~50 dB以下。
以上多种因素相互影响相互作用,对小鼠实验的影响往往是多种因素联合作用的结果。因此,在PSP小鼠生物法实验中要积极有效地去平衡和控制上述环境因素,让其在屏障系统内形成良性循环,以保证实验动物处于正常的生理状态,以期提供更为准确、可靠的实验数据。
2.1.3 PSP小鼠生物法检测操作要点
不同品系小鼠,例如BALB/c小鼠和ICR小鼠,对PSP的敏感性不同。而国内用小鼠生物法检测PSP时,多用ICR小鼠,这保证了实验结果的一致性和对比性。将提取液加热时,应徐徐煮沸5 min,切勿加热时间过长。因为在酸性环境中加热时,有可能促使N-磺酰氨甲酰基类毒素转变成相应的氨基甲酸酯类毒素,导致毒性增大而出现实验结果偏差。稀释提取液时,要逐滴加入0.1或0.01 mol/L盐酸溶液,缓慢调节pH至2.0~4.0。另外,在用NaOH溶液调整pH时,滴加速度要缓慢,同时需不断搅拌,防止局部碱化破坏毒素;而且NaCl的含量也会影响毒性的测定,1%含量的NaCl可使毒性降低一半,最终导致小鼠死亡时间延长,出现结果偏差,因此应控制NaOH溶液用量,确保实验结果真实可靠。
2.2 能力验证
为进一步加强水产品质检机构能力建设,全面提高质检机构整体素质和技术水平,受农业部渔业渔政管理局委托,中国水产科学研究院于2010年8月至2016年6月开展了7次PSP检测能力验证工作。本实验室参加以上能力验证的考核,并参加2010年11月国家认监委组织的CNCA-10-B04麻痹性贝类毒素(PSP)检测能力验证考核。考核结果详见表1。
具体评价标准为:对检测结果的对数值按Z比分数法统计,︱Z︱≤2的判定为满意结果,2<︱Z︱<3的判定为可疑结果,︱Z︱≥3的判定为不满意或离群结果。由表1可见,本实验室参加农业部组织的麻痹性贝类毒素(PSP)检测能力验证考核和国家认监委组织的CNCA-10-B04麻痹性贝类毒素(PSP)检测能力验证考核,均为满意结果。

表1 麻痹性贝类毒素检测能力验证结果Tab.1 Results of shellfish toxin detection ability verification n=3
注:—表示考核结果没有体现z-比分数。
2.3 贝类样品应急检测
2011年5月下旬浙江省沿海海域发生赤潮,大量的养殖鱼类、贝类和海洋生物发生死亡。本实验室于5月下旬和6月初对温州、台州、舟山等贝类养殖海域的贻贝进行采集,并进行PSP3个批次的应急检测,检测结果见表2。
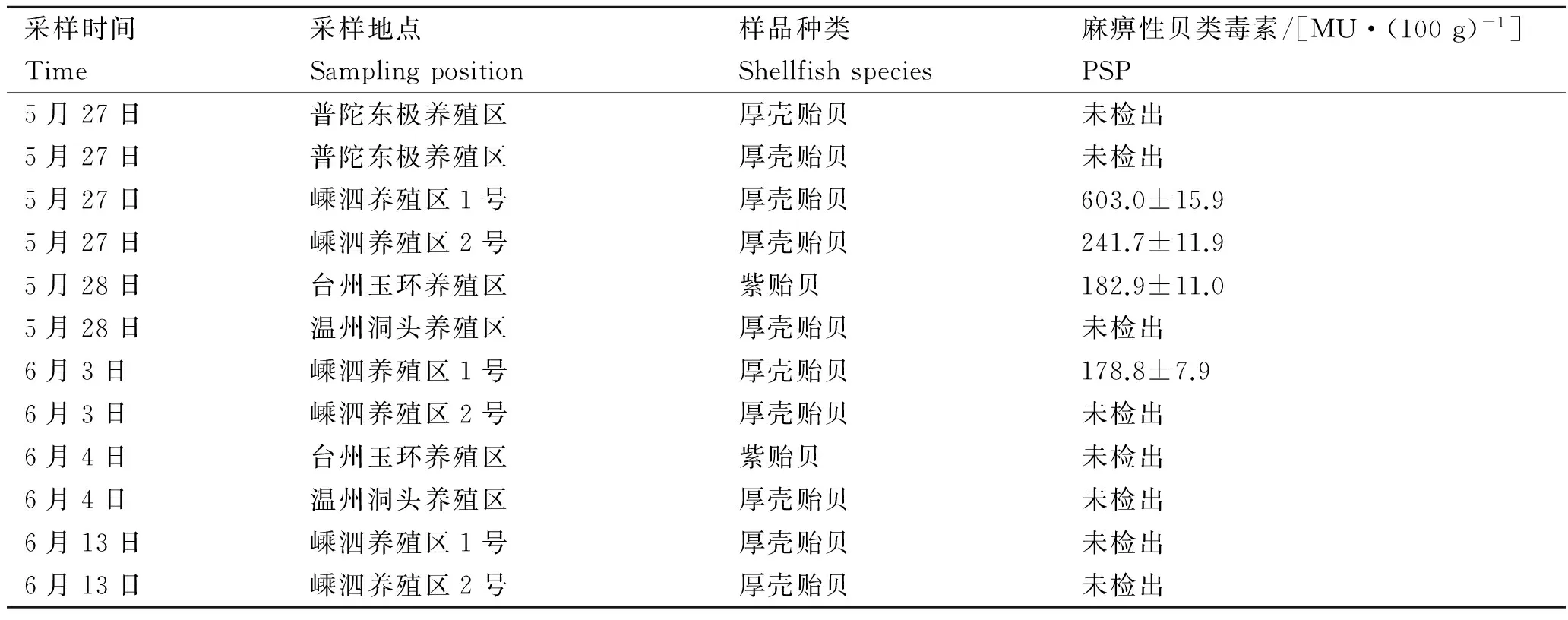
表2 贝类毒素应急样品检测结果Tab.2 Test results of shellfish toxin emergency samples n=3
通过表2检测结果可知,浙江沿岸养殖区域所采集的贝类中,一些贝类其体内保存或积累了一定量的PSP,其中在嵊泗、台州所采集的贻贝中有检出,而且嵊泗一个点采集的贝类中PSP的含量大于400 MU/100 g,超出了农渔发〔2016〕8号文件要求的限量标准(限量值为80 μg/100 g,即400 MU/100 g)。从表2中可以看出,相比5月采集的贝类,6月初检测的贝类样品中PSP的检出率和检出值均有所下降,说明赤潮发生时对贝类富集PSP有很大影响。因此,一旦发生赤潮等情况,就必须关闭养殖场,同时对已收获的养殖贝类进行暂养或净化处理,直到贝类的品质适于食用后才能上市销售。PSP对养殖业的影响不仅限于对养殖业本身,还易造成人们对贝类消费的恐慌,一旦发生贝类中毒事件,贝类消费将迅速下降,而且在很长时间内难以恢复。因此,为了有效防止PSP对养殖业和公众健康的影响,就必须建立起完善的监测体系,包括对有毒赤潮的监控和养殖贝类产品毒素的监测,同时建立进口贝类的市场准入制度。另外有关部门需加强对贝类养殖区产品及环境的监控,保护好当地的养殖环境,促进贝类养殖业可持续发展。
3 小结
本研究采用小鼠生物法检测贝类中的PSP,梳理了实验必须实施的优良实验室操作规范,总结了温度、湿度、气流、光照及噪声等环境因素对小鼠实验的影响,及多种因素联合作用。在PSP小鼠生物法实验中要积极有效地去平衡和控制环境因素,让其在屏障系统内形成良性循环,以保证实验动物处于正常的生理状态,以期提供更为准确、可靠的实验数据。本实验室在农业部渔业渔政管理局组织的麻痹性贝类毒素(PSP)检测能力验证考核和国家认监委组织的CNCA-10-B04麻痹性贝类毒素(PSP)检测能力验证考核中,考核结果均为满意。对浙江沿岸海域养殖区采集的贝类样品进行PSP应急监测分析,结果表明,赤潮发生时对贝类富集PSP有很大影响。本研究为采用小鼠生物法检测贝类中的PSP提供技术支持。
[1] 陆斗定, Gobel J, 王春生, 等. 浙江海区赤潮生物监测与赤潮实时预测[J]. 海洋学研究, 2000, 18(2): 33-42.
[2] 黄奕雯. ELISA法与小白鼠生物法检测麻痹性贝类毒素的研究[J]. 福建农业科技, 2012, 38(2): 47-51.
[3] 林燕堂, 杨美兰, 陈瑞雯. 广东沿海麻痹性贝毒的研究[J]. 海洋与湖沼, 1994, 25(2): 221-225.
[4] 郑淑贞, 林晓. 麻痹性贝毒[J]. 广州化学, 1995 (2): 39-43.
[5] 丁君. 赤潮毒素中腹泻性贝毒和麻痹性贝毒的研究及进展[J]. 大连水产学院学报, 2001, 16(3): 212-218.
[6] 江天久, 尹伊伟, 骆育敏, 等. 大亚湾和大鹏湾麻痹性贝娄毒素[J]. 海洋环境科学, 2000, 19(2): 1-5.
[7] Sommer H, Whedon W F, Kofoid C A, et a1. Relation of paralytic shellfish poison to certain plankton organisms of the genus Gonyanlax [J]. Arch Pathol, 1937,24: 537-559.
[8] 林健, 黄宗锈, 陈冠敏, 等. ICR和昆明种小鼠生物法检测麻痹性贝类毒素毒性差异比较[J]. 现代预防医学, 2011, 38(23): 4937-4942.
[9] 中华人民共和国卫生部,中国国家标准化管理委员会. GB/T 5009. 213—2008 贝类中麻痹性贝类毒素的测定[S]. 北京: 中国标准出版社, 2008.
[10] 中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会. GB/T 23 215—2008 贝类中多种麻痹性贝类毒素含量的测定-液相色谱-荧光检测法[S]. 北京: 中国标准出版社, 2009.
[11] 中华人民共和国国家质量监督检验检疫总局. SN/T 1773—2006 进出口贝类中麻痹性贝类毒素检验方法-酶联免疫吸附试验法[S]. 北京: 中国标准出版社, 2006.
[12] Sommer H, Meyer K F. Paralytic shellfish poisoning [J]. Arch Pathol, 1937, 24: 560-598.
[13] Ravn H. Toxicological and chemical aspects of paralytic shellfish poisoning (PSP) [J]. Vigo: Intergovernmental Oceanographic Commission of UNESCO, 1995:558.
[14] Boyer G L, Janiszewski J J. A comparison of electrochemical methods for the HPLC analysis of PSP toxins[C]//VIII International conference on Harmful algae-Abstracts and Posters Classification, 1997.
[15] Carlson R E, Lever M L, Lee B W, et al. Development of immunoassays for paralytic shellfish poisoning[M]. Washington, DC: American Chemical Society, 1984.
[16] Kralovec J A, Laycock M V, Richards R, et al. Immobilization of small molecules on solid matrices: a novel approach to enzyme-linked immunosorbent assay screening for saxitoxin and evaluation of anti-saxitoxin antibodies [J]. Toxicon, 1996, 34(10): 1127-1140.
[17] White A W, Anraku M, Hoot K K. Standard mouse bioassay for paralytic shellfish toxins [C]//Toxic Red Tides and Shellfish Toxicity in Southeast Asia.Philippines:ICLARM, 1984: 129-131.
[18] Vieytes M R, Cabado A G, Alfonso A, et al. Solid-phase radioreceptor assay for paralytic shellfish toxins[J]. Anal Biochem, 1993, 211(1): 87-93.
[19] 中华人民共和国农业部. SC/T 3023—2004 麻痹性贝类毒素的测定 生物法[S]. 北京: 中国标准出版社, 2004.
[20] 中华人民共和国国家质量监督检验检疫总局. GB 14925—2010 实验动物-环境及设施[S]. 北京: 中国标准出版社, 2010.
[21] 钟品仁. 哺乳类实验动物[M]. 北京: 人民卫生出版社, 1983:72-79.
[22] 寇举, 张来宾, 胡士鹏, 等. 屏障系统环境因素对实验动物的影响[J]. 畜牧与饲料科学, 2016, 37 (1): 30-31.
[23] 高振, 阿地力江, 哈木拉提. 干燥寒冷环境对小鼠生物表征的影响[J]. 科技导报, 2008, 26(14): 84-87.
[24] 山内忠平. 实验动物的环境与管理[M]. 沈德余, 译. 上海: 上海科学普及出版社, 1989.
Investigation and application of mouse bioassay in the determination of paralyticshellfish poisoning
ZHU Jingping, JIN Lei, ZHANG Xiaojun, CHEN Yu, GU Beiqiao*, MEI Guangming
(Marine Fisheries Research Institute of Zhejiang Province, Fishery Environment and Aquatic Product Quality Supervision Testing Center (Zhoushan), Key Lab of Mariculture and Enhancement of Zhejiang Province, Zhoushan 316021, China)
In order to ensure the effectiveness and credibility of monitoring results of shellfish poison, and establish and regulate accurate, rapid detection methods of paralytic shellfish poisoning (PSP), the study summarized the good laboratory practice, influencing factors and operation points in MBA experiment. Three batches of shellfish samples collected from the coast of Zhejiang were detected using MBA. The results showed that red tides had a significant impact on PSP enrichment of shellfish. In addition, through the status analysis of PSP in the coast of Zhejiang, supervision opinion was suggested on the quality and safety of cultivated shellfish. [Chinese Fishery Quality and Standards, 2017, 7(2):30-35]
PSP; mouse bioassay; quality control; monitoring; proficiency testing
GU Beiqiao, gbq@zjou.edu.cn
10.3969/j.issn.2095-1833.2017.02.006
2016-09-30;接收日期:2016-11-28
浙江省科技计划项目(2017F10018,2016C32074,2016F30020,2016F30022)
朱敬萍(1960-),女,高级工程师,研究方向为水域环境及食品安全研究,ZJP669888@163.com 通信作者:顾蓓乔,工程师,研究方向为水域环境及食品加工,gbq@zjou.edu.cn
S91
A
2095-1833(2017)02-0030-06

