水产品中庆大霉素直接竞争酶联免疫吸附测定法的建立
王强,王旭峰,赵东豪,黄珂,古小莉,李刘冬
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(广州),农业部渔业环境及水产品质量监督检验测试中心(广州),广东 广州 510300)
水产品中庆大霉素直接竞争酶联免疫吸附测定法的建立
王强,王旭峰,赵东豪,黄珂,古小莉,李刘冬*
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(广州),农业部渔业环境及水产品质量监督检验测试中心(广州),广东 广州 510300)
建立了测定水产品中庆大霉素(GM)残留的直接竞争酶联免疫吸附测定法(dcELISA),为进一步开发商业化的ELISA试剂盒提供技术支持。通过碳二亚胺法和戊二醛法分别制备了免疫原GM-KLH和包被原GM-OVA,经动物免疫后获取的多克隆抗体与辣根过氧化物酶偶联制备酶标抗体GM-PAb-HRP。优化确立了dcELISA最佳检测条件:包被原质量浓度0.2 μg/mL,GM-PAb-HRP稀释度1/3 200,抗体反应时间40 min,缓冲液为PBS(pH 8.0,10 mmol/L)。该方法的半抑制浓度(IC50)为0.99 μg/L,定量检测线性范围为0.27~3.64 μg/L。水产样品加标回收率为77.7%~104.5%,RSD为6.7%~13.2%,最低检测限为2.0 μg/kg。该方法可用于水产品中庆大霉素残留的快速测定,为食品安全风险监测提供一种有效的技术手段。[中国渔业质量与标准,2017,7(2):36-42]
庆大霉素;酶联免疫吸附法;抗体;水产品;残留;检测
庆大霉素(gentamicin,GM)是畜牧水产行业中常用的一种氨基糖苷类抗生素(aminoglycosides,AGs),常被添加到饲料中用于预防疾病和促进动物生长,其主要作用于革兰氏阴性菌,抗菌谱较广,能效抑制细菌的生长和繁殖[1-3]。研究表明,GM代谢缓慢,长期使用容易诱导致病菌对其耐药性增强,且该物质具有显著的耳毒性和肾毒性作用,其在动物源性食品中的残留对消费者的健康带来潜在的严重危害[4-6]。目前,中国农业部规定其在动物性食品的不同组织中的最高残留限量(MRL)范围为100~5 000 μg/kg,牛奶中的MRL为200 μg/kg[7],而欧盟委员会(EU)规定庆大霉素在动物肌肉组织中和牛奶中的MRL分别为50和100 μg/kg[8]。
微生物抑制法是分析庆大霉素的传统方法[9],检测成本低,但稳定性较差,耗时长[10]。GM易溶于水,极性大,比较适用于液相色谱分析[11-12]。由于其分子结构中不含有共轭双键,缺少发色基团,仅具有较弱的末端吸收,为了提高检测灵敏度和改善分析效果,常常在液相色谱柱前或柱后对其进行衍生化,操作相对复杂[13-14]。而液相色谱-质谱联用法测定GM时具有较高的灵敏度,且其分析结果专属性强,可以避免复杂样品基质的干扰[15-17]。现行国标检测方法主要依据GB/T 21323—2007 动物组织中氨基糖苷类药物残留量的测定高效液相色谱-质谱质谱法[18],该方法针对动物内脏、肌肉和水产品中GM的检测限为20 μg/kg,但其分离过程需采用离子对色谱模式,对质谱检测器造成潜在的污染和离子抑制作用[19]。
近年来,中国农业和食品药品等相关行政监管部门不断加强兽药抗生素残留的风险评估,逐步推进快速筛查机制的建立[20-21]。而基于抗原抗体反应的酶联免疫吸附测定法(ELISA)等快速免疫分析方法,拥有灵敏度好、特异性高、操作简便及检测成本低等特点,已经逐渐应用于复杂基质样品的高通量检测[22-23]。Chen等[24]建立了ELISA用于测定猪肌肉、肝脏和肾脏中的GM,方法加标回收率为64.7%~101.2%,最低检测限为2.7~6.2 μg/kg。许耀心等[8]制备了庆大霉素多克隆抗体,ELISA标准曲线优化后的IC50为2.954 ng/mL,该方法一抗和二抗反应均需孵育1 h,没有进行实际样品的加标回收测定。相比于传统的间接竞争ELISA,直接竞争酶联免疫吸附测定法(dcELISA)反应模式所需的步骤较少(加样及酶标抗体→孵育→洗板→显色→终止),大大缩短了样品检测工作的时间,更适用于水产品市场流通环节的快速筛查。目前,关于快速测定水产品中GM残留量的dcELISA方法尚不成熟,本研究通过制备GM特异性酶标抗体,优化确定各反应条件,建立快速、灵敏的测定水产品中庆大霉素残留的dcELISA,为进一步自主开发快速、简便的ELISA试剂盒提供技术支持。
1 材料与方法
1.1 仪器与试剂
VersaMax酶标仪和MultiWash Ⅲ 洗板机(美国Molecular Devices公司);Biofuge Stratos台式高速冷冻离心机(美国Thermo公司);MS3漩涡混合器(德国IKA公司);电子天平(瑞士梅特勒公司)。
庆大霉素、卡那霉素、安普霉素、新霉素、链霉素、碳二亚胺盐酸盐(EDC)、钥孔血蓝蛋白(KLH)、卵清蛋白(OVA)、辣根过氧化物酶(HRP)、弗氏完全与不完全佐剂均购于美国Sigma公司;羊抗兔IgG-HRP抗体购于武汉博士德生物工程有限公司;戊二醛(50%)购于山东西亚化学工业有限公司;辛酸、硫酸铵和过碘酸钠(分析纯),均购于广州化学试剂厂。
鲜活水产品:草鱼(Ctenopharyngodonidellus)、对虾(Penaeusvannamei)、罗非鱼(Oreochromisniloticus)和鲫(Carassiusauratus),均购于广州市农贸市场。
1.2 实验方法
1.2.1 人工抗原制备及鉴定
免疫原GM-KLH:取20 mg GM溶于1.5 mL水中,搅拌加入30 mg EDC,室温避光活化反应2 h;取10 mg KLH溶解于1.5 mL生理盐水(0.9% NaCl溶液)中,搅拌溶解后逐滴加入上述活化液,0~4 ℃下避光反应过夜;反应液经3 d透析处理后获得免疫原GM-KLH(图1),按照文献[24]方法对人工抗原进行鉴定,并将其分装于0.5 mL离心管中,置于-20 ℃冻存备用。
包被原GM-OVA:取20 mg GM和10 mg OVA溶于3 mL生理盐水中,搅拌下将戊二醛水溶液(20 μL戊二醛于0.5 mL水)逐滴加入上述混合液,室温下避光反应4 h;同上,透析处理后获得包被原GM-OVA(图1),鉴定及其他处理过程同GM-KLH。

图1 人工抗原GM-KLH和GM-OVA的合成路线Fig.1 Synthesis route of artificial antigen GM-KLH and GM-OVA
1.2.2 酶标抗体的制备
选取新西兰大白兔进行动物免疫,实验前取阴性血清作为对照[25]。首次免疫将GM-KLH(500 μg,按KLH含量计算)与弗氏完全佐剂乳化混合后,对兔子背部多点注射。之后每次间隔3周用等体积弗氏不完全佐剂乳化相同剂量的GM-KLH加强免疫。至抗血清效价不再增长后,心脏动脉取血,室温自然凝固分离抗血清,在4 ℃下放置过夜,4 000 r/min离心10 min后取上层血清,采用辛酸-硫酸铵法纯化处理适量抗血清。
采用过碘酸钠法[26]标记HRP制备酶标抗体。称取4 mg HRP溶于400 μL醋酸钠缓冲液(0.2 mol/L、pH 5.6)中,加入0.1 mol/L NaIO4溶液100 μL,4 ℃搅拌30 min,然后逐滴加入2.5%乙二醇400 μL,室温搅拌30 min;继续加入4 mg纯化抗体,混合搅拌30 min后置于碳酸盐缓冲液(0.1 mol/L、pH 9.6)中透析过夜;反应液中加入400 μL硼氢化钠溶液(5 mg/mL),4 ℃搅拌反应2 h后用PBS缓冲液(0.01 mol/L、pH 7.4)透析过夜;向反应液中加入硫酸铵,使其终浓度为0.277 g/mL(饱和度为45%),搅拌30 min,将所有反应液的沉淀溶于500 μL PBS缓冲液,4 ℃透析过夜后,收集袋中剩余液体即为酶标抗体GM-PAb-HRP,加入等体积的甘油后于-20 ℃分装保存。
1.2.3 棋盘滴定法
用包被缓冲液(pH 9.6,100 mmol/L碳酸盐缓冲液)将包被原GM-OVA倍比稀释至1.0、0.5、0.2和0.1 μg/mL,每孔100 μL分别在酶标板上进行包被。dcELISA的操作过程参照文献[26]所述,实验时用PBS缓冲液将酶标抗体GM-PAb-HRP从1/200倍比稀释至1/25 600,分别测定添加50 μL GM标准液(0.1 μg/mL)和50 μL PBS缓冲液(无药物竞争)时的吸光度(A450),比较不同包被浓度和抗体稀释度下dcELISA的反应抑制率。
1.2.4 检测条件的优化及特异性分析
称取适量的氨基糖苷类药物标准品,分别用水溶解后制备成500 μg/mL的单标储备液。实验时用PBS缓冲液稀释成系列浓度的标准工作液进行dcELISA检测,通过OriginPro8.5软件拟合,获取不同反应条件下竞争标准曲线的半抑制浓度(IC50)和酶标仪450 nm处的最大吸光值(maximal absorbance,Amax),优化确定dcELISA最佳酶标抗体反应时间,以及PBS缓冲液最适的pH和离子强度[27]。在同等的dcELISA条件下,通过计算庆大霉素与其他化合物IC50的比值的百分比,获取的该研究的交叉反应率(CR),交叉反应率越低,特异性越好。
1.2.5 样品检测
将草鱼、罗非鱼和鲫去鳞、去皮,取背脊两侧肌肉,对虾去壳、去头尾,取可食肌肉部分,切成小块后用绞肉机制成肉糜状[28],试样按照GB/T 21323—2007方法[18]测定后未检出庆大霉素。准确称取试样(2.00±0.02)g,置于50 mL塑料离心管中,分别添加5、10和30 μg/kg 3个水平的庆大霉素药物标准液,每个浓度水平进行5次平行实验。向每个样品中加入10 mL 3%三氯乙酸溶液,均质器匀浆处理约1 min,充分漩涡振荡提取5 min,以4 000 r/min离心10 min。取2 mL上清液于一个新塑料离心管中,用1 mol/L NaOH调节pH至7.4左右,进一步用PBS缓冲液定容至10 mL,取50 μL直接用于dcELISA检测。
2 结果与讨论
2.1 抗体和包被原浓度的选择
庆大霉素属于有机小分子物质(分子量小于1 000 Da),本身不具有没有免疫原性,只有将其与大分子载体(如蛋白质)偶联制备成人工抗原,才能刺激动物体产生特异性免疫应答。本研究采用碳二亚胺法将GM与KLH偶联,制备了免疫原GM-KLH,为降低免疫反应非特异性吸附,采用戊二醛法将GM与分子量较小的OVA偶联制备包被原GM-OVA。
获取的抗血清纯化处理后,经过碘酸钠法与HRP偶联,制备了酶标抗体GM-PAb-HRP。采用棋盘滴定法对包被原GM-OVA的浓度和GM-PAb-HRP的稀释倍数进行选择,根据不同包被浓度和抗体稀释倍数下dcELISA的A450值,测算抑制率。结果显示(表1),当包被原浓度为0.2 μg/mL,酶标抗体稀释倍数3 200时,此时dcELISA的A450值在1.2左右,且空白背景值较低,此时加入50 μL GM标准液(0.1 μg/mL)抑制率达85.3%,抗体特异性显著,可以满足进一步的dcELISA优化实验。
2.2 免疫反应时间的确定
抗原和抗体之间的结合属于动态可逆反应,为获取更高的检测灵敏度,需要选择酶标抗体与抗原最佳的竞争反应时间。将待测标准品和酶标抗体溶液加入微孔板后,比较不同反应时间下的标准曲线的Amax、IC50值以及其比值Amax/IC50的变化。结果显示(图2),随着反应时间的增加(20~40 min),Amax逐渐升高,IC50值不断下降;进一步增加反应时间至50 min,Amax趋于稳定,IC50值不再降低;反应时间为40 min时,曲线的Amax/IC50最大,本研究的抗体竞争反应时间为40 min。
2.3 缓冲液pH对反应的影响
反应体系的pH可以影响待测药物的溶解度,进而影响抗原抗体之间的相互作用。配制不同pH(5.5~9.0)的PBS缓冲液作为药物稀释液,分别绘制dcELISA标准曲线。结果显示(图3),Amax随着pH的增加不断增大,pH>7后趋于稳定。pH为8.0时显示了最低的IC50值,且此时曲线的Amax/IC50最大,因此反应缓冲体系的最佳pH为8.0。
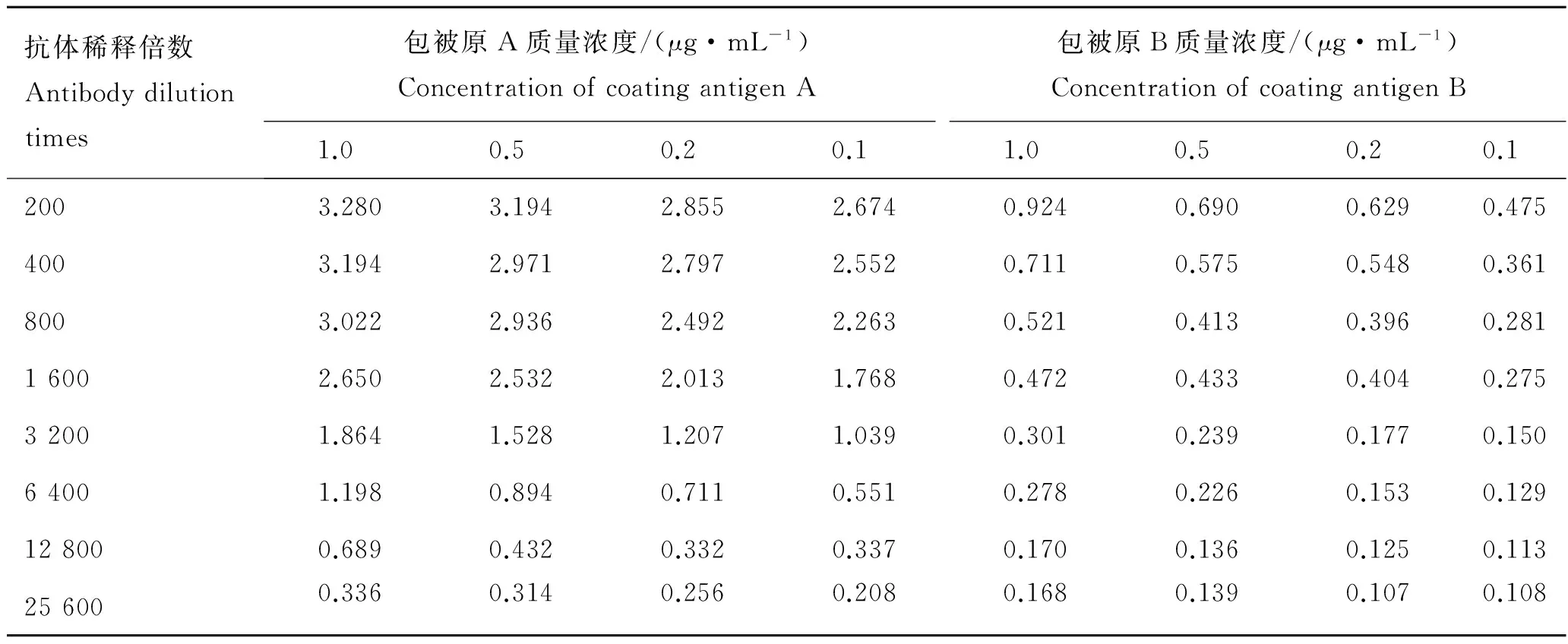
表1 棋盘滴定实验的A450值Tab.1 A450 values of chessboard titration experiment
注:包被原A为50 μL PBS +50 μL GM-PAb-HRP,包被原B为50 μL 药物标准液(0.1 μg·mL-1)+50 μL GM-PAb-HRP。
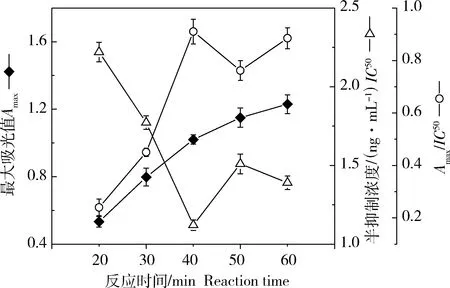
图2 反应时间对dcELISA的影响Fig.2 The influence of reaction time on dcELISA

图3 pH对dcELISA的影响Fig.3 The influence of pH on dcELISA
2.4 缓冲液离子强度的优化
缓冲溶液的离子浓度通常会影响抗体和酶的活性,是建立免疫分析法的一个重要因素[29]。考察了不同离子浓度(5~40 mmol/L)的PBS缓冲液对所建立dcELISA灵敏度的影响,结果表明(图4),随着离子浓度的增加,Amax不断下降,IC50值先下降后升高。离子浓度为10 mmol/L时IC50值最低,曲线的Amax/IC50最大,此时Amax为1.239,显示了最优的检测灵敏度。因此,缓冲液最优离子强度为10 mmol/L。
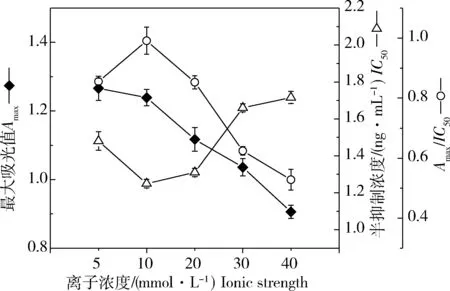
图4 离子浓度对dcELISA的影响Fig.4 The influence of ionic strength on dcELISA
2.5 标准曲线的建立
基于上述最优的反应条件,本研究建立了庆大霉素dcELISA标准曲线(图5),其IC50为0.99 μg/L,线性检测范围(IC20~IC80)为0.27~3.64 μg/L,定量范围相对较窄,对于高浓度样品的测定需要做进一步的稀释处理,检测时间可以控制在1 h以内。该方法最低检测限(LOD,IC10)为0.13 μg/L,低于GB/T 21323—2007所规定的液质联用法的检测限,具有较高的检测灵敏度。

图5 庆大霉素dcELISA标准曲线C为庆大霉素浓度,ug·L-1;B为添加药物时的吸光值,B0不添加药物时的吸光值。Fig.5 Standard curve of dcELISA for gentamicinThe C is gentamicin concentration,ug·L-1;B is the absorbance with analytes and B0 is the absorbance without analytes.
2.6 特异性分析
分别配制卡那霉素、安普霉素、新霉素和链霉素的标准品溶液,在同等条件下测定曲线的IC50值,计算交叉反应率(CR)。结果显示,该方法针对庆大霉素的特异性良好,与所考察的其他4种氨基糖苷类结构类似物的交叉反应率均小于0.1%(表2)。
2.7 回收率和精密度
庆大霉素易与样品中的组织成分结合,而鱼虾类水产品的可食肌肉组织中往往富含较多的蛋白质,因此样品提取时首先要除蛋白[19]。常用的蛋白质沉淀

表2 庆大霉素及其结构类似物的交叉反应率Tab.2 Cross-reactivity of gentamicin and its analogs
剂主要是有机溶剂(乙腈或甲醇)和强酸性溶液(三氯乙酸或高氯酸)。由于庆大霉素具有较高水溶性,在匀浆处理时使用强酸性溶液既可以除蛋白,同时可以促使目标物庆大霉素从样品组织中游离出来[30]。本研究选用3%三氯乙酸溶液作为提取溶剂,提取液调至中性并用PBS缓冲液稀释处理后用于dcELISA测定,进一步降低了样品的基质干扰。结果同时显示,用PBS缓冲液配制标准曲线校正检测结果时,低浓度的样品回收率偏高,可能是由于空白样品的A450值略低于使用空白缓冲液时的A450值。为保证样品的定量分析结果,分别使用相应的样品提取液配制基质匹配标准曲线,进行数据校正分析。结果如表3所示,4种水产品基质的加标回收率为77.7%~104.5%,相对标准偏差(RSD)为6.7%~13.2%,最低检测限为2.0 μg/kg,表明该方法准确度和精密度良好,满足水产品中痕量庆大霉素药物残留检测的要求。
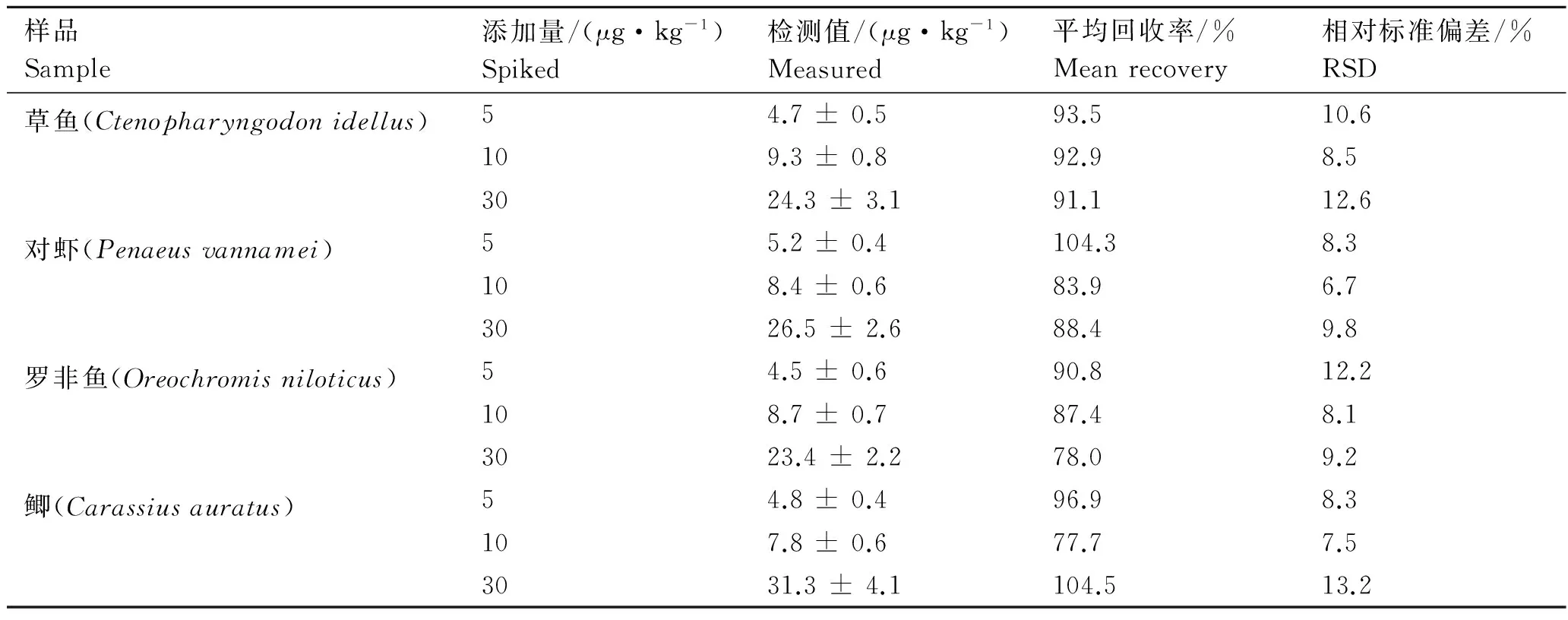
表3 水产品庆大霉素的添加回收率Tab.3 Recoveries of spiked aquatic product of gentamicin n=5
3 结论
本研究分别采用采用碳二亚胺法和戊二醛法制备了庆大霉素的免疫原和包被原,抗血清纯化处理后标记辣根过氧化酶获取酶标抗体GM-PAb-HRP,优化确定了dcELISA反应条件。该方法检测结果准确可靠,操作简便,检测时间少于1 h,与结构类似物的交叉反应率小于0.1%。样品经三氯乙酸溶液除蛋白提取,进一步缓冲液稀释处理后消除基质干扰,针对水产品中庆大霉素的最低检测限为2.0 μg/kg,为快速测定水产品中残留的庆大霉素提供一种有效的监测技术手段。
[1] 郭浩, 王燕飞, 邹明强, 等. 悬液芯片与常规酶联免疫吸附法检测庆大霉素残留的比较[J]. 食品科学, 2012, 33(20): 144-148.
[2] 王志兵, 高杨, 刘洋, 等. 微波辅助衍生-离子液体分散液液微萃取-高效液相色谱法检测牛奶中氨基糖苷类抗生素残留[J]. 现代食品科技, 2014, 30(4): 260-267.
[3] Tao Y, Chen D, Yu H, et al. Simultaneous determination of 15 aminoglycoside(s) residues in animal derived foods by automated solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2012, 135(2): 676-683.
[4] Kumar P, Rúbies A, Companyó R, et al. Determination of aminoglycoside residues in kidney and honey samples by hydrophilic interaction chromatography-tandem mass spectrometry[J]. J Sep Sci, 2012, 35(20): 2710-2717.
[5] 徐飞, 栗静雅, 周洁, 等. 可视化凝胶酶联免疫吸附分析法检测牛奶中庆大霉素和卡那霉素[J]. 分析化学, 2015, 43(6): 881-885.
[6] 龚强, 丁利, 朱绍华, 等. 高效液相色谱-串联质谱法检测乳制品中10种氨基糖苷类抗生素残留[J]. 色谱, 2012, 30(11): 1143-1147.
[7] 中华人民共和国农业部. 农业部第235号公告 动物性食品中兽药最高残留限量[S]. 北京:中国农业出版社, 2002.
[8] 许耀心, 龚云飞, 陈宗伦, 等. 庆大霉素人工抗原及多克隆抗体的制备与鉴定[J]. 现代食品科技, 2014, 30(6): 152-157,256.
[9] Montero A, Althaus R, Molina A, et al. Detection of antimicrobial agents by a specific microbiological method (Eclipse100®) for ewe milk[J]. Small Rumin Res, 2005, 57(2): 229-237.
[10] 马伟, 胥传来. 动物源食品中氨基糖苷类抗生素多残留免疫检测方法研究进展[J]. 食品科学, 2009, 30(11): 289-292.
[11] Al-amound A I, Clark B J, Chrystyn H. Determination of gentamicin in urine samples after inhalation by reversed-phase high-performance liquid chromatography using pre-column derivatisation with o-phthalaldehyde[J]. J Chromatogr B, 2002, 769(1): 89-95.
[12] Clarot I, Chaimbault P, Hasdenteufel F, et al. Determination of gentamicin sulfate and related compounds by high-performance liquid chromatography with evaporative light scattering detection[J]. J Chromatogr A, 2004, 1031(1): 281-287.
[13] Arsand J B, Jank L, Martins M T, et al. Determination of aminoglycoside residues in milk and muscle based on a simple and fast extraction procedure followed by liquid chromatography coupled to tandem mass spectrometry and time of flight massspectrometry[J]. Talanta, 2016, 154: 38-45.
[14] 刘雪红, 张秀芹, 侯颖, 等. 超高效液相色谱-串联质谱法检测牛奶中7种氨基糖苷类药物残留[J]. 中国兽药杂志, 2015, 49(3): 48-52.
[15] 高玲, 张丹, 高峰, 等. 水产品中氨基糖苷类药物残留的高效液相色谱-串联质谱检测方法研究[J]. 中国兽药杂志, 2012, 46(11): 27-30.
[16] Zhu W X, Yang J Z, Wei W, et al. Simultaneous determination of 13 aminoglycoside residues in foods of animal origin by liquid chromatography-electrospray ionization tandem mass spectrometry with two consecutive solid-phase extraction steps[J]. J Chromatogr A, 2008, 1207(1): 29-37.
[17] 苏晶, 汤立忠, 陈长毅, 等. 高效液相色谱串联质谱法同时测定9种龙虾中氨基糖苷类和四环素类抗生素残留[J]. 食品工业科技, 2016, 37(2): 60-63, 67.
[18] 中华人民共和国国家质量监督检验检疫总局. GB/T 21323—2007 动物组织中氨基糖苷类药物残留量的测定高效液相色谱-质谱质谱法[S]. 北京: 中国标准出版社, 2007.
[19] Alechaga E, Moyano E, Galceran M T. Mixed-mode liquid chromatography coupled to tandem mass spectrometry for the analysis of aminoglycosides in meat[J]. Anal Bioanal Chem, 2014, 406(20): 4941-53.
[20] 陈胜军, 李来好, 杨贤庆, 等. 我国水产品安全风险来源与风险评估研究进展[J]. 食品科学, 2015, 36(17): 300-304.
[21] 黄珂, 赵东豪, 杨宏亮, 等. 渔业环境及水产品中药物和个人护理用品(PPCPs)的研究进展[J]. 南方水产科学, 2016, 12 (3): 119-126.
[22] 职爱民, 李青梅, 刘庆堂, 等. 抗庆大霉素单克隆抗体的制备及其初步应用[J]. 中国农业科学, 2010, 43(12): 2584-2589.
[23] 金涌, 陈立本, 邹明强, 等. 庆大霉素单克隆抗体的制备及ELISA检测方法研究[J]. 中国兽医杂志, 2009, 45(8): 9-12.
[24] Chen Y, Shang Y, Li X, et al. Development of an enzyme-linked immunoassay for the detection of gentamicin in swine tissues[J]. Food Chem, 2008, 108(1): 304-309.
[25] Lei H T, Shen Y D, Song L J, et al. Hapten synthesis and antibody production for the development of a melamine immunoassay[J]. Anal Chim Acta, 2010, 665(1): 84-90.
[26] Xu Z L, Deng H, Deng X F, et al. Monitoring of organophosphorus pesticides in vegetables using monoclonal antibody-based direct competitive ELISA followed by HPLC-MS/MS[J]. Food Chem, 2012, 131(4): 1569-1576.
[27] Shi L, Feng H, Zhang P, et al. Synthesis of haptens and development of an indirect enzyme-linked immunosorbent assay for tris(2,3-dibromopropyl) isocyanurate[J]. Anal Biochem, 2014, 447: 15-22.
[28] 赵东豪, 黎智广, 王旭峰, 等. 高效液相色谱-串联质谱法检测水产品中硝基呋喃类代谢物的优化研究[J]. 南方水产科学, 2015, 11(6): 58-64.
[29] 王保玲, 袁利鹏, 雷红涛, 等. 沙丁胺醇直接竞争ELISA法快速测定[J]. 食品科学, 2010, 31(20): 270-274.
[30] Kaufmann A, Butcher P, Maden K. Determination of aminoglycoside residues by liquid chromatography and tandem mass spectrometry in a variety of matrices[J]. Anal Chim Acta, 2012, 711: 46-53.
Development of a direct competitive enzyme-linked immunosorbent assay forgentamicin in aquatic product
WANG Qiang, WANG Xufeng, ZHAO Donghao, HUANG Ke, GU Xiaoli, LI Liudong*
(South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Aquatic Product Processing, Ministry of Agriculture; Laboratory of Quality & Safety Risky Assessment for Aquatic Product on Storage and Preservation (Guangzhou); Fishery Environment and Aquatic Products Quality Inspection & Testing Center of the Ministry of Agriculture (Guangzhou),Guangzhou 510300, China)
A direct competitive enzyme-linked immunosorbent assay (dcELISA) was developed for rapid determination of gentamicin in aquatic product, which exhibited the potential to develop commercial ELISA kits. The immunogen (GM-KLH) and coating antigen (GM-OVA) were synthesized by the method of carbodiimide and glutaraldehyde, respectively. Then, the polyclonal antibody obtained was coupled to horseradish peroxidase for enzyme-labeled antibody (GM-PAb-HRP). The optimized dcELISA conditions were as follows: the dilution ratio of GM-PAb-HRP, 1/3 200; coating antigen concentration, 0.2 μg/mL; reaction time of antibody, 40 min; dilution solution, PBS (pH 8.0, 10 mmol/L). The half inhibition concentration (IC50) was 0.99 μg/L and the linear range (IC20-IC80) was 0.27~3.64 μg/L. Recoveries from spiked aquatic products were in the range of 77.7%~104.5%, with relative standard deviation ranging from 6.7% to 13.2%. The limit of detection (LOD) of the dcELISA for gentamicin in aquatic products was 2.0 μg/kg. The developed method was suitable for rapid determination of gentamicin residues in aquatic product, which would be a useful tool in regular risk monitoring program for food safety. [Chinese Fishery Quality and Standards, 2017, 7(2):36-42]
gentamicin; ELISA; antibody; aquatic product; residue; determination
LI Liudong, 168LLd@163.com
10.3969/j.issn.2095-1833.2017.02.007
2016-10-14;接收日期:2017-01-16
国家农产品质量安全风险评估重大专项(GJFP201501003);广东省水产品质量安全专项(GDSCZA2015009);中国水产科学研究院南海水产研究所基本科研业务费(2015TS17,2015TS18)
王强(1988-),男,硕士,助理研究员,研究方向为水产品检测与风险评估,546056407@qq.com 通信作者:李刘冬,研究员,研究方向为水产品检测与风险评估,168LLd@163.com
S94;O657.72
A
2095-1833(2017)02-0036-07

