槲皮素在实验性大鼠脑出血模型中的对抗炎症作用及细胞凋亡作用的研究
徐兰娟 易波 李保林
·基础研究·
槲皮素在实验性大鼠脑出血模型中的对抗炎症作用及细胞凋亡作用的研究
徐兰娟 易波 李保林
目的 探讨槲皮素对大鼠脑出血模型神经功能恢复的作用及可能机制。 方法 采用胶原酶法制作大鼠脑出血模型,随机分为假手术组、脑出血组、脑出血+槲皮素5mg/kg组和脑出血+槲皮素50mg/kg组。药物实验组通过腹腔注射槲皮素,通过实时定量聚合酶链式反应技术来检测脑组织提取物中的炎症指标及使用TUNEL法观察细胞凋亡情况。结果经过3 d最佳剂量(50 mg/kg)槲皮素的治疗,与脑出血组相比可以显著降低炎症因子的表达量及减少TUNEL阳性细胞的数量。 结论 槲皮素的最佳剂量的早期治疗通过抑制炎症反应和减少细胞凋亡,可以改善脑出血模型后的脑损伤,从而促进神经功能的恢复。
脑出血; 槲皮素; 炎症反应; 细胞凋亡
脑出血(intracerebral haemorrhage,ICH)是一种临床上常见的脑卒中亚型,具有较高的病死率,而存活的患者也常常遗留有严重的神经功能障碍[1]。有研究表明从1980年至2008年,ICH的发病率并未降低,总发病率为24.6/10万,且发病率随年龄的增长而增加[2]。目前,对ICH及其后遗症仍然缺乏有效的针对治疗。有研究证实ICH后在出血范围内的脑组织因为巨噬细胞和中性粒细胞及小胶质细胞的激活产生炎症反应形成脑水肿,进而导致神经细胞凋亡,影响ICH患者的预后[3]。因此,针对ICH后的炎症反应,槲皮素作为一种抗炎和抗氧化药物,可能具有潜在的治疗作用。槲皮素已经被证明了具有非常有效的抗氧化剂和细胞保护作用,可以阻止内皮细胞的凋亡[4]。目前对ICH后的炎症反应是否具有一定的作用还没有得到实验证明。本研究建立胶原酶法大鼠脑出血模型,经腹腔注射不同剂量的槲皮素,通过检测大鼠脑出血后的神经功能评分,脑组织水肿,脑组织炎症因子检测及细胞凋亡,来观察槲皮素针对ICH是否具有治疗作用。
材料与方法
一、实验材料与试剂
动物头颅立体定位仪 (美国Stoelting公司);10微升微量注射器(高鸽);图像分析系统(德国莱卡);槲皮素制剂(美国Sigma公司);VII型胶原酶(美国Sigma公司);RNA提取液Trizol试剂及PCR试剂盒(日本TaKaRa公司);TUNEL试剂盒 (德国Roche公司)。
二、动物分组及脑出血模型处理
雄性SD大鼠96只,体质量300~320 g,由维通利华公司提供。随机分为假手术组、脑出血组、脑出血+槲皮素5 mg/kg组和脑出血+槲皮素50 mg/kg组。每组24只,其中6只用于脑水肿检测,6只用于脑出血病灶体积测量,6只用于实时定量聚合酶链式反应技术(real-time quantitative polymerase chain reaction,RT-PCR)检测,6只用于TUNEL细胞凋亡检测。采用“脑内注入胶原酶法”制作大鼠脑出血模型。将3.6%水合氯醛麻醉处理好的大鼠置于动物头颅立体定位仪上,定位大鼠左侧尾状核区,将0.5单位的Ⅶ型胶原酶通过微量注射器注入大鼠左侧尾状核区,留针10min,缓慢拔出,使用骨蜡封闭颅骨钻孔,消毒手术区域,缝合头皮。所有大鼠脑出血模型制备完成后给予相同饲养条件。假手术组只打开头皮,不做其他处理,缝合头皮。脑出血+槲皮素5mg/kg组术后1 h给予腹腔注射5mg/kg剂量槲皮素;脑出血+槲皮素50mg/kg组术后1 h给予腹腔注射50mg/kg剂量槲皮素;假手术组和脑出血组术后1 h经腹腔注入等量生理盐水。各组每12 h给药1次,连续3 d。
三、神经功能评分标准
使用双盲法,参照改良大鼠神经功能缺损评分(modified neurological severity score,mNSS)标准:在大鼠脑出血模型制作完成及在处死各组大鼠之前进行mNSS评分。包括运动试验,感觉试验,反射丧失和不正常运动及癫痫、肌阵挛、肌张力障碍4个方面进行行为学评分。最高值18分,1~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。在模型制作完成时观察到大鼠评分>7分表示模型制作成功,入选本实验。本实验96只大鼠中在模型制作过程中死亡或神经功能缺损评分未达到7分共5只,均在实验过程中补充完整。
四、脑水肿测定
大鼠脑出血模型建立3 d后,3.6%水合氯醛麻醉,快速取出大鼠全脑,使用电子天平称取大脑标本湿重,将标本放入160℃烤箱中48 h后称取干重。脑组织水含量测定=(湿重-干重)/湿重×100%。
五、出血量病灶体积测定
大鼠脑出血后3 d,多聚甲醛灌注大鼠固定后,在冠状面连续切片(厚度20mm),测量出血区最大切面的长和宽。血肿体积计算公式为:总病灶体积(mm3)=1/2×A×B×C(A代表血肿长径、B代表血肿的宽径、C代表血肿的层数)。
六、RT-PCR检测炎症因子
通过RT-PCR检测脑组织提取物中的炎症指标。大鼠脑出血模型建立3 d后,3.6%水合氯醛麻醉,快速取出大鼠全脑,放入无RNA酶的离心管内,液氮中保存。按照Trizol试剂使用步骤提取大鼠脑出血部位炎症因子RNA,计算提取出RNA纯度(A260/A280介于1.8~2.0之间有效);参照三步法操作说明,白细胞介素-1β (interleukine-1β,IL-1β),白细胞介素-6(interleukine-6,IL-6) 和肿瘤坏死因子-α(tumor necrosisfactor-α,TNF-α)引物序列见表1。IL-1β,IL-6和TNF-α扩增条件:(1)反转录,45℃,45min;(2)变性,96℃,2min;(3)二次变性,94℃,45 s;(4)退火,58℃,1min;(5)延伸,68℃,2min;(6)以上(3)~(5)三项35个循环;(7)最后延伸,68℃,7min,分析扩增产物。

表1 RT-PCR扩增产物大小
七、细胞凋亡检测
使用TUNEL法检测细胞凋亡。3.6%水合氯醛麻醉,经大鼠左心室插入针头至主动脉入口,剪开右心耳,快速滴注200ml生理盐水置换大鼠血液,再用4%多聚甲醛溶液(4℃)快速灌注。迅速断头取脑,将取出大脑标本放入4%多聚甲醛溶液(4℃)过夜处理。将标本在蔗糖溶液中梯度脱水48 h。恒温冰冻切片机连续切片,厚度20μm。按照Roche公司生产的TUNEL试剂盒操作规程进行染色,观察到胞核为黄棕色是为TUNEL阳性细胞,在目的区域的5个不重复视野,观察100 mm3范围内TUNEL阳性细胞数,取均值。
八、统计学分析
采用SPSS16.0版本软件进行数据处理分析。数据以均数±标准差(x±s)表示。组间样本比较采用两样本的t检验。以P<0.05为差异具有统计学意义。
结果
一、神经功能缺损评分mNSS结果
3组大鼠脑出血模型制作成功后均出现不同程度的神经功能缺损表现,mNSS评分比较差异无统计学意义(P>0.05)。处死大鼠之前,假手术组、脑出血组与脑出血+槲皮素5 mg/kg组之间mNSS评分差异无统计学意义(P>0.05);脑出血组和脑出血+槲皮素50mg/kg组之间mNSS评分差异明显,差异具有统计学意义(P<0.05);脑出血+槲皮素5 mg/kg组与脑出血+槲皮素50mg/kg组之间mNSS评分差异明显,差异具有统计学意义(P<0.05),具体内容见表2。
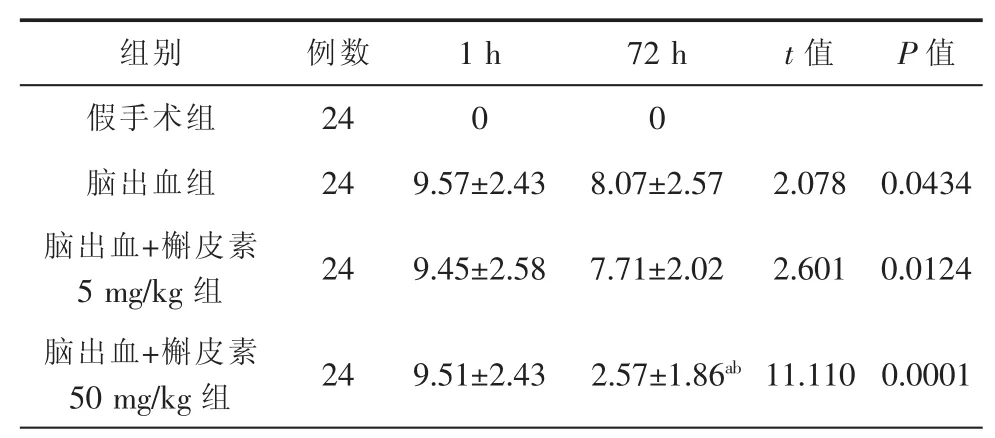
表2 4组大鼠脑出血神经功能缺损评分(x±s,分)
二、脑水肿和TUNEL阳性细胞数检测
脑组织水含量和TUNEL阳性细胞数在脑出血+槲皮素50 mg/kg组低于脑出血组,差异有统计学意义(P<0.05);且低于脑出血+槲皮素5mg/kg组,差异有统计学意义(P<0.05)(图1),具体内容见表3。
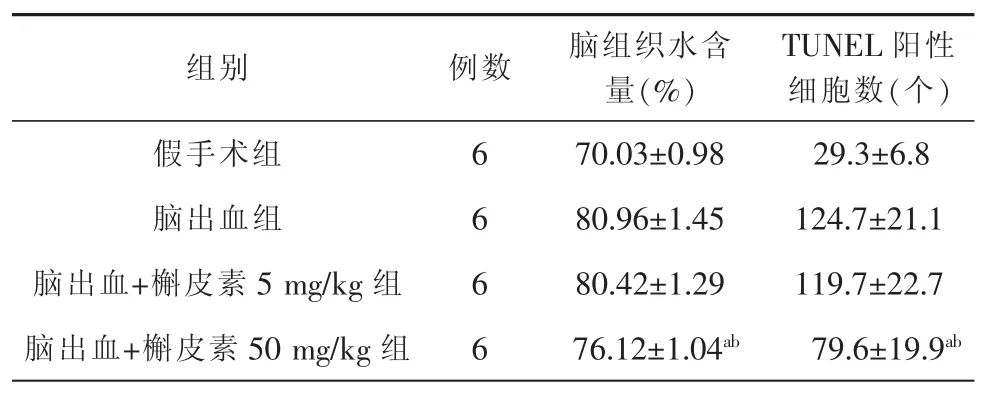
表3 4组大鼠脑出血脑组织水含量和TUNEL阳性细胞数(x±s)
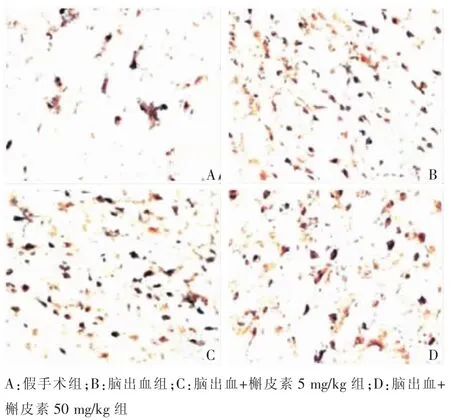
图1 各组大鼠脑出血标本TUNEL染色结果(×200)
三、出血量病灶体积检测
大鼠脑出血后3 d,在脑出血组、脑出血+槲皮素5 mg/kg组及脑出血+槲皮素50 mg/kg组均可见出血灶。与脑出血组比较,脑出血+槲皮素50 mg/kg组出血灶体积明显缩小,表明槲皮素能降低脑出血病灶体积,差异具有统计学意义(P<0.05)(图2),具体内容见表4。

表4 4组大鼠脑出血病灶体积(x±s)
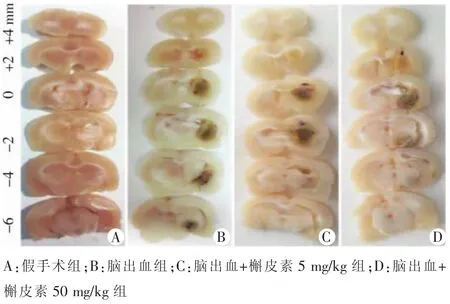
图2 各组大鼠脑出血标本出血灶体积
四、炎症因子检测
每组实验大鼠均有炎症因子mRNA的表达,但是假手术组表达量微弱。大鼠脑出血后脑组织内IL-1β,IL-6和TNF-α在mRNA水平表达的结果。与脑出血组和脑出血+槲皮素5mg/kg组比较,脑出血+槲皮素50mg/kg组各炎症因子在mRNA表达量均降低,差异有统计学意义(P<0.05),具体内容见表5。
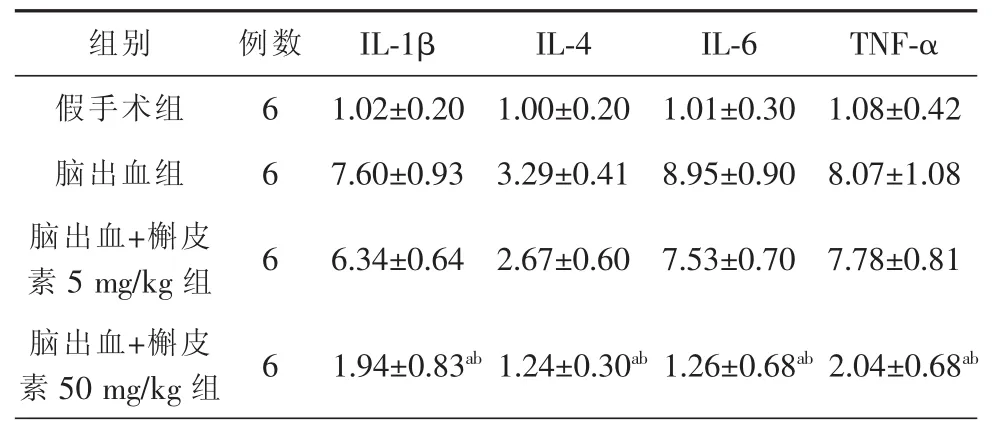
表5 4组大鼠炎症因子mRNA的表达量(x±s)
讨论
在ICH引起的继发性损伤中,由炎症反应引发的脑组织水肿和细胞凋亡是2种相关的危险因素,对ICH的预后有十分重要的影响[3-5]。对于如何减轻由炎症反应导致的脑水肿及细胞凋亡是目前研究ICH的热点。作为一种抗氧化和抗炎药物,五羟黄酮的化合物槲皮素应被认为在急性期中枢神经系统创伤后具有潜在有用的治疗作用。目前有研究表明,槲皮素对脊髓损伤的大鼠动物模型在运动功能恢复方面具有重要保护的作用,并能降低大鼠脊髓损伤模型的继发性损害[6]。但是在槲皮素对ICH后的影响,目前尚无研究报道。本实验研究了槲皮素对大鼠脑出血模型中的炎症反应及细胞凋亡的影响,观察其对ICH是否具有保护作用。本实验采用胶原酶法制作大鼠脑出血模型,模型制作技术成熟,相对可靠。本实验结果发现在神经功能缺损评分mNSS测试中,大鼠脑出血后给予最佳剂量槲皮素,能明显改善其神经功能缺损症状,评分高于单纯脑出血组,差异具有统计学意义(P<0.05)。因此,可以说明经腹腔注射最佳治疗剂量的槲皮素,能促进ICH模型后的神经功能恢复。对大鼠脑出血具有保护作用。
TNF-α是主要的促炎细胞因子之一,是炎症反应过程中重要的调节因子,可以刺激IL-1β、IL-4、IL-6的释放,扩大其生物学效应,是反映机体炎症与组织损伤严重程度的重要敏感指标。TNF-α在ICH后数小时即可检测到,通过检测TNF-α的含量,对预后的判断具有重要的意义。因此,在ICH后给予一种阻断TNF-α等炎症因子表达的药物,或许可以减少由ICH带来的继发性脑损伤和改善神经功能。体外实验发现,槲皮素可有效抑制细菌脂多糖诱导产生的IL-1β、IL-4、IL-6和TNF-α等炎症因子[8]。但在健康成人体内尚未发现槲皮素的血浆浓度与细菌脂多糖诱导产生的TNF-α相关,提示槲皮素只对那些机体内存在氧化应激相关疾病的人群有作用。有研究表明槲皮素因抑制核转录因子(nuclear factor-kappa B,NF-κB)的生物活性,从而直接减少了组织中NF-κB参与产生的相关细胞因子[9]。NF-κB是一种具有多向转录调节作用的蛋白质,参与炎症反应、细胞凋亡等重要的病理生理过程[7]。编码炎症因子的基因是NF-κB的反应性基因,对IL-1β、IL-4、IL-6和TNF-α等炎症因子的转录调控是其最主要功能。槲皮素的抗炎机制可能与其能抑制NF-κB的生物活性所引起的中性粒细胞自发性凋亡延迟和降低中性粒细胞对炎症因子的敏感性有关。
诱导大鼠脑出血已经被证明可以诱导大鼠神经元细胞死亡,在ICH后,细胞凋亡与神经元细胞死亡有密切联系[10]。天冬氨酸特异性半胱氨酸蛋白酶-3(cysteine-containing aspartate-specific proteases,caspase-3)表达上调的细胞凋亡是缺血性和出血性脑损伤的重要标志。Caspase-3是Caspase家族成员之一,它在细胞凋亡执行阶段中起着核心作用,活化的Caspase-3导致神经元细胞DNA断裂,TUNEL阳性和Caspase-3阳性细胞在海马的数量表达增加表示海马中的神经细胞死亡增加[11]。因此,ICH后理想的治疗方法是降低细胞凋亡数量,改善神经损伤情况。槲皮素已被证明改变的Nrf2基因的表达。槲皮素的一个关键功能是Nrf2在小脑颗粒细胞氧化应激后的活化,从而导致基因编码的G-谷氨酰半胱氨酸合成的诱导和增加还原氧化还原平衡神经元谷胱甘肽水平的诱导,这些抗氧化活性的结果,使槲皮素对蛋白质的合成重新建立起氧化还原,转录因子和生存信号通路的调控[12]。在大鼠心肌缺血再灌注模型中,结果表明经槲皮素处理后,TUNEL阳性和Caspase-3阳性细胞的数量有所减少,从而抑制了细胞凋亡[13]。
本实验表明,在大鼠脑出血模型后使用一定剂量的槲皮素,有利于大鼠脑出血后的神经功能的恢复。ICH之后在第3天进行动物神经功能行为测试。测试结果是脑出血+槲皮素50mg/kg组的行为学评分明显高于脑出血组,但是脑出血+槲皮素5mg/kg组与脑出血组的行为学评分没有明显差别。这可能是由于几个不同的机制:(1)最佳治疗剂量的槲皮素对ICH后具有对抗炎症的作用。通过抑制NF-κB的生物活性,从而减少了IL-1β、IL-4、IL-6和TNF-α的表达。本实验结果中,IL-1β、IL-4、IL-6和TNF-α的表达在脑出血+槲皮素50 mg/kg组比脑出血组明显降低。降低炎症因子的含量,从而抑减弱ICH后的继发性损伤,保护神经元细胞;(2)在本实验中通过胶原酶诱导大鼠脑出血,在脑出血组可以观察到有大量TUNEL阳性细胞及Caspase-3蛋白表达。通过最佳治疗剂量的槲皮素能降低 TUNEL阳性和Caspase-3蛋白表达的数量,在脑出血+槲皮素50 mg/kg组与脑出血组相比。从而减少ICH部位的神经元细胞死亡,降低ICH后的继发性损伤。(3)本实验中脑出血+槲皮素50mg/kg组大鼠脑出血量病灶体积与脑出血组和脑出血+槲皮素5 mg/kg组相比,病灶体积明显缩小,说明最佳剂量的槲皮素能明显缩小ICH后病灶体积,改善ICH后血肿的占位效应,对ICH的预后有所帮助。综合以上的机制,50 mg/kg剂量的槲皮素在大鼠ICH后通过降低炎症反应和抑制细胞凋亡,有助于神经功能的恢复。
本实验研究表明腹腔注射治疗最佳剂量的槲皮素的早期治疗,能促进ICH模型后的神经功能恢复。此外,槲皮素通过对抗炎症反应和抑制神经元细胞死亡来改善ICH后的神经功能的恢复。然而反应ICH神经功能损伤的指标很多,本实验仅选取了几个代表性的指标,因此,在实验程序下一步中将要进一步评估槲皮素作为一种神经保护剂在ICH治疗中的其他机制。
[1]van Asch CJ,Luitse MJ,Rinkel GJ,et al.Incidence,case fatality,and functional outcome of intracerebral haemorrhage over time,according to age,sex,and ethnic origin:a systematic review andmeta-analysis[J].Lancet Neurol,2010,9(2):167-176.
[2]Keep RF,Hua Y,Xi G.Intracerebralhaemorrhage:mechanisms of injury and therapeutic targets[J].Lancet Neurol,2012,11(8): 720-731.
[3]Qureshi AI,Tuhrim S,Broderick JP,et al.Spontaneous intracerebral hemorrhage[J].N Engl J Med,2001,344(19): 1450-1460.
[4]Bradl M,Lassmann H.Oligodendrocytes:biology and pathology [J].Acta Neuropathol,2010,119(1):37-53.
[5]Gong C,Boulis N,Qian J,et al.Intracerebral hemorrhageinduced neuronal death[J].Neurosurgery,2001,48(4):875-882.
[6]Schültke E,Kendall E,Kamencic H,et al.Quercetin promotes functional recovery following acute spinal cord injury[J].J Neurotrauma,2003,20(6):583-591.
[7]Offner H,Subramanian S,Parker SM,et al.Experimental stroke induces massive,rapid activation of the peripheral immune system[J].JCereb Blood Flow Metab,2006,26(5):654-665.
[8]Boots AW,Wilms LC,Swennen EL,et al.In vitro and ex vivo anti inflammatory activity of quercetin in healthy volunteers[J]. Nutrition,2008,24(7-8):703-710.
[9]Nair MP,Mahajan S,Reynolds JL,et al.The flavonoid quercetin inhibits proinflammatory cytokine (tumor necrosis factor alpha) gene expression in normal peripheral blood mononuclear cells via modulation of the NF-kappa beta system[J].Clin Vaccine Immunol,2006,13(3):319-328.
[10]Qureshi AI.Nonsteroidal anti-inflammatory drugs and the risk of intracerebral hemorrhage[J].Stroke,2003,34(2):379-386.
[11]Baek SS,Jun TW,Kim KJ,et al.Effects of postnatal treadmill exercise on apoptotic neuronal cell death and cell proliferation of maternal-separated rat pups[J].Brain Dev,2012,34(1):45-56.
[12]Carrasco-Pozo C,Mizgier M,Speisky L,et al.Differential protective effects of quercetin, resveratrol, rutin and epigallocatechin gallate against mitochondrial dysfunction induced by indomethacin in Caco-2 cells[J].Chem Biol Interact, 2012,195(3):199-205.
[13]Liu H,Guo X,Chu Y,et al.Heart protective effects and mechanism of quercetin preconditioning on anti-myocardial ischemia reperfusion(IR)injuries in rats[J].Gene,2014,545(1): 149-155.
Study on the effect of quercetin on inflammation and apoptosis in experimental intracerebral hemorrhage model in rats
Xu Lanjuan,Yi Bo,Li Baolin. ICU,Zhengzhou Central Hospital Affiliated to Zhengzhou University,Zhengzhou 450007,China
Li Baolin,Email:libaolin136@163.com
Objective To investigate the effect of quercetin on neuronal functional recovery in intracerebral hemorrhage(ICH)rats and its underlyingmechanisms.M ethodsIn the present study,we established an ICH model by injecting type VIIbacterial collagenase(0.5 U)into the central striatum of male Sprague-Dawley rats.The animals were randomized to four groups:sham-operation group;ICH+ vehicle group;ICH+5 mg/kg quercetin group;and ICH+50 mg/kg quercetin group.The expression levels of inflammatory cytokines in the brain tissue were assayed by real-time PCR,and cell apoptosis was assayed by TUNEL staining 3 d aftermodel establishment.ResultsIt was found that the expression levels of inflammation markers and the number of apoptotic cells were reduced significantly in ICH rats receiving quercetin in 50 mg/kg quercetin group.ConclusionThese results confirmed the therapeutic efficacy of quercetin in repairing brain injury,probably by inhibiting inflammatory response and apoptosis,thus promoting nerve functional restoration.
Intracerebral hemorrhage;Quercetin;Inflammation;Apoptosis
2017-02-13)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2017.02.008
450007郑州,郑州大学附属郑州中心医院重症医学科
李保林,Email:libaolin136@163.com
徐兰娟,易波,李保林.槲皮素在实验性大鼠脑出血模型中的对抗炎症作用及细胞凋亡作用的研究[J/CD].中华神经创伤外科电子杂志,2017,3(2):093-097.

