8种室内植物对苯污染的监测能力研究
鲁敏,丁珍,赵学明,刘顺腾,景荣荣,高鹏
(1.山东建筑大学学报编辑部,山东济南250101;2.山东建筑大学艺术学院,山东济南250101)
8种室内植物对苯污染的监测能力研究
鲁敏1,2,丁珍2,赵学明2,刘顺腾2,景荣荣2,高鹏2
(1.山东建筑大学学报编辑部,山东济南250101;2.山东建筑大学艺术学院,山东济南250101)
苯作为室内“三大隐形杀手”之一,已严重威胁到人们的生命安全及健康。植物监测作为一种绿色环保、经济实用的方法已成为室内苯化学污染监测的有效途径和重要手段。研究采用密闭熏气法对8种室内植物进行不同浓度的苯胁迫试验,测定植物叶绿素及丙二醛含量、过氧化物酶活性的变化,运用统计分析及双因素方差分析方法,综合评定植物对室内苯污染的监测能力。结果表明:在20、40、80 mg/m3浓度的苯胁迫下,苯浓度与植物种类两因素及其协同作用,对8种实验植物叶绿素及丙二醛含量、过氧化物酶活性变化的影响均达极显著水平;就两因素相比较而言,苯浓度对实验植物的叶绿素及丙二醛含量、过氧化物酶活性变化的影响更为显著;综合三种浓度苯胁迫下实验植物三项指标变化,对苯污染监测能力强的室内植物有凤仙花、玻璃海棠,监测能力中等的有吸毒草、薄荷、吊兰、绿萝,监测能力弱的有天竺葵、吊竹梅。
苯污染;室内植物;密闭熏气法;监测能力
0 引言
当今人类已经进入第三污染期——室内化学污染期,苯作为室内“三大隐形杀手”之一,具强致癌和致畸能力,严重威胁人们的生命安全及健康[1-3]。如何安全、有效、持久的监测并运用科学合理的方法控制室内苯化学污染,已成为亟待解决的重大课题[4-5]。
室内植物对室内苯化学污染具有敏感的监测能力[1-2,4-8]。植物监测是利用受化学污染胁迫后的植物症状学表现和生理生化响应来检测污染物种类、含量以及环境受污染程度的一种生态监测方法[9-10]。植物监测作为一种绿色环保、经济实用的方法已成为室内苯化学污染监测的有效途径和重要手段。
室内苯污染胁迫下植物内部生理特性的变化可有效反映室内植物对苯污染的监测能力[1,5,9]。室内苯污染的植物监测能力研究是室内苯污染的监测植物选择及室内植物监测配置模式构建的基础理论依据[1,5]。目前,国内外有关空气污染的植物监测研究大多集中于园林植物对室外大气污染的监测上,对室内苯污染的植物监测研究相对较少[1,3,5,9-10]。研究采用密闭熏气法对8种室内植物进行20、40、80 mg/m3三种浓度的苯胁迫试验,测定植物叶绿素及丙二醛含量、过氧化物酶活性的变化,运用统计分析及双因素方差分析方法,综合评定植物对室内苯污染的监测能力,从而为室内苯化学污染的敏感监测植物的选择及室内植物监测配置模式的构建提供基础理论依据和指导。
1 试验材料与方法
1.1 试验材料
试验地点在山东建筑大学市政与环境工程学院实验室。试验植物(见表1)为凤仙花、玻璃海棠、天竺葵、薄荷、吊兰、绿萝、吸毒草、吊竹梅,按照实验进程,分批选购于济南市齐鲁花卉市场。
要求植物生长状态良好且长势株型基本一致,置于同一环境下生长;花盆材质、大小完全一致;盆土性质与用量相同。实验前将实验植物放置在实验室正常养护两周,使其适应实验室环境。
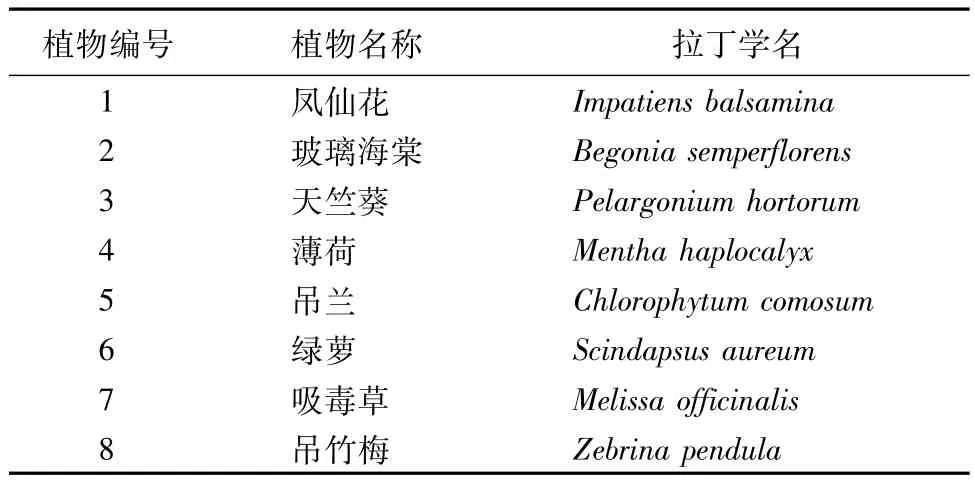
表1 植物选择和编号
1.2 实验装置
以Wolverton的实验装置为参照[11]。利用6组规格为80 cm×80 cm×80 cm的玻璃熏气箱,材质厚度为8 mm的普通玻璃;为防止熏气箱漏气,放入实验植物和试剂后立即用海绵胶带密封顶盖与箱体的接口,箱体其他连接处用玻璃胶密封,并涂少许凡士林;熏气箱内预留小风扇(220 V、80 W),加快污染物挥发速度;控制室内温度为25℃,适宜光照和湿度;放置干湿温度计,观测舱内温、湿度变化。
1.3 实验方案设计
设置20、40和80 mg/m3等3个苯浓度梯度,将8种实验植物随机区组,分批次进行实验,采用模拟舱密闭熏气法处理试验植物,熏气前擦拭植物叶片并晾干,将其盆土用聚乙烯薄膜包扎。
(1)对照组 向A组3个熏气箱内各放置3盆同种植物,并密封箱体,不注入苯,使植物正常生长。
(2)处理组 向B组3个熏气箱内各放置3盆同种植物,并密封箱体,向熏气箱中注入纯度为99.9%的分析纯苯,使3个熏气箱内的苯浓度相同。除处理组用苯处理外,处理组与对照组的植物种类及其它实验条件均相同。
将上述对照组和处理组的植物熏气24 h后,取出植物,可用对角线取样方法采集生长良好,没有病虫害且位置一致的叶片,用去离子水将叶片洗净晾干,称取所需剪碎叶片的重量,进行相应的实验操作,测定叶绿素及丙二醛含量、过氧化物酶活性,实验重复3次。
1.4 生理指标测定方法
叶绿素含量用浸提法测定[12-13];丙二醛含量用巴比妥酸显色法测定[14];过氧化物酶活性用愈创木酚法测定[15]。
1.5 统计分析方法
将植物种类和苯浓度看作是影响植物生理指标变化的两个因素,利用Excel和SPSS17.0软件进行0.05水平的统计分析及双因素方差分析[16-20]。
2 结果与分析
2.1 不同浓度苯污染胁迫后植物叶绿素含量变化
受化学污染胁迫的植物,叶绿素含量会呈现一定程度的降低,进而导致其叶片颜色发生改变,光合作用减弱,从而阻碍植物正常的生长发育[21]。处于相同空气污染环境的抗性较强的植物会利用体内的抗性机制抑制叶绿素含量的减少,导致植物叶绿素含量变化较小,说明其监测能力及敏感性就越低[9]。因此,室内化学污染胁迫下,能够通过植物体内叶绿素含量的变化差异来判断比较不同植物种类的监测能力强弱[4]。
不同浓度苯污染胁迫24 h后,对8种实验植物的叶绿素含量变化进行统计分析,见表2。
从表2看出,不同浓度苯胁迫24 h后,8种实验植物的叶绿素含量均呈现一定程度的降低。将苯浓度和植物种类看作是影响叶绿素含量变化的两个因素,利用SPSS17.0软件进行双因素方差分析,结果见表3。

表2 不同浓度苯胁迫后植物叶绿素含量变化

表3 叶绿素含量变化的双因素方差分析
从表3可以看出,植物种类与苯浓度两因素及其协同作用,对8种实验植物叶绿素含量变化的影响均达极显著水平;F值4835.131>105.428,表明苯浓度对植物叶绿素含量变化的影响更为显著。
得出20、40、80 mg/m3浓度苯胁迫24 h下,8种实验植物中凤仙花的叶绿素含量变化均最大,分别降低15.70%、38.19%、55.48%,监测能力最强;玻璃海棠叶绿素含量变化率分别为14.76%、35.46%、52.50%,监测能力次之;吊竹梅的叶绿素含量变化均最小,分别降低8.45%、22.43%、42. 56%,监测能力最弱。
根据叶绿素含量的变化情况,8种实验植物在20、40、80 mg/m3浓度苯胁迫下的监测能力排序由强到弱均为凤仙花>玻璃海棠>吸毒草>薄荷>吊兰>绿萝>天竺葵>吊竹梅。即对苯污染监测能力强的室内植物有凤仙花、玻璃海棠;监测能力中等的有吸毒草、薄荷、吊兰、绿萝;监测能力弱的有天竺葵、吊竹梅。
2.2 不同浓度苯污染胁迫后植物丙二醛含量变化
化学污染胁迫下的植物的组织或器官会发生膜脂质过氧化作用,从而导致该植物体内丙二醛含量上升,损伤核酸、蛋白质等大分子,影响细胞稳定[22-23]。处于相同空气污染环境,抗性强的植物会通过体内的抗性机制抑制丙二醛含量的增加,导致植物丙二醛含量变化较小,其监测能力及敏感性就越低[4]。因此,室内化学污染胁迫下植物体内丙二醛含量的变化程度,能够反映植物对化学污染的监测能力[24]。
不同浓度苯胁迫24 h后,对8种实验植物的丙二醛含量变化进行统计分析,见表4。

表4 不同浓度苯污染胁迫后植物的丙二醛含量变化
从表4看出,不同浓度苯胁迫24 h后,8种实验植物的丙二醛含量均呈现一定程度的升高。将苯浓度和植物种类看作是影响丙二醛含量变化的两个因素,利用SPSS17.0软件进行双因素方差分析,结果见表5。
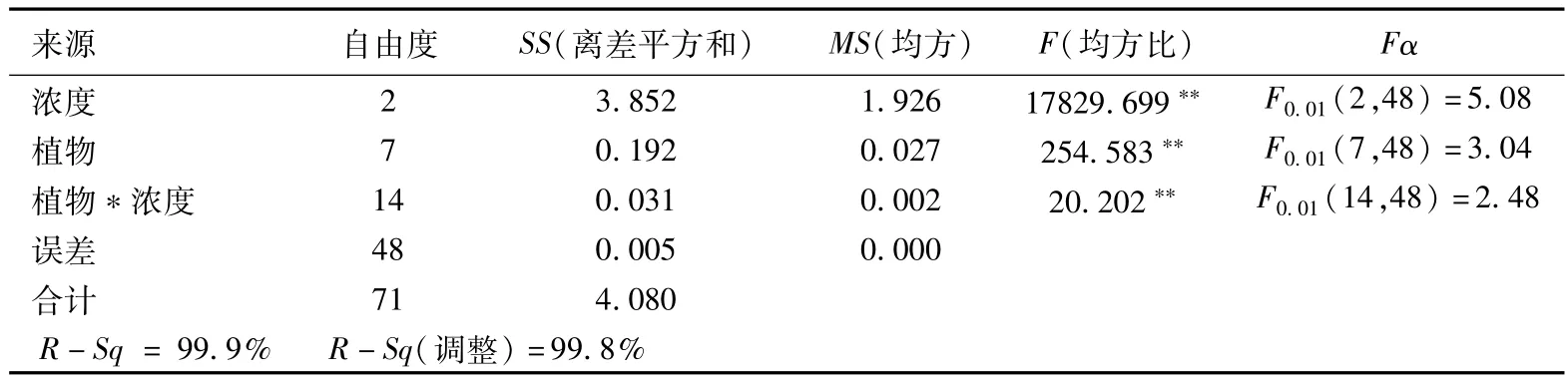
表5 丙二醛含量变化的双因素方差分析
从表5看出,植物种类与苯浓度两因素及其协同作用,对8种实验植物丙二醛含量变化的影响均达极显著水平;F值17829.699>254.583,表明苯浓度对植物丙二醛含量变化的影响更为显著。
得出20、40、80 mg/m3浓度苯胁迫24 h下,凤仙花的丙二醛含量变化均最大,分别升高19.35%、54.79%、83.71%,监测能力最强;玻璃海棠丙二醛含量变化率分别为17.56%、48.74%、79.36%,监测能力次之;吊竹梅丙二醛含量变化最小,分别升高11.06%、35.25%、63.34%,监测能力最弱。
根据丙二醛含量变化情况,8种实验植物在20、40、80 mg/m3浓度苯胁迫下的监测能力排序由强到弱均为:凤仙花>玻璃海棠>吸毒草>薄荷>吊兰>绿萝>天竺葵>吊竹梅。即对苯污染监测能力强的室内植物有凤仙花、玻璃海棠;监测能力中等的有吸毒草、薄荷、吊兰、绿萝;监测能力弱的有天竺葵、吊竹梅。
2.3 不同浓度苯污染胁迫后植物过氧化物酶活性变化的结果与分析
化学污染胁迫下的植物过氧化物酶活性会增加,促进碳水化合物向木质素的转化,使叶片萎焉、干枯[1,25]。在相同污染环境中,抗性强的植物会通过体内的抗性机制抑制过氧化物酶活性的增加,导致植物过氧化物酶活性变化较小,其监测能力及敏感性就越低[4,9]。因此,室内化学污染胁迫下植物体内过氧化物酶活性的变化程度,能够反映植物对化学污染的监测能力[26]。
不同浓度苯胁迫24 h后,对8种实验植物的过氧化物酶活性变化进行统计分析,见表6。
从表6看出,不同浓度苯胁迫24 h后,8种实验植物的过氧化物酶活性均呈现一定程度的升高。将苯浓度和植物种类看作是影响过氧化物酶活性变化的两个因素,利用SPSS17.0软件进行双因素方差分析,结果见表7。

表6 不同浓度苯污染胁迫后植物的过氧化物酶活性变化

表7 过氧化物酶活性变化的双因素方差分析
从表7可以看出,植物种类与苯浓度两因素及其协同作用,对8种实验植物过氧化物酶活性变化的影响均达极显著水平;F值16819.627>174.922,表明苯浓度对植物过氧化物酶活性变化的影响更为显著。
得出20、40、80 mg/m3浓度苯胁迫24 h下,凤仙花的过氧化物酶酶活性变化均最大,分别升高24.74%、57.76%、80.35%,监测能力最强;玻璃海棠过氧化物酶活性变化率分别为22.83%、50.32%、77.86%,监测能力次之;吊竹梅过氧化物酶活性变化均最小,分别升高14.17%、39.75%、66.49%,监测能力最弱。
依据过氧化物酶活性的变化情况,8种实验植物在20、40、80 mg/m3浓度苯胁迫下的监测能力排序由强到弱均为凤仙花>玻璃海棠>吸毒草>薄荷>吊兰>绿萝>天竺葵>吊竹梅。即对苯污染监测能力强的室内植物有凤仙花、玻璃海棠;监测能力中等的有吸毒草、薄荷、吊兰、绿萝;监测能力弱的有天竺葵、吊竹梅。
3 结论
通过上述研究可知:
(1)苯浓度与植物种类两因素之间及其协同作用,对8种实验植物叶绿素及丙二醛含量、过氧化物酶活性变化的影响均达极显著水平;就两因素相比较而言,苯浓度对实验植物叶绿素及丙二醛含量、过氧化物酶活性变化的影响更为显著。
(2)综合20、40、80 mg/m3三种不同浓度苯胁迫下植物叶绿素及丙二醛含量、过氧化物酶活性的变化,8种实验植物监测能力排序由强到弱为凤仙花>玻璃海棠>吸毒草>薄荷>吊兰>绿萝>天竺葵>吊竹梅。即对苯污染监测能力强的室内植物有凤仙花、玻璃海棠;监测能力中等的有吸毒草、薄荷、吊兰、绿萝;监测能力弱的有天竺葵、吊竹梅。
[1] 鲁敏,赵洁,冯兰东,等.室内苯污染的植物生态修复技术研究进展[J].山东建筑大学学报,2013,28(6):551-556.
[2] Ohura T.,Amagai T.,Shen X.E.,etal..Comparative study on indoor air quality in Japan and China:Characteristicsof residential indoor and outdoor VOCs[J].Atmospharic Environment,2009,43(40):6352-6359.
[3] 鲁敏,裴翡翡,刘顺腾.室内甲醛污染的植物生态修复技术研究进展[J].山东建筑大学学报,2011,26(6):592-597,615.
[4] 鲁敏,郭天佑,闫红梅,等.耐阴观叶植物对室内甲醛敏感监测能力研究[J].山东建筑大学学报,2014,29(6):504-511.
[5] 鲁敏,刘顺腾,赵洁.室内化学污染气体的植物监测研究进展[J].山东建筑大学学报,2013,28(1):58-62.
[6] 邱影,丁旭升,叶丽霞,等.龙舌兰科9种观赏植物对苯污染净化能力的研究[J].浙江林业科技,2015,35(2):74-77.
[7] 来伊楠,陈波,卢山.天南星科室内观赏植物对苯的净化研究[J].浙江理工大学学报:自然科学版,2015,33(2):280-284.
[8] 赵辉,郝振萍.苯污染对四种室内观叶植物光合作用的影响[J].黑龙江农业科学,2015(7):89-91.
[9] 鲁敏,赵学明,赵洁,等.室内苯污染胁迫下植物抗性的研究进展[J].山东建筑大学学报,2013,28(5):457-463.
[10]鲁敏,闫红梅,冯兰东,等.室内植物受甲醛污染胁迫响应机制的研究进展[J].山东建筑大学学报,2014,29(3):263-268.
[11]Wolverton B.C.,Wolverton J.D..Plants and soil microorganisms:removal of formaldehyde,xylene,and ammonia from the indoor environment[J].Journal of the Mississippi Academy of Sciences,1993,38(2):11-15.
[12]安雪,李霞,潘会堂,等.16种室内观赏植物对甲醛净化效果及生理生化变化[J].生态环境学报,2010,19(2):379-384.
[13]王江,张崇邦,柯世省,等.模拟酸雨和铜复合污染对白花泡桐生理特性的影响及其解毒机制[J].应用生态学报,2010,21(3):577-582.
[14]井大炜,邢尚军,杜振宇,等.干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响[J].应用生态学报,2013,24(7):1809-1816.
[15]王伟玲,王展,王晶英.植物过氧化物酶活性测定方法优化[J].实验室研究与探索,2010,29(4):21-23.
[16]陈佳瀛,邵勤龙,张佳慧,等.吊兰和常春藤对室内甲醛污染降解能力的研究[J].安徽农业科学,2013,41(15):6829-6831.
[17]刘栋,史宝胜,魏文欣.甲醛气体胁迫对3种观赏植物的形态及部分生理指标的影响[J].河北农业大学学报,2011,34(2):66-70.
[18]林丽仙,李惠华,张雪芹,等.甲醛对吊兰等植物细胞质膜相对透性和光合特性的影响[J].热带作物学报,2013,34(4):719 -726.
[19]李俊霖,李鹏,王恒蓉,等.特殊植物类群空气凤梨对大气污染物甲醛的净化[J].环境工程学报,2013,7(4):1451-1458.
[20]孙瑞莲,张建,王文兴.8种挺水植物对污染水体的净化效果比较[J].山东大学学报(理学版),2009,44(1):12-16.
[21]Wood R.,Orwell R.,Tarran J.,et al.Pot-plants really do clean indoor air[J].The Nursery Papers,2001,2:1-4.
[22]赵辉,王春彦,郝振萍,等.甲醛污染对4种观赏植物叶片叶绿素及MDA含量的影响[J].金陵科技学院学报,2009,25(2):55-57.
[23]何勤勤,周俊辉.盆栽植物对室内甲醛空气污染的净化研究进展[J].江西农业学报,2014,26(2):44-48.
[24]鲁敏,刘功生,陈强,等.9种耐荫观赏植物对室内甲醛污染生理抗性比较研究[J].山东建筑大学学报,2014,29(2):111-117.
[25]陈段芬,李宪松,邸葆,等.甲醛对5种花卉质膜透性和保护酶活性的影响[J].华北农学报,2007,22(3):84-87.
[26]魏梅红,郑晶晶,饶瑶,等.甲醛对芦荟过氧化物酶酶活性的影响[J].福建师范大学学报,2007,23(4):133-136.
Research on monitoring capacity of eight kinds of indoor plants to benzene pollution
Lu Min1,2,Ding Zhen2,Zhao Xueming2,et al.
(1.Editorial Departmentof Journalof Shandong Jianzhu University,Shandong Jianzhu University,Jinan 250101,China;2.School of Art,Shandong Jianzhu University,Jinan 250101,China)
Benzene,one of the three indoor invisible killers,has badly threatened the safety and health of people.Plantmonitoring,as a green,economical and practical method,has become an effective way and importantmeans ofmonitoring chemical pollution of indoor benzene.The change of internal physiological characteristics of plants under indoor benzene pollution can effectively reflects themonitoring capability of indoor plants to benzene pollution.The research experimentswith different concentrations of benzene stress for eight kinds of indoor plants with airtight fumigation method,determines the change of chlorophyll and MDA content,peroxidase activity of plants,comprehensively evaluatesmonitoring capability of indoor plants to benzene pollution by using themethod of statistical analysis and two-factor analysis of variance.The result shows that two factors of benzene concentration and plant species and their synergy significantly affect the change of chlorophyll content and MDA content and peroxidase activity of eight kinds of experimental plants under benzene stress of concentrations of 20,40,80 mg/m3.In comparison to the two factors,the impact of benzene concentration to the change of chlorophyll content and MDA content and peroxidase activity of experimental plants ismore significant.Synthesizing the change of test plants’three indicators underthree concentrations of benzene stress,the indoor plantwith the strongmonitoring capacity to benzene pollution includes Impatiens balsamina and Begonia semperflorens;with the medium monitoring capacity to benzene pollution includes Melissa officinalis,Mentha haplocalyx,Chlorophytum comosum,Scindapsus aureum,with the weak monitoring capacity to benzene pollution includes:Pelargonium hortorum,Zebrina pendula.
benzene pollution;indoor plant;airtight fumigation method;monitoring capacity
X171.4,X173
A
1673-7644(2017)01-0001-06
2016-12-10
国家自然科学基金重点项目(20337010);住房和城乡建设部科技计划项目(2012-K6-5);山东省住房和城乡建设厅科技计划项目(2011YK046)
鲁敏(1963-),女(满族),教授,博士,主要从事室内化学污染、污染大气和污水的植物净化和修复技术及吸污防污植物的选择与应用等方面的研究.E-mail:lumin@sdjzu.edu.cn

