类风湿关节炎合并肺间质病变的影响因素研究
周浩彤,王友莲
类风湿关节炎合并肺间质病变的影响因素研究
周浩彤,王友莲*
目的 探讨类风湿关节炎(RA)合并肺间质病变(ILD)的影响因素。方法 选取2013年6月—2016年2月在江西省人民医院风湿免疫科住院治疗的RA患者349例,根据高分辨率CT(HRCT)检查结果分为RA组和RA合并ILD组(RA-ILD组)。记录并比较两组患者的一般资料、相关实验室检测指标及肺功能指标。结果 349例RA患者中,合并ILD 69例(19.8%)。RA-ILD患者的主要呼吸道症状为活动后干咳及呼吸困难,主要HRCT异常表现为毛玻璃样改变、网状结节状阴影。RA-ILD组患者男性比例、平均年龄、吸烟率、类风湿关节炎活动度评分(DAS28)高于RA组,差异有统计学意义(P<0.05);两组患者病程比较,差异无统计学意义(P>0.05)。RA-ILD组患者类风湿因子(RF)、抗环瓜氨酸肽抗体(抗-CCP抗体)、葡萄糖-6-磷酸异构酶(GPI)高于RA组,差异有统计学意义(P<0.05);两组患者红细胞沉降率(ESR)、C反应蛋白(CRP)、纤维蛋白原、D-二聚体、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)比较,差异无统计学意义(P>0.05)。共68例患者进行了肺功能检查,RA-ILD组患者一氧化碳弥散量(DLCO)、肺活量(VC)、用力肺活量(FVC)、第1秒用力呼气末容积(FEV1)低于RA组,通气功能障碍发生率、弥散功能减退发生率高于RA组,差异有统计学意义(P<0.05);两组患者第1秒用力呼气末容积与用力肺活量比值(FEV1/FVC)、小气道功能障碍发生率比较,差异无统计学意义(P>0.05)。多因素Logistic回归分析结果显示,年龄、DAS28、GPI是RA合并ILD的影响因素(P<0.05)。Pearson相关分析结果显示,DLCO与年龄、DAS28、GPI均无线性相关关系(P>0.05)。结论 ILD是RA患者的常见合并症,高龄、高疾病活动度、高滴度GPI是其危险因素。早期行HRCT检查有助于疾病的及早诊断和治疗,肺功能DLCO测定也对早期诊断ILD有一定参考价值。
关节炎,类风湿;肺疾病,间质性;影响因素分析
周浩彤,王友莲.类风湿关节炎合并肺间质病变的影响因素研究 [J].中国全科医学,2017,20(10):1191-1195.[www.chinagp.net]
ZHOU H T,WANG Y L.Influencing factors of patients with rheumatoid arthritis combined with interstitial lung disease [J].Chinese General Practice,2017,20(10):1191-1195.
类风湿关节炎(rheumatoid arthritis,RA)是一种系统性自身免疫性疾病,以慢性、对称性、破坏性多关节滑膜炎为特征,在一般人群中的发病率为0.5%~2.0%[1]。近50%的RA患者会出现关节外表现,可累及皮肤、眼、心脏、肺、肾、神经系统等[2],其中肺部是最为常见的累及部位,累及率高达67%[3]。肺间质病变(interstitial lung disease,ILD)是RA肺部疾病中较为严重的并发症,可使患者的死亡风险增加3倍[4]。ILD是一组累及肺间质的炎性疾病,也可累及肺泡壁、小气道及微血管[5]。RA合并ILD是从亚临床炎症发展至终末期肺纤维化,约半数的RA合并ILD患者出现在RA发病时或发病后3年内[6]。由于RA合并ILD的早期无明显临床症状,故确诊非常困难。高分辨率CT(high-resolution computed tomography,HRCT)对检测早期肺实质疾病和小气道疾病具有极高的灵敏度,尤其是在ILD患者中[7]。本研究旨在探讨RA合并ILD的影响因素,以为此类患者的及早诊断和治疗提供依据。
1 对象与方法
1.1 研究对象 选取2013年6月—2016年2月在江西省人民医院风湿免疫科住院治疗的RA患者349例。纳入标准:(1)符合1987年美国风湿病学会(ACR)修订的相关诊断标准[8];(2)入院期间行HRCT检查。排除标准:(1)有除RA外的其他自身免疫性疾病史;(2)有除ILD外的其他肺部疾病史,如肺部感染、慢性肺部疾病、肺部肿瘤等;(3)伴药物(如胺碘酮)导致的肺部病变;(4)伴慢性心、肝、肾功能不全,或其他系统肿瘤;(5)妊娠或准备妊娠。本研究通过了江西省人民医院伦理委员会的审核批准,纳入患者均自愿签署知情同意书。
1.2 研究方法 根据HRCT检查结果,参照2010年美国胸科协会/欧洲呼吸协会(ATS/ERS)制定的ILD诊断标准[9],将纳入患者分为RA组(n=280)和RA合并ILD组(RA-ILD组,n=69)。
1.2.1 一般资料收集 通过查阅病历的方法收集纳入患者的一般资料,包括患者姓名、性别、年龄、吸烟史(以≥200~400支/年为吸烟)、病程、类风湿关节炎活动度评分(DAS28)。其中DAS28包括关节触痛数、肿胀关节数、红细胞沉降率(ESR)、受试者疼痛状况评分4个条目,以>5.1分为疾病活动、<3.2分为疾病活动度低、<2.6分为疾病缓解[10]。
1.2.2 实验室指标检测 所有实验室指标检测均由本院检验科完成,其中ESR采用魏氏法,类风湿因子(RF)、C反应蛋白(CRP)、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)采用免疫比浊法,抗环瓜氨酸肽抗体(抗-CCP抗体)、葡萄糖-6-磷酸异构酶(GPI)采用酶联免疫吸附试验法(ELISA),纤维蛋白原、D-二聚体采用日本希森美康CS-5100全自动凝血分析仪。
1.2.3 肺功能检查 采用德国康讯Ganshorn PowerCube肺功能仪检测患者肺功能,包括一氧化碳弥散量(DLCO)、肺活量(VC)、用力肺活量(FVC)、第1秒用力呼气末容积(FEV1)、第1秒用力呼气末容积与用力肺活量比值(FEV1/FVC)。根据2005年ATS/ERS制定的肺功能联合指南,判断是否存在通气功能障碍、小气道功能障碍、弥散功能减退[11]。
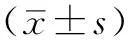
2 结果
2.1 RA患者合并ILD情况 349例RA患者中,合并ILD 69例(19.8%)。RA合并ILD患者的主要呼吸道症状为活动后干咳及呼吸困难,常见HRCT异常表现为小叶间隔增厚、毛玻璃样改变、蜂窝状改变及网状结节状阴影,以双下肺受累为主,其中毛玻璃样改变、网状结节状阴影为主要表现。
2.2 两组患者一般资料比较 两组患者男性比例、平均年龄、吸烟率、DAS28比较,差异有统计学意义(P<0.05);两组患者病程比较,差异无统计学意义(P>0.05,见表1)。

表1 两组患者一般资料比较
注:RA=类风湿关节炎,ILD=肺间质病变,DAS28=类风湿关节炎活动度评分;a为t值
2.3 两组患者实验室检测指标比较 两组患者RF、抗-CCP抗体、GPI比较,差异有统计学意义(P<0.05);两组患者ESR、CRP、纤维蛋白原、D-二聚体、IgG、IgA、IgM比较,差异无统计学意义(P>0.05,见表2)。
2.4 两组患者肺功能指标比较 共68例患者进行了肺功能检查,其中RA组37例,RA-ILD组31例。两组患者DLCO、VC、FVC、FEV1、通气功能障碍发生率、弥散功能减退发生率比较,差异有统计学意义(P<0.05);两组患者FEV1/FVC、小气道功能障碍发生率比较,差异无统计学意义(P>0.05,见表3)。
2.5 RA合并ILD年龄、DAS28、GPI的多因素Logistic回归分析 以是否合并ILD为因变量(赋值:否=0,是=1),以表1、2中差异有统计学意义的指标为自变量(赋值:性别,男=0,女=1;吸烟,否=0,是=1;其他指标均以实际值纳入),进行多因素Logistic回归分析。结果显示,年龄、DAS28、GPI是RA合并ILD的影响因素(P<0.05,见表4)。
2.6 RA-ILD组患者DLCO与年龄、DAS28、GPI的相关性分析 对31例RA-ILD组患者DLCO与年龄、DAS28、GPI进行Pearson相关分析。结果显示,DLCO与年龄、DAS28、GPI均无线性相关关系(r值分别为-0.023、0.179、-0.337,P>0.05)。

表2 两组患者实验室检测指标比较
注:ESR=红细胞沉降率,RF=类风湿因子,CRP=C反应蛋白,抗-CCP抗体=抗环瓜氨酸肽抗体,GPI=葡萄糖-6-磷酸异构酶,IgG=免疫球蛋白G,IgA=免疫球蛋白A,IgM=免疫球蛋白M;a为Z值

表3 两组患者肺功能指标比较
注:DLCO=一氧化碳弥散量,VC=肺活量,FVC=用力肺活量,FEV1=第1秒用力呼吸末容积,FEV1/FVC=第1秒用力呼吸末容积与用力肺活量比值;a为t值;DLCO、VC、FVC、FEV1数据均为与预计值的百分比
表4 RA合并ILD影响因素的多因素Logistic回归分析
Table 4 Multivariate Logistic regression analysis of influencing factors of RA combined with ILD

自变量bSEWaldχ2值P值OR(95%CI)性别0.1460.5740.0640.8001.157(0.375,3.566)年龄0.0640.02010.0310.0021.066(1.025,1.109)吸烟1.1500.7442.3910.1223.158(0.735,13.564)DAS280.4960.2175.2110.0221.642(1.073,2.513)RF1.491×10-41.580×10-40.8910.34510.001×10-1(9.998×10-1,10.004×10-1)抗-CCP抗体4.133×10-44.932×10-40.7020.4021.000(0.999,1.001)GPI 0.4430.1419.8360.0021.557(1.181,2.053)常量-9.9252.24119.621<0.0014.895×10-5
3 讨论
肺部病变是RA关节外表现最为常见的并发症,其表现各不相同,包括气道、肺实质、血管及胸膜疾病,ILD是其中最严重的,也是RA患者的主要死因之一[5]。本研究中ILD在RA患者的HRCT检出率为19.8%,高于BONGARTZ等[4]报道的7.7%,但低于GILES等[12]报道的33%,主要原因为该病的发病率受诊断标准、方法及研究人口的影响。而尸检的研究结果显示,RA合并ILD的发生率高达35%[13]。HRCT可以提供早期识别ILD的灵敏方法[8],如毛玻璃样改变、网状结节状阴影,这也是本研究中检测到的常见异常表现。RA合并ILD早期无明显症状且患者预后差,因此对于疑似合并ILD的RA患者应早期行HRCT检查。另外,外科肺活检仍然是ILD的诊断金标准[14],但其为侵入性方法,不主张在早期无症状患者中使用。
目前,RA合并ILD的发病机制和危险因素仍有待阐明。有研究报道,男性、高龄、吸烟、高疾病活动程度、高滴度RF,高滴度抗-CCP抗体是RA合并ILD的危险因素[4,15-18]。本研究结果显示,RA-ILD组男性患者比例、平均年龄、吸烟率、DAS28、RF、抗-CCP抗体、GPI高于RA组,且年龄、DAS28、GPI是RA合并ILD的影响因素,与上述既往研究结果相符。
RF是由B细胞产生的抗变性抗体,可与体内变性抗原IgG结合形成稳定的免疫复合物,激活补体途径,引起肺血管炎性病变与气道和肺泡壁损伤,导致肺不可逆的重构形成ILD,表达高滴度RF的RA患者易发生ILD[15]。同时,近期研究结果表明,表达高滴度抗-CCP抗体与RA合并ILD相关,RA合并ILD患者肺内存在的环瓜氨酸蛋白可能作为抗原,通过外源性或内源性刺激产生抗-CCP抗体参与肺间质损伤[16]。本研究中,RA-ILD组患者的RF、抗-CCP抗体高于RA组,但未发现RF、抗-CCP抗体是RA合并ILD的影响因素,其原因可能与本研究纳入的样本量较小及RF、抗-CCP抗体影响因素较多有关。
一项国外的研究结果表明,RA K/BxN模型小鼠通过转基因编码表达KRN T细胞受体,激活KRN T细胞将GPI呈递给特异性B细胞,高亲和性GPI-特异性B细胞在支气管相关淋巴组织样病变组织中优先产生,而支气管相关淋巴组织的发病率与ILD严重程度相关[17]。但目前GPI导致RA合并ILD的作用机制尚不明确,需进一步研究。
RA合并ILD患者的弥散功能减退主要由ILD引起弥散距离增加、通气血流比例失调、肺毛细血管床和血流量减少等病理生理变化所致,是最早期也是最常见的肺部改变。肺功能DLCO测定主要反映了弥散功能,DLCO下降提示弥散功能减退,同时DLCO下降也被认为是RA合并ILD最为灵敏的指标[7]。本研究中RA-ILD组患者的DLCO与年龄、DAS28、GPI无线性相关关系,表明ILD严重程度不随其危险因素的升高而加重。进行了肺功能检查的31例RA-ILD患者中,83.9%出现了弥散功能减退,明显高于RA组;同时RA-ILD组患者DLCO、VC、FVC、FEV1均低于RA组。故监测早期无呼吸道症状RA患者的肺功能,尤其是DLCO,对早期发现和诊断ILD有一定的参考价值[18]。
RA-ILD是RA常见且严重的并发症之一,高龄、高疾病活动度、高滴度GPI是其危险因素,应早期行HRCT检查,以早期诊断和治疗。另外,尽早行肺功能DLCO测定对早期诊断ILD具有一定参考价值。
作者贡献:周浩彤进行研究的实施与可行性分析,数据的收集、整理及统计学处理,结果的分析与解释,撰写论文并负责文章的中英文修订;王友莲进行文章的构思与设计、文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]GABRIEL S E,CROWSON C S,KREMERS H M,et al.Survival in rheumatoid arthritis:a population-based analysis of trends over 40 years[J].Arthritis Rheum,2003,48(1):54-58.
[2]TURESSON C,O′FALLON W M,CROWSON C S,et al.Occurrence of extraarticular disease manifestations is associated with excess mortality in a community based cohort of patients with rheumatoid arthritis[J].J Rheumatol,2002,29(1):62-67.
[3]BILGICI A,ULUSOY H,KURU O,et al.Pulmonary involvement in rheumatoid arthritis[J].Rheumatol Int,2005,25(6):429-435.DOI:10.1007/s00296-004-0472-y.
[4]BONGARTZ T,NANNINI C,MEDINA-VELASQUEZ Y F,et al.Incidence and mortality of interstitial lung disease in rheumatoid arthritis:a population-based study[J].Arthritis Rheum,2010,62(6):1583-1591.DOI:10.1002/art.27405.
[5]NURMI H M,PUROKIVI M K,KRKKINEN M S,et al.Variable course of disease of rheumatoid arthritis-associated usual interstitial pneumonia compared to other subtypes[J].BMC Pulm Med,2016,27,16(1):107.DOI:10.1186/s12890-016-0269-2.
[6]KODURI G,NORTON S,YOUNG A,et al.Interstitial lung disease has a poor prognosis in rheumatoid arthritis:results from an inception cohort[J].Rheumatology(Oxford),2010,49(8):1483-1489.DOI:10.1093/rheumatology/keq035.
[7]DAWSON J K,FEWINS H E,DESMOND J,et al.Fibrosing alveolitis in patients with rheumatoid arthritis as assessed by high resolution computed tomography,chest radiography,and pulmonary function tests[J].Thorax,2001,56(8):622-627.DOI:10.1136/thorax.56.8.622.
[8]ARNETT F C,EDWORTHY S M,BLOCH D A,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31(3):315-324.DOI:10.1002/art.1780310302.
[9]ALETAHA D,NEOGI T,SILMAN A J,et al.2010 Rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Arthritis Rheum,2010,62(9):2569-2581.
[10]WELLS G,BECKER J C,TENG J,et al.Validation of the 28-joint Disease Activity Score(DAS28) and European League Against Rheumatism response criteria based on C-reactive protein against disease progression in patients with rheumatoid arthritis,and comparison with the DAS28 based on erythrocyte sedimentation rate[J].Ann Rheum Dis,2009,68(6):954-960.DOI:10.1136/ard.2007.084459.
[11]PELLEGRINO R,VIEGI G,BRUSASCO V,et al.Series "ATS/ERS task force:standardisation of lung function testing".Standardisations of spirometry[J].Eur Respir J,2005,26:948-968.DOI:10.1016/j.jcf.2016.01.003.
[12]GILES J T,DARRAH E,DANOFF S,et al.Association of cross-reactive antibodies targeting peptidyl-arginine deiminase 3 and 4 with rheumatoid arthritis-associated interstitial lung disease[J].PLoS One,2014,9(6):e98794.DOI:10.1371/journal.pone. 0098794.
[13]SUZUKI A,OHOSONE Y,OBANA M,et al.Cause of death in 81 autopsied patients with rheumatoid arthritis[J].J Rheumatol,1994,21(1):33-36.
[14]KAARTEENAHO R.The current position of surgical lung biopsy in the diagnosis of idiopathic pulmonary fibrosis[J].Respir Res,2013,14(1):43.DOI:10.1186/1465-9921-14-43.
[15]HABIB H M,EISA A A,ARAFAT W R,et al.Pulmonary involvement in early rheumatoid arthritis patients[J].Clin Rheumatol,2011,30(2):217-221.DOI:10.1007/s10067-010-1492-5.
[16]YIN Y,LIANG D,ZHAO L,et al.Anti-cyclic citrullinated Peptide antibody is associated with interstitial lung disease in patients with rheumatoid arthritis[J].PLoS One,2014,9(4):e92449.DOI:10.1371/journal.pone.0092449.
[17]SHILLING R A,WILLIAMS J W,PERERA J,et al.Autoreactive T and B cells induce the development of bronchus-associated lymphoid tissue in the lung[J].Am J Respir Cell Mol Biol,2013,48(4):406-414.DOI:10.1165/rcmb.2012-0065OC.
[18]WANG T,ZHENG X J,LIANG B M,et al.Clinical features of rheumatoid arthritis-associated interstitial lung disease[J].Sci Rep,2015,5:14897.DOI:10.1038/srep14897.
本文链接:
类风湿关节炎(rheumatoid arthritis,RA)是一种系统性自身免疫性疾病,呈全球分布,病因尚不清楚,可能与细菌和病毒感染、遗传、内分泌、代谢、职业、心理和社会环境的差异、营养和地理因素等有关,以慢性、对称性、多滑膜关节炎和关节外病变为主要临床表现。早期受累关节有疼痛、肿胀、功能下降,病变呈持续、反复发作的过程,晚期关节可出现不同程度的僵硬畸形,并伴有骨和骨骼肌的萎缩,极易致残。RA的全身性表现除关节病变外,还有发热、乏力、全身不适、心包炎、皮下结节、肺间质病变、动脉炎、周围神经病变等。
2009年10月17—21日在费城召开的美国风湿病学会(ACR)年会上公布了最新的RA分类标准,这个标准由ACR与欧洲风湿病学会(EULAR)联合提出,具体内容包括:(1)受累关节(0~5分):1个中大关节0分;2~10中大关节1分;1~3小关节2分;4~10小关节3分;>10个,至少1个为小关节5分。(2)血清学抗体检查(0~3分):类风湿因子(RF)和抗环瓜氨酸肽(CCP)抗体均阴性0分;RF或抗CCP抗体至少1项低滴度阳性2分;RF或抗CCP抗体至少1项高滴度阳性3分。(3)滑膜炎持续时间(0~1分):<6周0分;6周1分。(4)急性期反应物(0~1分):C反应蛋白(CRP)和红细胞沉降率(ESR)均正常0分;CRP或ESR增高1分。以上4项累计最高评分6分或以上可以诊断RA。
(本刊编辑部整理)
(本文编辑:王凤微)
Influencing Factors of Patients with Rheumatoid Arthritis Combined with Interstitial Lung Disease
ZHOUHao-tong,WANGYou-lian*
DepartmentofRheumatismandImmunology,JiangxiProvincialPeople′sHospital,Nanchang330006,China
*Correspondingauthor:WANGYou-lian,Chiefphysician,Mastersupervisor;E-mail:wyl5639@sina.com
Objective To explore influencing factors of patients with rheumatoid arthritis(RA) combined with interstitial lung disease(ILD).Methods A total of 349 patients with RA treated in Department of Rheumatism and Immunology of Jiangxi Provincial People′s Hospital from June 2013 to February 2016 were selected and divided into RA group and RA combined with ILD group(RA-ILD group) according to the detected results of high-resolution CT(HRCT).The general data,related laboratory testing indicators and pulmonary function indicators were recorded and compared between the two groups.Results Among the 349 patients with RA,69(19.8%) were combined with ILD.The main respiratory symptoms of RA-ILD patients were dry cough and dyspnea after the event,and the main abnormal performance of HRCT were groupd-glass opacity and reticular and nodular shadows.The proportion of males,mean age,smoking rate and RA disease activity score(DAS28) in RA-ILD group were significantly higher than those in RA group(P<0.05).There was no significant difference in the course of disease between two groups(P>0.05).The levels of rheumatoid factor(RF),anti-cyclic citrullinated peptide antibody(anti-CCP antibody) and glucose-6-phosphate isomerase(GPI) in RA-ILD group were significantly higher than those in RA group(P<0.05);the erythrocyte sedimentation rate(ESR),C-reactive protein(CRP),fibrinogen,D-dimer,immunoglobulin G(IgG),immunoglobulin A(IgA),and immunoglobulin M(IgM) were not significantly different between two groups(P>0.05).A total of 68 patients received pulmonary function tests.The carbon monoxide diffusing capacity(DLCO),vital capacity(VC),forced vital capacity(FVC),first-second forced expiratory volume(FEV1) in RA-ILD group were significantly lower than those in RA group(P<0.05);the incidence of ventilatory dysfunction and diffuse dysfunction in RA-ILD group were significantly higher than those in RA group(P<0.05);there was no significant difference in the incidence of FEV1/FVC ratio and small airway dysfunction between the two groups(P>0.05).Multivariate Logistic regression analysis showed that age,DAS28 and GPI were the influencing factors of RA combined with ILD(P<0.05).Pearson correlation analysis showed that DLCO had no linear correlation with age,DAS28 and GPI(P>0.05).Conclusion ILD is a common complication of patients with RA,and advanced age,high disease activity,high-titer GPI are its risk factors.Early HRCT examination is helpful for the early diagnosis and treatment of the disease and early DLCO diagnosis of lung function is also valuable for early diagnosis of ILD.
Arthritis,rheumatoid;Lung diseases,interstitial;Root cause analysis
R 593.22 R 563.13
A
10.3969/j.issn.1007-9572.2017.10.010
2016-11-30;
2017-02-26)
330006 江西省南昌市,江西省人民医院风湿免疫科
*通信作者:王友莲,主任医师,硕士生导师;E-mail:wyl5639@sina.com

