阵发性交感神经过度兴奋综合征的临床特点分析
黄宝和,是明启,邵春香
·个案报道·
阵发性交感神经过度兴奋综合征的临床特点分析
黄宝和,是明启,邵春香
阵发性;交感神经;临床特点
阵发性交感神经过度兴奋综合征(paroxysmal sympathetic hyperactivity,PSH)是一组以阵发性自主神经症状(瞳孔散大、高热、多汗、血压高、心率快、呼吸快)和运动症状(肌张力增高、去大脑或去皮质强直、肌阵挛)为表现的临床综合征。常突然出现,可持续数小时,随之迅速结束。临床医生对PSH大多认识不足,易误诊而延误治疗。笔者总结了我院神经科2012年5月至2015年5月收治的PSH患者4例的临床资料,并对其病因、临床特点、辅助检查、治疗方法等进行探讨,以提高大家对其认识。
1 临床资料
例1患者,男,55岁。因“头晕、意识不清2 h”入院。既往有高血压病10年,未规律服用降压药治疗,血压最高210/120 mmHg(1 mmHg=0.133 kPa)。发现血糖高2年,未治疗。入院时查体:血压180/ 110 mmHg,昏迷,双侧瞳孔直径3 m,光反射灵敏,双眼水平眼震,快相向左,四肢瘫,肌张力低,双侧病理征阳性。急诊头CT排除脑出血,头MRA及DWI扫描显示基底动脉远端血流缺损,未见急性期梗死,确定基底动脉血栓为临床症状的病因。急诊经股动脉导管血管造影证实基底动脉远端闭塞。基底动脉尖端和大脑后动脉仍能经过后交通动脉从颈内动脉获得供血,用微导管接触血栓,给予尿激酶50万单位高压注射器泵入,10 000 u/min,50 min后复查,基底动脉完全再通。患者术后3 h清醒。查体:神志清,吟诗样言语,双侧瞳孔直径3 mm,光反射灵敏,双眼不能内收,外展不足,双眼水平眼震,快相向左,右侧中枢性面舌瘫,右侧肢体肌力Ⅲ级,左上肢肌力Ⅳ级,左下肢肌力Ⅴ级,右侧病理征阳性。继续给予抗血小板聚集、抗凝、改善循环、脑保护、调整血压、血糖等综合治疗。患者于发病48 h后翻身拍背时出现去脑强直、双侧瞳孔散大(直径5 mm)、多汗、血压高(180/110 mmHg)、心率快(120次/min)、呼吸快(28次/min)、体温高(38.5℃),持续5 min左右自行缓解,考虑癫痫大发作。因无静脉通路,给予肌注咪达唑仑,口服丙戊酸钠治疗。其后每天发作1~4次,持续时间几分钟至20 min,多在翻身拍背时发作,发作时去脑强直、有或无双侧瞳孔散大(直径5 mm)、多汗、血压>160/110 mmHg、心率>120次/min、呼吸>25次/ min、体温>38.3℃。丙戊酸钠缓慢加量至0.4 tid,仍然反复发作。化验血常规、降钙素原,胸部CT排除感染。动态脑电图检查发现发作时均无癫痫波出现,复查头MRI及MRA:中脑、小脑、丘脑、枕叶可见小的缺血病灶。基底动脉轻度狭窄。修正诊断:基底动脉尖综合征、高血压病3级(极高危)、PSH、2型糖尿病。治疗上停用丙戊酸钠,添加心得安联合加吧喷丁治疗,症状在发病后10 d消失。
例2患者,男,45岁,煤矿工人,因“头部外伤后意识不清伴呕吐4 h”入院。代诉患者井下工作意外塌方致伤头部,当即意识不清,呼之不应,烦躁不安,恶心、呕吐数次。头颅CT显示左侧额颞叶脑挫裂伤并出血,量约20 mL,蛛网膜下腔出血,左颞骨骨折,左颞顶头皮血肿。入院时查体:体温37.3℃,脉搏86次/min,呼吸22次/min,血压125/70 mmHg。浅昏迷,查体不合作。格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分为6分。左颞顶头皮血肿,大小约4 cm×5 cm,左侧眼睑青紫肿胀,“熊猫眼”征阳性,右侧瞳孔直径3 mm,光反应迟钝,左侧瞳孔直径2 mm,光反射迟钝,双侧视乳头无水肿,A:V=2:3,视网膜未见出血点。双侧鼻腔及外耳道未见血性液体流出。颈部无抵抗,四肢肌力无法查,肌张力正常,双侧病理征阴性;脑膜刺激征阴性。入院2 h后意识障碍加重,复查头颅CT显示左侧额颞叶出血量增加,量约40 mL,中线向右侧偏移约1.5 cm。遂急诊在全麻下行颅内血肿清除术,术后给予止血、降颅压、营养神经、抗感染及支持对症等治疗。术后第2天,患者意识逐渐好转,呈嗜睡状态,能回答简单问题。患者于术后56 h侧卧排大便时出现去皮质强直、大汗、血压高(170/110 mmHg)、心率快(130次/ min)、呼吸快(29次/min)、体温高(38.5℃),持续10 min左右自行缓解。复查头颅CT显示无出血和脑水肿,ICU医师拟诊“症状性癫痫”,先后应用苯巴比妥钠、卡马西平、丙戊酸钠、苯妥英钠等治疗,其后每天发作2~5次,持续时间几分钟至半小时,多在翻身排大便或拍背时发作,发作时去去皮质强直、大汗、血压>165/110 mmHg、心率>120次/min、呼吸>25次/min、体温>38.5℃,不发作时均正常,多次视频脑电录像检测发作时均无癫痫波出现。经我科会诊考虑PSH,给予心得安、溴隐亭、加巴喷汀治疗,并加用高压氧治疗,症状在发病后38 d消失。
例3患者,男,78岁。因“发作性四肢僵硬、大汗、血压高、呼吸急促1月”急诊以“症状性癫痫”收入院。既往有高血压病史20年,血压最高200/120 mmHg,口服氨氯地平片、缬沙坦治疗。患者5年来多次脑梗死(大脑半球、脑干)后卧床,鼻饲,失语,四肢瘫,双侧病理征阳性。近1月来出现发作性四肢僵硬、大汗、血压高、呼吸急促,并因此于基层医院住院治疗,考虑为“症状性癫痫”口服丙戊酸钠0.4 tid,检测血药浓度90µɡ/mL,托吡酯100 mg/d,每天上述症状仍发作2~10次,持续时间几分钟至半小时,翻身可诱发。入院时查体:血压145/95 mmHg,自主睁眼,无指令性动作,双上肢屈曲,双下肢伸直,肌张力增高,多个关节挛缩畸形,双巴氏征阳性。入院后头部MRI示多发性脑梗死(脑干、皮质下,基底核区、侧脑室旁),部分为软化灶,无新发病灶,皮质下动脉硬化性脑病,脑萎缩。视频脑电图检查:发作时均未见癫痫波。监测:发作时心率120~155次/min,血压180/110 mmHg~220/140 mmHg,呼吸25~30次/分,体温38.3~39℃,不发作时正常,考虑PSH。治疗上予停服丙戊酸钠、托吡酯,给予心得安、溴隐亭、加巴喷汀治疗,发作次数减少,1天1次或数天1次,1月后因肺部感染死亡。
例4患者,男,73岁。因“头部外伤后意识不清伴呕吐1 h”入院。代诉患者晨起锻炼身体倒退行走摔倒后枕部着地,当即意识模糊,烦躁不安,恶心、呕吐数次。头颅CT显示左侧枕部脑挫裂伤并出血,右侧额颞叶硬膜下血肿脑挫伤颅内血肿量约10 mL,蛛网膜下腔出血,左枕部头皮血肿。入院时查体:体温36.3℃,脉搏76次/min,呼吸22次/min,血压135/75 mmHg。昏睡,查体不合作。GCS评分11分。左枕部头皮血肿,大小约3 cm×5 cm,双侧瞳孔直径3 mm,光反应灵敏,双侧视乳头无水肿,A:V=2:3,视网膜未见出血点。双侧鼻腔及外耳道未见血性液体流出。颈部无抵抗,四肢可见自主活动,肌张力正常,双侧病理征阴性;脑膜刺激征阴性。入院5 h后意识障碍加重,复查头颅CT显示右侧额颞叶出血量增加,量约45 mL,中线向左侧偏移约1.5 cm。遂急诊在全麻下行颅内血肿清除术及去骨板减压术,术后给予止血、降颅压、营养神经、抗感染及支持对症等治疗。术后1周,患者意识逐渐好转,呈嗜睡状态,能回答简单问题。术后30 d,患者神志清,能回答简单问题,右侧肢体肌力Ⅳ级,左侧肢体肌力Ⅲ级,左侧病理征阳性。患者于术后45 d吸痰时出现去皮质强直、大汗、血压高(190/110 mmHg)、心率快(130次/min)、呼吸快(27次/min)、体温高(38.5℃),持续10 min左右自行缓解。复查头颅CT显示脑水肿,拟诊“症状性癫痫”先后应用卡马西平、丙戊酸钠、苯妥英钠、托吡酯等治疗,其后每天发作4~10次,持续时间几分钟至1 h,多在吸痰、排便时诱发,发作时血压>160/110 mmHg、心率>120次/min、呼吸>25次/分、体温>38.3℃,发作间期正常;多次动态脑电图检测发作时均无癫痫波出现,考虑PSH。给予心得安、溴隐亭、加巴喷汀治疗,发作次数减少,患者智能减退明显,脑积水明显,给予脑室-腹腔分流术,并加用高压氧治疗,症状在发病后68 d消失。随访1年,未再发作。
2 讨论
2.1 PSH的病因
1929 年Wilder Penfield[1]首次在脑外伤患者中描述此综合征,随后越来越多的病因被报道(缺血性脑血管病、缺血缺氧性脑病、脑出血、蛛网膜下腔出血、脑积水、脑炎等),其中严重脑损伤最常见。严重脑损伤患者中8%~33%出现PSH,脑组织缺氧患者中6%~29%出现PSH,而脑梗死仅占5.4%[2]。国内吴中亚等[3]报道3例PSH均为脑梗死。本文报道的4例患者,2例为脑梗死,1例为严重脑损伤,1例为脑损伤后脑积水。
2.2 PSH的病理生理机制
最初研究认为PSH是由于癫痫发作,然而传统抗癫痫药物治疗PSH功效甚微。随后有更多学说被提出,其中主要有2个[4]。1个是失联学说,另一个是EIR(excitatory:inhibitory ratio)模型学说。失联学说认为,在上游脑干、间脑、大脑皮质中存在抑制中枢,它对来自下游脑干和脊髓通路的交感神经兴奋起抑制作用。如果其受伤则抑制作用消失,来自下游脑干和脊髓通路的交感神经持续兴奋。然而,有病理学和影像学证实,低位脑干损伤患者同样有PSH发生,视乎此学说并不能解释。EIR模型学说提出在脑干和间脑有抑制中枢,它限制了由脊髓电路中处理的传入感觉信息的增大和增敏。除此之外,这些脊髓电路的可塑性将导致轻度伤害性刺激增大,从而导致异常性疼痛(不适的疼痛和轻度感觉刺激)。脑损伤后,伤害和非伤害性刺激将有能力产生正的反馈回路用于产生PSH。这些刺激包括普通的护理措施,如吸痰,翻动,调整和洗澡,以及生理性触发如便秘,尿潴留和疼痛。这种刺激经常引起脑损伤患者的PSH发作,这也验证了模型的可信。此外,EIR模型还表明有效的治疗策略应该涉及阻断发生在脊髓中传入感觉信息的致敏过程。本文报道的4例患者在日常护理过程中发现翻身、吸痰、拍背可刺激PSH的发作,从而也证明了EIR模型学说的真实性。
2.3 PSH的诊断及鉴别诊断
PSH目前尚无统一的标准。既往文献提出过9套诊断标准[5]。大多数诊断标准在PSH的核心临床特征包括心率、血压、呼吸频率、体温、出汗、和肢体活动状况达成了共识。但文献报道[5]的PSH病例仅有33%应用诊断标准。2014年Lump等[4]通过回顾相关PSH文献,提出成立一个多学科小组管理PSH的方法,以期提高PSH的识别,且通过规范药物应用,减少PSH的发作频率以及持续时间。本文报道的4例患者均具有PSH的核心临床特征。
因PSH的非特异性症状,其诊断多采用排除法,如癫痫、颅内高压、脑积水、躁动、疼痛、中枢性发热、恶性高热、麻醉复苏、戒断综合征等。特别是PSH患者多数脑损伤严重难以判断意识状态,同时合并肺部感染、营养不良,加上临床医师对其认识不足,极易被误诊。本文4例患者均首先误诊为癫痫大发作,常规抗癫痫治疗无效,后经过脑电图视频录像检测发现患者发作时均无癫痫波,从而明确诊断。PSH与癫痫大发作的鉴别要点见表1。这提示,如果脑损伤患者出现阵发性肌张力增高、瞳孔散大、高热、大汗、血压升高、心动过速、呼吸急促等临床表现,要想到PSH的可能。
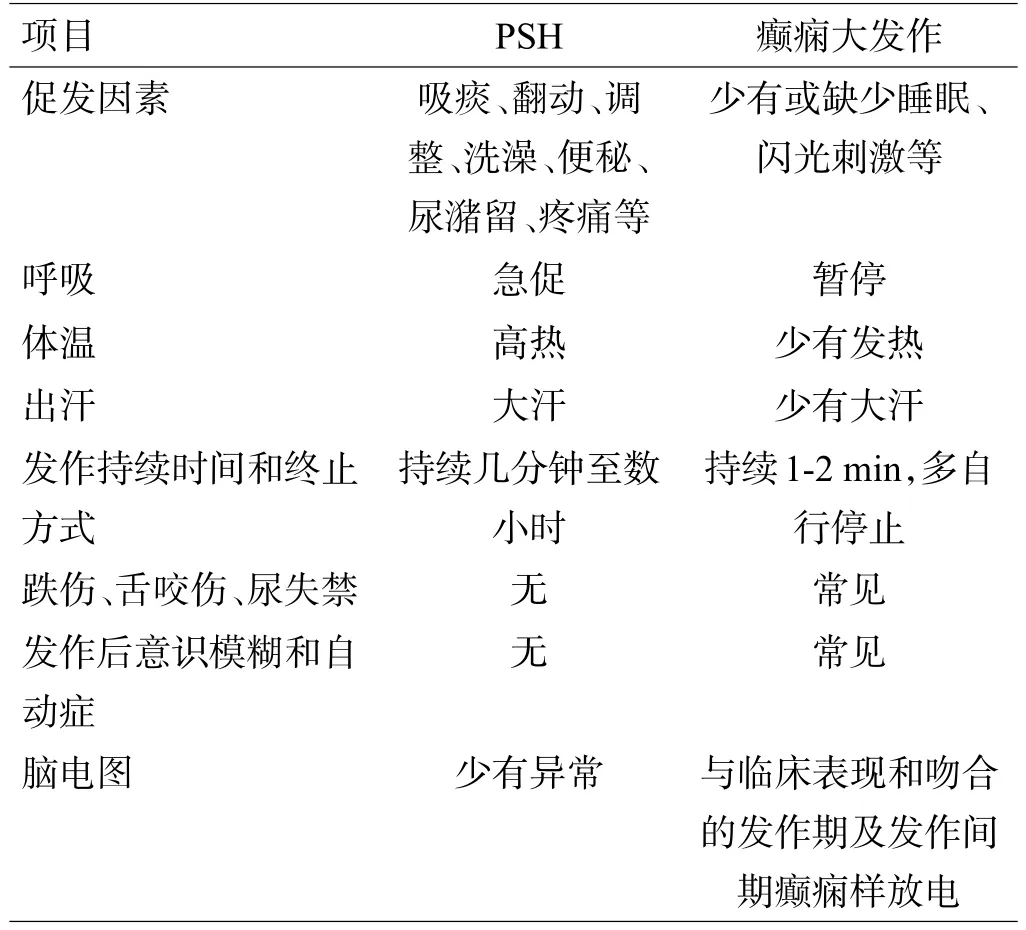
表1 PSH与癫痫大发作的鉴别
2.4 PSH的治疗
PSH发作的治疗主要是对临床症状的对症治疗,避免交感神经过度持续兴奋导致的损害。一般认为比较有效的药物都有特异性的靶点(细胞表面蛋白),其靶点为减轻中枢交感神经的传出,抑制传入感觉路径而限制疼痛超敏的发展,阻断交感神经系统的终端响应靶器官。用于治疗PSH的主要药物有阿片受体激动剂(吗啡)、GABA激动剂(加吧喷丁)、非选择性β-阻滞剂、多巴胺受体激动剂等。阿片受体激动剂(吗啡),临床作用迅速,可以快速阻止PSH的发作,但是易受剂量的影响。其治疗PSH的作用主要依赖于调节中枢通路和抑制交感神经的传出[6]。常用治疗PSH的剂量为1~8 mg。GABA激动剂,主要有巴氯芬、加巴喷丁、苯二氮类。巴氯芬主要应用鞘内注射治疗PSH,可以减少痉挛发作次数以及降低严重程度,缓解阵挛、疼痛和肌肉强直等症状。2012年1项研究[7]表明鞘内泵入巴氯芬治疗43例严重脑损害后6个月合并PSH常规非侵入药物治疗无效的患者,取得了良好的效果,平均最大剂量232.6 mg/d。有研究[8]表明口服巴氯芬治疗PSH无效。加巴喷丁通过抑制脊髓灰质和大脑皮质神经递质的释放,从而降低交感神经的过度兴奋。有文献报道[9]在治疗PSH过程中加巴喷丁比巴氯芬效果好。苯二氮类(劳拉西泮、咪达唑仑、地西泮)用于治疗PSH[9],作为肌松剂和控制情绪激动效果好。有文献报道[10],脑外伤患者PSH发作时血浆中儿茶酚胺浓度显著升高。非选择性β-阻滞剂(普萘洛尔),可透过血脑屏障,有效降低血浆中儿茶酚胺浓度及基础代谢率。对治疗PSH的临床症状(肌张力增高、高热、大汗、血压升高、心动过速)效果显著[11]。多巴胺受体激动剂(溴隐亭),作用在纹状体和下丘脑的多巴胺D2型受体而拮抗D1型受体,可减少温度阈值,减少多汗症状,并且可降压。其和阿片受体激动剂(吗啡)联合应用效果更好[10]。其他药物,如可乐定、美托咪啶、丹曲林对PSH发作的治疗也有一定的效果[12]。
PSH的非药物治疗,高压氧疗改善脑外伤患者的脑细胞的线粒体有氧代谢,降低死亡率[13]。有文献报道[14],引入高压氧疗治疗药物治疗效果不好的PSH患者,效果明显。本文2例患者采用药物联合应用效果明显,2例患者在药物的基础上引入高压氧疗治疗取得了良好的效果。
3 总结
PSH在各种脑损伤中发病率较高,且会增加住院时间及医疗费用,但因临床症状非特异,诊断标准不统一,易被误诊或漏诊。临床工作中如遇到脑损害患者合并阵发性肌张力增高、瞳孔散大、高热、大汗、血压升高、心动过速、呼吸急促等临床症状时,应考虑PSH的可能,完成相关疾病的鉴别诊断。PSH应采用多种药物、诊疗措施联合应用。
[1]Penfield W.Diencephalic autonomic epilepsy[J].Arch Neurol Psychiatry,1929,22:358-374.
[2]Spiriev T,Sandu N,Kondoff S,et al.Tic and autonomic symptoms[J]. J Neurosurg,2012,116:1397-1398.
[3]吴中亚,王炳国,葛成东.阵发性交感神经过度兴奋综合征3例报告及文献复习[J].中风与神经疾病杂志,2015,32:644-646.
[4]Lump D,Moyer M.Paroxysmal sympathetic hyperactivity after severe brain jnjury[J].Curr Neurol Neurosci Rep,2014,14:494-501.
[5]Iain E,Perkes DK,Nott MT,et al.Paroxysmal sympathetic hyperactivity after acquired injury:A review of diagnostic criteria[J].Brain Inj,2011, 25:925-932.
[6]Blackman JA,Patrick PD,Buck ML,et al.Paroxysmal autonomic instability with dystonia after brain injury[J].Arch Neural,2004,61: 321-328.
[7]Hoarau X,Richer E,Dehail P,et al.A 10-year follow-up study of patients with severe traumatic brain injury and dysautonomia treated with intrathecal baclofen therapy[J].Brain Inj,2012,26:927-940.
[8]Baguley IJ,Heriseanu RE,Gurka JA,et al.Gabapenttin in the management of dusautonomia following severe traumatic brain injury:a case series.J Neurol Neurosurg Psychiatry,2007,78:539-541.
[9]Ko SB,Kim CK,Lee SH,et al.Morphin-sensitive paroxysmal sympathetic storm in pontine intracerebral hemorrhage[J].Neurologist,2010,16: 384-385.
[10]Choi HA,Jeon SB,Samuel S,et al.Paroxysmal sympathetic hyperactivity after acute braininjury[J].Curr Neurol Neurosci Rep,2013,13: 370-379.
[11]Rabinstein AA,Benarroch EE.Treatment of Paroxysmal Sympatheticau Hyperactivity[J].Curr Treat Options Neurol,2008,10:151-157.
[12]Russo RN,O'Flaherty S.Bromocriptine for the management of autonomic dysfunction after severe traumatic brain injury[J].J Paediatr Child Health,2000,36:283-285.
[13]冯莹,方志成.脑外伤患者阵发性交感神经功能亢进的治疗进展[J].临床神经病学杂志,2015,28:388-390.
[14]Zhou Z,Daugherty WP,Sun D,et al.Protection of mitochondrial function and improvement in cognitive recovery in rats treated with hyperbaric oxygen following lateral fluid-percussion injury[J].J Neurosurg, 2007,106:687-694.
(本文编辑:唐颖馨)
R741;R747
ADOI10.16780/j.cnki.sjssgncj.2017.02.031
焦作煤业(集团)有限责任公司中央医院神经内科河南 454000
2016-10-09
黄宝和383299410@qq. com

