miRNA-21、miRNA-221、miRNA-222与脑胶质瘤发生发展的相关性
韩福新,张蕊,马善波,王彦刚
miRNA-21、miRNA-221、miRNA-222与脑胶质瘤发生发展的相关性
韩福新a,张蕊b,马善波c,王彦刚a
目的:研究miRNA-21、miRNA-221、miRNA-222与脑胶质瘤发生发展的相关性,为脑胶质瘤的早期诊断提供相关依据。方法:选取2011年4月至2015年4月第四军医大学第一附属医院西京医院收治的60例经病理证实为胶质瘤的患者作为实验组,分为低级别组(经检查肿瘤级别为I级和II级)和高级别组(经检查肿瘤级别为III级和IV级)。另选取15例经体检证实为健康人作为对照组。使用RT-qPCR检测3组血清miRNA-21、miRNA-221和miRNA-222含量,并且进行比较。结果:3组血清miRNA-21(F=5.497,P=0.006)、miRNA-221(F=7.615,P=0.001)和miRNA-222(F=6.304,P=0.003)含量差异有统计学意义;血清miRNA-21、miRNA-221含量在对照组最低,在高级别组最高,差异有统计学意义(P<0.05);血清miRNA-222含量高级别组高于对照组(P<0.05),而低级别组与对照组差异无统计学意义(P>0.05)。结论:脑胶质瘤患者的血清miRNA-21、miRNA-221、miRNA-222都呈高表达状态,提示其与脑胶质瘤的形成和发展有密切联系;监测血清miRNA-21、miRNA-221、miRNA-222的含量可以对脑胶质瘤患者的早期诊断、分级和预后评估等提供重要依据。
脑胶质瘤;微小核糖核酸-21;微小核糖核酸-221;微小核糖核酸-222
神经胶质瘤简称胶质瘤,由于常发生在患者的神经外胚层,所以也常称之为神经上皮肿瘤或神经外胚层肿瘤[1]。相关统计结果显示,70%的恶性肿瘤都为原发肿瘤[2]。近年来,高发生率和高死亡率使恶性肿瘤备受关注。在我国,胶质瘤的发病率在33.3%~60.0%,其中男性患者多于女性患者,每年有将近3万人死于该肿瘤[3]。虽然胶质瘤可以发生在任何年龄阶段,目前来看,患者多为成年人,30~40岁为肿瘤发病的高峰期[4]。发病的儿童占少数,一旦发病,多位于小脑。成人多见于幕上。胶质瘤为浸润型肿瘤,切除后常复发,患者的临床症状与患者的发病部位,肿瘤的病理类型和分期等密切相关[5]。最常见的胶质瘤症状为间断性头痛、颅内压增高、失明、精神改变、癫痫、视力减退、喷射性呕吐、性格改变、复视等,严重者还会出现大小便失禁和偏瘫等[6]。这些临床症状的出现大多是由于患者相应功能区受损,压迫或者侵蚀[7]。若胶质瘤患者能够得到早诊断、早治疗,患者的生命健康和生存质量将得到大大提高。
目前胶质瘤的确诊依靠术后组织病理检查,虽然影像学检查也能发现异常,但是很难分期,无法准确得知肿瘤的恶性程度。近年来,医学工作者们都在积极寻找相关肿瘤标志物。研究发现,miRNA与肿瘤干细胞的关系非常密切,对胶质瘤的诊断显得尤为重要而受到极大的关注[8]。miRNA可以调控很多转录因子和信号通路,作用于下游的靶蛋白,调控肿瘤基因或者肿瘤抑制基因的表达,影响肿瘤细胞的分化,增殖,转移和生长等。本研究探索了脑胶质瘤患者血清miRNA-21、miRNA-221和miRNA-222含量与肿瘤良恶性的关系,现将具体的研究过程和研究结果报告如下。
1 资料与方法
1.1 临床资料
将60例术后组织病理学检查证实为神经胶质瘤的患者纳入实验组。病理切片显示:I级胶质瘤8例(13.3%),II级胶质瘤10例(20.0%),III级胶质瘤18例(30.0%),IV级胶质瘤24例(36.7%)。低级别组包括I级和II级胶质瘤患者,18例;高级别组包括III级和Ⅳ胶质瘤患者,42例。对照组为经体检证实为健康人的非肿瘤者15例。
1.2 方法
1.2.1 提取血清总RNA采集3组患者的血液标本放置于-80℃保存。将3组血液标本离心后取血清部分,血清中RNA含量较低,为提高RNA获取率,采用mirvanaTMPARTSTM Kit进行提取。具体步骤:(1)在1.5 mL EP管中加入血清375 μL,再加入375 μL 2×Denaturing Solution后充分混匀,放置在冰上5 min;(2)加入650 μL酸酚氯仿,充分混匀;(3)在室温下离心5 min分离有机相和水相(1 mL);(4)将水相转移至新的EP管中,记录其体积;(5)将水相预热洗脱到95℃;(6)加入100%乙醇(水相的1.25倍),充分混匀。(7)放置过滤柱到收集管中;(8)吸取一定量乙醇和裂解液的混合物放置于过滤柱上,每个过滤柱仅限700 μL液体;(9)离心15 s后将混合物过滤,离心10 000 rpm;(10)重复此过程直到混合液完全过滤,收集;(11)使用700 μL miRNA的洗脱液洗脱过滤柱,离心;(12)在过滤柱上加入500 μL混
有乙醇的洗液,逐渐减少洗液的量,重复上一步骤;(13)弃去收集管中的液体,将过滤柱放置于收集管上,离心;(14)去掉剩余液体;(15)将过滤柱转移至新的收集管中,无核酸酶水或预热的洗脱液100 μL放置于过滤柱中心,盖上收集管管盖,离心,最后回收RNA;(16)收集系统池,冻存在-20℃或者直接使用。
1.2.2 使用紫外吸收测定患者血清RNA浓度RNA和蛋白质在波长260 nm和280 nm处测定相应物质的吸光度,推算出血清RNA的浓度和纯度。纯净的RNA样本其A260 nm/A280 nm比值大于2.0。有异硫酸胍污染时,A260 nm/A280 nm比值为0.5。当A260 nm/A280 nm比值较低时,说明样本中存在DNA或蛋白质的污染,应该再次提取。
1.2.3 RT-qPCR检查 根据测得的浓度取其3 μg总RNA设为模版,添加2 μl Random Rrimer中,同时加以10 μlDEPC处理水进行补足,经65℃变性3 min后即刻放在冰盒中;添加2μl的RNA酶抑制剂,3 μl的5×RT buffer,2 μl的Rever Tra Ace以及3 μl的dNTP。经25℃下反应3 min,再于40℃下进行反应1h,75℃下3 min对其中AMV逆转录酶进行灭活,10℃8 min。最终将所获取的cDNA产物放在-18℃条件下进行留存。按照表1配置PCR相关反应液。然后放入反应仪器,设置相关参数:95℃10 min,95℃15 s,60℃60 s,进行40个循环。半定量分析处理:采集3 μl扩增产物,并在含有1.0 μg/μl溴化乙锭的2%琼脂糖凝胶进行电泳操作。通过Quantity One软件对其面积灰度进行计算,将灰度值作为期表达水平,且经相应U6表达量对目的基因的相对表达量进行计算。

表1 PCR反应液体系
1.3 统计学处理
采用SPSS20.0软件处理数据,计量资料以(x±s)表示,两组间比较用t检验,多组间比较用方差分析。计数资料以率(%)表示,组间比较用卡方检验。P<0.05为差异有统计学意义。
2 结果
3组患者血清miRNA-21(F=5.497,P=0.006)、miRNA-221(F=7.615,P=0.001)和miRNA-222(F=6.304,P=0.003)含量比较差异有统计学意义;血清miRNA-21和miRNA-221含量在对照组最低,在高级别组最高,差异有统计学意义(P<0.05);血清miRNA-222含量在高级别组高于对照组(P<0.05),而低级别组与对照组差异无统计学意义(P>0.05),见表2,图1,2。

表2 3组血清miRNA-21、miRNA-221和miRNA-222含量比较(nmol/L,x±s)
图1 部分标本的RNA电泳图
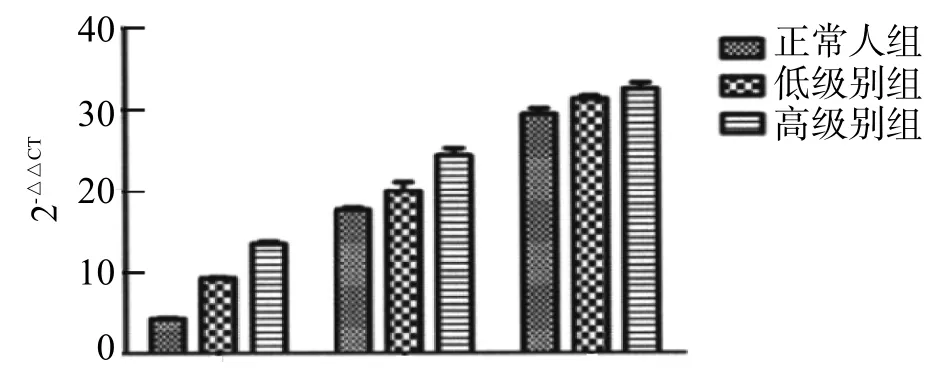
图2 3组血清miRNA-21、miRNA-221和miRNA-222含量比较
3 讨论
现今,治疗胶质瘤应用最广泛的方法是手术治疗辅以放化疗,这种治疗方法效果明确且可以降低患者的死亡率和致残率,提高患者术后生活水平和生存时间[8]。胶质瘤大多数的生长方式为浸润生长,医生在进行手术时难以分清正常组织和胶质瘤的界限,常常导致肿瘤无法完全切除,存在术后复发等一系列的难题[9]。所以胶质瘤患者在术后一般都会运用放疗和化疗等手段对患者进行进一步治疗。另有很多患者由于肿瘤接近功能区、病变较小或者患者的年龄大、并发症多、身体条件差等原因不进行手术治疗,而单纯采取放疗和化疗[10]。
在正常人和肿瘤患者的血清中都存在miRNA,并且可以对其进行定量检测。由于患者所患疾病的类型不同,其外周血中可以检测到的RNA的种类和表达的量都不一样。血液中miRNA是稳定存在的并且可以通过一定的方法定量检测,关于这一观点,可以通过以下3点对其进行证明:①血液中存在大量DNA酶或者RNA酶,可能导致miRNA被酶降解,但是大量实验研究证实,在血液中仍然可以定量检测到miRNA,说明血液中miRNA其实具有RNA酶的活性;②PCR扩增以后,miRNA的含量没有受到其他基因组的影响;③在使用RT-qPCR的方法检测血液中的miRNA时,就算人为将检测条件恶化,如将血液放置到强酸、强碱环境中,miRNA仍然能够被检测到[11]。所以miRNA在血液中存在十分稳定,具有作为特异性标志物的潜质。
虽然血液中稳定存在miRNA已经得到证实,但其来源还未可知。实验表明,外周血中miRNA分子大多数都与血液中的蛋白质结合存在,与蛋白质结合以后的miRNA稳定性很高,可以在一定程度上耐受核酸酶的催化和分解[12]。这些都是本次实验可以在血液中检测到特异性的miRNA分子的基础。
目前,检测miRNA的技术已经有了长期的发展,可行性也得到较大提高。现在检测新的miRNA分子的首选方法就是进行基因芯片的克隆测序,因为基因芯片具有高效性和快速性两大特点,还可以同时进行多种miRNA的检测[13-15],在目前应用较为广泛,但是这项技术也存在一些缺点,如灵敏度和特异度都不高,所以广泛应用于miRNA的初步筛选。这样筛选出来的特异性miRNA还需要进一步验证和定量,即进行Northern blot或者RT-qPCR。检测血液中miRNA最常用的方法就是使用RT-qPCR,这种方法需要选择合适的内参组作为对照,对内参的依赖性很大,但是可以提高结果的可靠性[15]。
本研究结果显示,对照组、低级别组和高级别组血清miRNA-21(F=5.497,P=0.006)、miRNA-221(F=7.615,P=0.001)和miRNA-222(F=6.304,P=0.003)含量比较差异有统计学意义;血清miRNA-21和miRNA-221含量在对照组最低,在高级别组最高,差异有统计学意义(P<0.05);血清高级别组高于对照组(P<0.05),而低级别组与对照组差异无统计学意义(P>0.05)。
综上所述,血清miRNA-21、miRNA-221和miRNA-222含量在胶质瘤患者中均较高。血清miRNA-21、miRNA-221和miRNA-222含量的测定为人胶质瘤的诊断提供了新的可靠依据。但还需要在恶性肿瘤的不同时期检测患者血清miRNA的表达量,提高胶质瘤诊断的准确性和特异性,使其成为早期胶质瘤诊断的好方法。
[1]石朔,张敏,郭睿,等.经钠碘同向转运体监测骨髓间充质干细胞向颅内脑胶质瘤迁移的实验研究[J].中华核医学与分子影像杂志,2015, 35:346-350.
[2]严钢莉,李朝武,聂海岭,等.miRNA-9过表达对Aβ损伤的PC12细胞的保护作用[J].神经损伤与功能重建,2015,10:12-15.
[3]Jiang XY,Xin HL,Ren QY,et al.Nanoparticles of 2-deoxy-d-glucose functionalized poly(ethyleneglycol)-co-poly(trimethylene carbonate)for dual-targeted drug delivery in glioma treatment[J].Biomaterials,2014,35: 518-529.
[4]晁腾飞,康慧聪,张佳璇.放射性脑损伤的胶质瘤患者的血浆miR-21水平研究[J].神经损伤与功能重建,2013,8:356-359.
[5]郭成永,梁朝辉,魏可欣,等.解旋酶RECQ1和细胞核相关抗原Ki-67在脑胶质瘤组织中的表达及相关性[J].中国老年学杂志,2015, 35:3259-3260.
[6]Gao HL,Yang Z,Zhang Sh,et al.Glioma-homing peptide with a cell-penetrating effect for targeting delivery with enhanced glioma localization,penetration and suppression of glioma growth[J].Journal of Controlled Release,2013,172:921-928.
[7]伍碧武,张义,汪洋,等.显微外科手术治疗丘脑胶质瘤及预后分析[J].中华神经外科杂志,2015,31:1201-1205.
[8]王明磊,王鹏,夏新舍,等.DTI示踪皮质脊髓束对脑胶质瘤术后放疗方案选择的影响[J].实用医学杂志,2015,31:610-613.
[9]Chen L,Miao W,Tang X,et al.The expression and significance of neuropilin-1(NRP-1)on glioma cell lines and glioma tissues[J].J Biomed Nanotechnol,2013,9:559-563.
[10]刘金剑,张玉民,杨翠红,等.酸敏感阿霉素前药纳米粒的合成及其在治疗脑胶质瘤中的作用[J].天津医药,2016,44:33-37.
[11]严勇,王洪祥,徐涛,等.多中心脑胶质瘤诊治的临床研究[J].中华医学杂志,2015,95:991-995.
[12]Zhang B,Shen S,Liao ZW,et al.Targeting fibronectins of glioma extracellular matrix by CLT1 peptide-conjugated nanoparticles[J].Biomaterials,2014,35:4088-4098.
[13]崔璨,王峰,邵国强,等.原位脑胶质瘤99Tcm-Galacto-RGD2 micro-SPECT/CT靶向显像研究[J].中华放射医学与防护杂志,2015,35: 881-885,952.
[14]晋晖.氢质子磁共振波谱在脑胶质瘤临床应用中的价值[J].中国老年学杂志,2015,35:1815-1816.
[15]Zhang B,Wang HF,Liao ZW,et al.EGFP-EGF1-conjugated nanoparticles for targeting both neovascular and glioma cells in therapy of brain glioma[J].Biomaterials,2014,35:4133-4145.
(本文编辑:雷琪)
R741;R742
ADOI10.16780/j.cnki.sjssgncj.2017.02.028
第四军医大学第一附属医院西京医院a神经外科;b耳鼻喉头颈外科;c药剂科西安 710032
2016-03-16
王彦刚hanfxqa@163.com

