法舒地尔对SH-SY5Y细胞氧糖剥夺后突触损伤的影响
张伟,张海飞,马杰,赵静,柴智,刘建春,宋丽娟,姜维佳,肖保国,4,马存根1,
法舒地尔对SH-SY5Y细胞氧糖剥夺后突触损伤的影响
张伟1,2,张海飞2,马杰1,2,赵静1,2,柴智3,刘建春3,宋丽娟3,姜维佳3,肖保国3,4,马存根1,3
目的:探讨法舒地尔(Fasudil)对人神经母细胞瘤细胞(SH-SY5Y)氧糖剥夺(OGD)后突触损伤的影响。方法:培养SH-SY5Y细胞,分为空白对照组、OGD组、OGD+法舒地尔组,各3皿。相差光学显微镜下观察细胞突触损伤及修复的细胞形态;Western-Blot检测ROCKⅡ、磷酸化肌球蛋白磷酸酶(p-MYPT1)、突触后致密物-95(PSD-95)、突触素(Synaptophysin)等蛋白的表达情况。结果:形态学显示法舒地尔可有效修复OGD诱导的神经突触损伤。OGD组ROCKⅡ及p-MYPT1的表达明显高于空白对照组(P<0.05),突触素及PSD-95的表达明显低于空白对照组(P<0.01)。OGD+法舒地尔组ROCKⅡ及p-MYPT1表达水平低于OGD组(P<0.05),而与对照组差异无统计学意义(P>0.05);突触素和PSD-95表达水平高于OGD组(P<0.01);PSD-95表达水平高于空白对照组(P<0.05),突触素的表达与空白对照组差异无统计学意义(P>0.05),结论:法舒地尔可有效修复OGD诱导的神经突触损伤,增加PSD-95、突触素的表达,抑制ROCKⅡ及p-MYPT1的表达。
法舒地尔;SH-SY5Y细胞;氧糖剥夺;ROCKⅡ;磷酸化肌球蛋白磷酸酶;突触后致密物-95;突触素
对于急性脑梗死,临床上除了早期静脉溶栓及桥接动脉取栓或溶栓治疗外,尚无特别有效的治疗方法,且能够及时接受上述治疗的患者极少[1-3]。寻求有效的治疗方法一直是关注的热点。
SH-SY5Y细胞来源于神经系统发育的神经嵴,是一种分化程度较低、繁殖快的肿瘤细胞。其细胞形态、生理及生化功能与正常神经细胞极为相似。现被广泛应用于神经系统疾病的发病机制及药物作用机制方面的研究[4-6]。氧糖剥夺(oxygen-glucose deprivation,OGD)是建立细胞缺血缺氧模型惯用的细胞建模技术[7]。近年来研究显示缺血缺氧损伤可通过激活Rho/ROCK信号通路进而引起神经元突起回缩、细胞骨架塌陷、细胞凋亡。有效地抑制Rho/ ROCK信号通路的激活则可促进神经细胞突起延长、细胞骨架重构,发挥修复作用[8]。本课题拟用OGD的方法处理SH-SY5Y细胞建立缺血缺氧损伤模型,体外模拟急性脑卒中的病理生理改变,然后给予Rho激酶抑制剂法舒地尔(Fasudil)干预,研究其形态学及突触素(synaptophysin)、突触后致密物-95(postsynaptic densities,PSD-95)的改变,为Rho激酶抑制剂法舒地尔治疗卒中,改善神经功能,预防卒中后认知功能障碍提供新的实验数据和理论基础。
1 材料与方法
1.1 材料
人神经母细胞瘤细胞SH-SY5Y神经元由复旦大学神经病学研究所肖保国教授友好提供,培养在DMEM完全培养液中(10%胎牛血清,1%双抗)。胎牛血清和双抗购于美国Gibco公司,抗磷酸化肌球蛋白磷酸酶(p-myosin phosphatase-1,p-MYPT1)抗体购于Cell Signaling Tech公司,BCA蛋白定量试剂盒购自碧云天生物技术有限公司;兔抗ROCKⅡ抗体(Anti-ROCK2 Rabbit pAb)购自BD Biosciences公司,兔抗突触素抗体(Rabbit Anti-Synapsin 1)购自Epitomics公司,抗PSD-95抗体(PSD-95 polyclonal antibody)购自Cell Signaling Tech公司;盐酸法舒地尔购于天津红日药业股份有限公司。
1.2 方法
1.2.1 实验分组 SHSY-5Y细胞以1×105/mL接种于10 cm2的培养皿中,加入DMEM培养液,并以100 mL/ L的浓度加入胎牛血清、以100 U/mL的浓度加入青霉素和链霉素(完全培养液),然后置于37℃、5%CO2恒温培养箱中,常规培养和传代。实验分为:空白对照组,OGD组,OGD+法舒地尔组,各3皿。
1.2.2OGD处理当细胞生长状态良好,细胞密度约60%时,进行OGD处理:空白对照组细胞在正常细胞培养条件下继续培养,OGD组细胞换成无糖完全培养液,置Forma Anaerobic System(Thermo,USA)进行OGD[N2/CO2/O2(94%/5%/<1%)]培养3 h,然后将液体换成含糖DMEM培养液继续培养。OGD+法舒地尔组则加入法舒地尔干预,浓度为15 μg/mL。3组细胞在正常细胞培养条件下继续培养24 h。
1.2.3 细胞形态学观察各组细胞在正常细胞培养条件下继续培养24 h后,在Olympus CK×41倒置相差显微镜下观察其突触损伤及修复情况。
1.2.4 蛋白表达测定各组细胞在正常细胞培养条件下继续培养24 h后,收集细胞离心(2 000 rpm,4℃,10 min),用PBS洗涤2次。然后,将沉淀细胞置于玻璃匀浆管中,在4℃条件下用组织裂解液提取蛋白,并测定和调整组织提取液中的蛋白浓度。制备SDS-PAGE 10%分离胶和5%浓缩胶。然后用微量加样器在凝胶小槽内加30 μg蛋白上样电泳分离。电泳完毕后采用BioRad标准湿式转膜装置进行转膜。转膜完毕后用5%脱脂牛奶封闭液室温封闭1 h,然后加入相应抗体:anti-ROCK II,anti-p-MYPT1,anti-突触素,anti-PSD-95和抗甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,4℃孵育过夜。次日洗膜后,加相应HRP耦联的抗兔和抗鼠的IgG室温孵育1 h,用BIO-RAD仪器进行化学发光法显色,将所得的谱带经Image--LAB软件分析相应的谱带灰度值,用GAPDH作为内参,得出各标本的谱带密度相对值,取各组平均值进行比较。
1.3 统计学处理
采用GraphPad Prism 6.0软件处理数据,计量资料以(x±s)表示,组间比较采用单因素方差分析和单尾检验,计数资料以率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义,P<0.01为差异显著,P<0.001为差异极显著。
2 结果
2.1 法舒地尔干预OGD损伤的SH-SY5Y细胞的形态学观察
正常培养的SH-SY5Y细胞胞体多数呈梭形或三角形,少数呈多边形,突触生长良好、伸展性好、连续性好、胞质清亮、贴壁能力强。OGD损伤后细胞胞体变小、形状不规则,突触明显受损,不连续,有断裂现象,胞质透光度增加、贴壁差。法舒地尔+OGD组细胞胞体接近正常胞体,可见部分受损突触得以修复,总体形态更接近于正常细胞形态,见图1。
2.2 法舒地尔干预OGD损伤的SH-SY5Y细胞的ROCKⅡ及p-MYPT1表达
Western blot显色谱带显示,OGD组ROCKⅡ及p-MYPT1的表达明显高于空白对照组(P<0.05),显示OGD可以诱导ROCK的表达和活性。OGD+法舒地尔组ROCKⅡ及p-MYPT1表达水平低于OGD组(P<0.05),而与对照组差异无统计学意义(P>0.05),见图2。提示法舒地尔抑制Rho/ROCK通路激活,减少其下游蛋白的表达。
2.3 法舒地尔干预OGD损伤的SH-SY5Y细胞突触素及PSD-95表达
Western blot显色谱带显示,OGD组突触素及PSD-95的表达明显低于空白对照组(P<0.01)。OGD+法舒地尔组突触素和PSD-95表达水平高于OGD组(P<0.01);PSD-95表达水平高于空白对照组(P<0.05),突触素的表达与空白对照组差异无统计学意义(P>0.05),见图3。
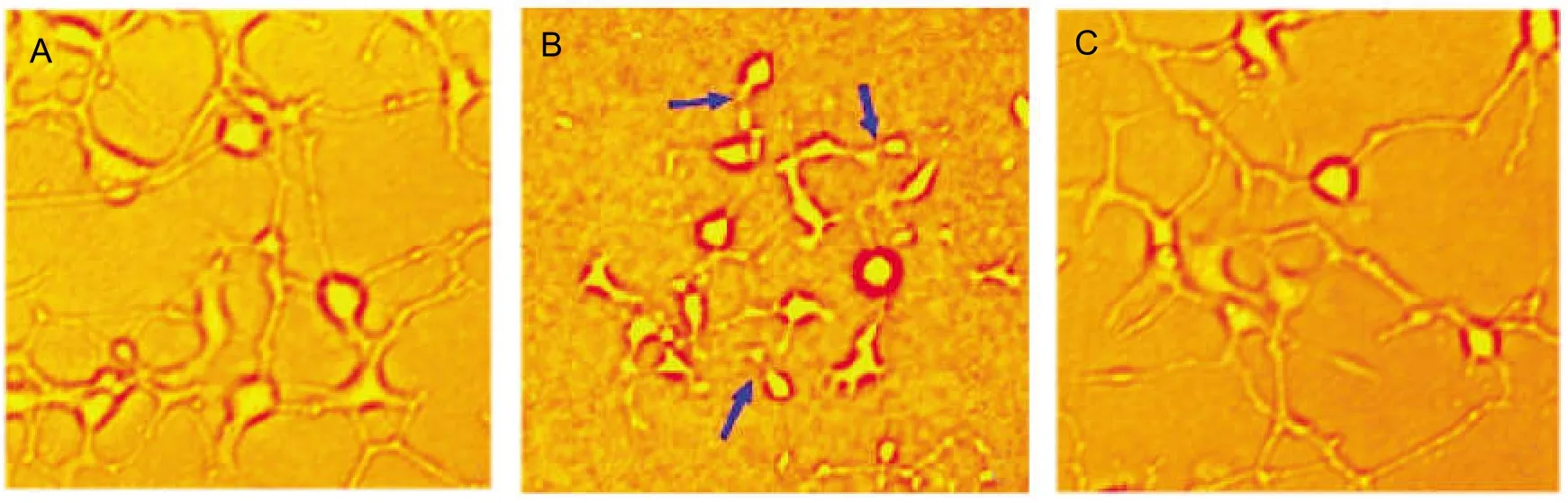
图1 法舒地尔干预OGD损伤SH-SY5Y细胞后形态学改变
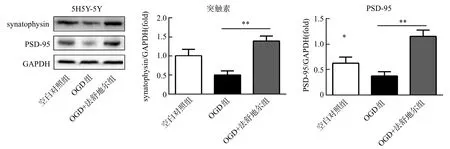
图3 法舒地尔干预OGD损伤的SH-SY5Y细胞突触素及PSD-95表达
3 讨论
神经细胞在缺血缺氧损伤情况下表现为细胞死亡和凋亡2种病理生理过程,研究显示在脑缺血后神经细胞凋亡在脑损伤中发挥着重要的作用,也是脑缺血损伤的重要发病机制之一[9]。细胞凋亡的重要病理环节包括细胞骨架坍陷、胞体缩小、突触受损、核凝集、染色体降解等[10]。而突触受损后修复包括内源性和外源性2种路径,内源性途径多与基因有关,外源性途径多与内环境和某些蛋白和信号通路激活有关[11]。通过实验笔者发现SH-SY5Y细胞在OGD损伤后表现为胞体变小、突触变细甚至断裂的现象,而经法舒地尔干预后突触有明显的再生和修复的迹象,细胞整体的形态接近于正常细胞。有理由相信Rho激酶抑制剂法舒地尔对缺血缺氧损伤的神经细胞具有修复的作用,特别是对受损的突触具有保护或再生的能力。同时本实验中也发现在OGD+法舒地尔组细胞的突触素和PSD-9表达显著高于OGD组,而ROCKⅡ、p-MYPT1的表达显著低于OGD组。推测法舒地尔可能是通过抑制Rho/ ROCK信号通路激活,从而增加突触相关蛋白突触素和PSD-95的表达,形成对细胞突触的保护和再生的作用。但Rho/ROCK信号通路与突触素和PSD-95确切关系尚不明确,有待进一步深入研究。
近年来大量研究证实脑缺血后可通过激活Rho/ ROCK信号通路引起神经元突起回缩、细胞骨架降解进而加速神经细胞凋亡。研究发现一氧化氮可以通过Rho激酶依赖的机制导致病理性突触丧失[12]。抑制Rho/ROCK信号通路则可促进神经元突起延长、细胞骨架重构,从而发挥保护作用[8]。ROCKⅡ是该过程中起主导作用的亚型[13],所以抑制ROCKⅡ的激活和表达也成为抑制Rho/ROCK信号通路的主要靶点。磷酸化肌球蛋白磷酸酶(p-MYPT1)是ROCK蛋白最具特殊意义的一个底物,常被用来评价ROCK的活性[14]。法舒地尔是目前在临床上唯一使用的ROCK抑制剂,在细胞水平可以调节细胞增殖、迁移黏附、细胞骨架重构、胞质移动、免疫细胞运动等,同时在分子基因水平还可调节炎症相关因子[15]。Feske等[16]研究发现,法舒地尔可以促进神经轴突生长、抑制炎性细胞的活化、减少炎性介质的聚集和释放、从而保护受损神经元。
突触素是与突触囊泡膜相联系神经元特异性磷酸蛋白家族中的一员,定位于前突触。突触素在中枢神经元突起的形成、延伸、连接、维护以及神经元极性形成过程中扮演着重要角色[17]。研究显示突触素可与多种具有SH3结构的蛋白质相结合,提示突触素可能与Rho蛋白的信号通路联系起来对神经元突触发挥作用。详细机制尚不明确,有待更加深入的研究[18]。PSD-95隶属于膜相关的鸟苷酸激酶(MAGUK)家族,主要参与突触的可塑性调节[19]。Gasco’n等[20]通过栓塞大鼠大脑中动脉1 h后再灌注24 h的动物实验中发现PSD-95在缺血侧皮质的表达显著低于非缺血侧皮质。这一结果与本研究结果基本一致,均提示脑缺血早期PSD-95表达减少。Chen等[21]通过用插线法制备大鼠2 h脑缺血模型,然后再灌注3 d后,通过脑立体定位技术分别将神经干细胞(neural stem cells,NSCs)以及胶质细胞源性神经生长因子基因修饰的神经干细胞(glial cell line-derived neurotrophic factor/neural stem cells,GDNF/NSCs)移植到同侧侧脑室,同时用生理盐水对照。分别在再灌注1、2、3、5和7 w后处死大鼠,通过免疫组织化学显色的方法观察脑缺血区域的突触素和PSD-95的表达,结果显示GDNF/NSCs组和NSCs组较对照组突触素和PSD-95的表达显著增加。他们认为NSCs移植后可能增强神经元功能以及促进神经环路的重建,从而促进梗死后神经功能障碍的恢复。
综上所述,Rho激酶抑制剂法舒地尔除了可有效改善微循环、抑制炎症反应、保护神经元之外,同时对受损神经元的突触具有良好的保护和修复功能,有望改善脑梗死患者的远期预后。
[1]姜平舟.超早期急性脑梗死应用阿替普酶静脉溶栓治疗的临床分析[J].中外医疗,2016,29:132-134.
[2]Fransen PS,Berkhemer OA,Lingsma HF,et al.Time to Reperfusion and Treatment Effect for Acute Ischemic Stroke:A Randomized Clinical Trial[J].JAMA Neurology,2016,73:1-7.
[3]Saver JL,Goyal M,Bonafe A,et al.Stent-retriever thrombectomy after intravenous t-PA vs.t-PA alone in stroke[J].NEJM,2015,372: 2285-2295.
[4]冯波,王蓉,盛树力.神经退行性疾病研究中拟神经细胞模型:人神经母细胞瘤株SH-SY5Y的来源特性及应用[J].中国组织工程研究,2006, 10:121-123.
[5]卢娜,白瑞樱,黄河,等.低氧预适应对氧糖剥夺损伤SH-SYSY细胞的保护作用[J].中国应用生理学杂志,2016,32:319-323.
[6]Hillion JA,Li Y,Maric D,et al.Involvement of Akt in preconditioning-induced tolerance to ischemia in PC12 cells[J].J Cereb Blood Flow Metab,2006,26:1323-1331.
[7]吴燕,丁爱石,吴丽颖,等.大鼠海马神经元体外缺糖缺氧模型的建立[J].中国应用生理学杂志,2003,19:197-200.
[8]张衡,房晓祎,林霓阳.Rho/Rho激酶信号通路介导新生大鼠神经元缺氧缺血损伤的作用机制研究[J].汕头大学医学院学报,2014,31: 23-25.
[9]罗素慧,张绪梅,黄国伟.缺氧诱导神经干细胞凋亡作用机制研究[J].天津医科大学学报,2013,19:89-92.
[10]Mehta SL,Manhas N,Raghubir R.Molecular targets in cerebral ischemiafor developing novel therapeutics[J].Brain Res Rev,2007,54:34-66.
[11]汪晶,朱青,胡波,等.中枢神经系统损伤后修复的内在机制研究[J].神经损伤与功能重建,2015,10:145-147.
[12]Sunico CR,Gonzálezforero D,Domínguez G,et al.Nitric oxide induces pathological synapse loss by a protein kinase G-,Rho kinase-dependent mechanism preceded by myosin light chain phosphorylation[J].J Neurosci, 2010,30:973-984.
[13]Koch JC,Tönges L,Barski E,et al.ROCK2 is a major regulator of axonal degeneration,neuronal death and axonal regeneration in the CNS[J]. Cell Death Dis,2014,5:e1225.
[14]侯绍蔚,刘岳婷,郭敏芳,等.盐酸法舒地尔治疗实验性自身免疫性脑脊髓炎的潜能与抗炎作用[J].中国临床神经科学,2012,20:126-134.
[15]Ishikawa Y,Nishikimi T,Akimoto K,et al.Long-Term Administration of Rho-Kinase Inhibitor Ameliorates Renal Damage in Malignant Hypertensive Rats[J].Hypertension,2006,47:1075-1083.
[16]Feske SK,Sorond FA,Henderson GV,et al.Increased Leukocyte ROCK Activity in Patients after Acute Ischemic Stroke[J].Brain Research, 2009,1257:89-93.
[17]Hosaka M,Hammer RT.A phospho-switch controls the dynamic association of synapsins with synaptic vesicles[J].Neuron,1999,24:377-387.
[18]辛洪启,陈乃宏.突触素在神经元发育过程中的作用[J].国际神经病学神经外科学杂志,2003,30:253-256.
[19]Komiyama NH,Watabe AM,Carlisle HJ,et al.SynGAP regulates ERK/MAPK signaling,synaptic plasticity,and learning in the complex with postsynaptic density 95 and NMDA receptor[J].J Neurosci,2002,22: 9721-9732.
[20]Gascón S,Sobrado M,Roda JM,et al.Excitotoxicity and focal cerebral ischemia induce truncation of the NR2A and NR2B subunits of the NMDA receptor and cleavage of the scaffolding protein PSD-95[J].Mol Psychiatry,2008,13:99-114.
[21]Chen B,Gao XQ,Yang CX,et al.Neuroprotective effect of grafting GDNF gene-modified neural stem cells on cerebral ischemia in rats[J]. Brain Res,2009,1284:1-11.
(本文编辑:唐颖馨)
Synaptic Protective Effect of Fasudil on SH-SY5Y Cells Synapses after Oxygen-glucose Deprivation
ZHANGWei1,2,ZHANGHai-fei2,MAJie1,2,ZHAOJing1,2,CHAIZhi3,LIUJian-chun3,SONGLi-juan3,
JIANGWei-jia3,XIAOBao-guo3,4,MACun-gen1,31.DepartmentofNeurology,FirstClinicalMedicalCollege, ShanxiMedicalUniversity,Shanxi030001,China;2.DepartmentofNeurology,TheFifthpeople’shospitalof Datong,Shanxi037009,China;3.“2011”CollaborativeInnovationCenter/ResearchCenterofNeurobiology, ShanxiUniversityofTraditionalChineseMedicine,Shanxi030024,China;4.InstituteofNeurology,Huashan HospitalFudanUniversity,Shanghai200025,China
Objective:To investigate the effect of Fasudil on synaptic regeneration and repair of SH-SY5Y cells after oxygen-glucose deprivation(OGD).Methods:SH-SY5Y cells were cultured,and randomly divided into three groups:control group,OGD group and OGD+Fasudil group.The morphology of synaptic injure and repair was observed by phase contrast microscopy,and the expressions of ROCKII,phosphorylated myosin phosphatase 1(p-MYPT1),postsynaptic density(PSD)-95 and synaptophysin were evaluated by western blot assay. Results:Compared with those in the control group,the cytological morphology and synapses were significantly injured in the OGD group,which were obviously restored to the normal state in the OGD+Fasudil group.Cells in the OGD group had higher expressions of ROCKII and p-MYPT1(P<0.05)and lower expressions of PSD-95 and synaptophysin(P<0.01)than those in the control group.Cells in the OGD+Fasudil group had lower expressions ROCKII and p-MYPT1(P<0.05)and higher expressions of PSD-95 and synaptophysin than those in the OGD group(P<0.01).The expression of PSD-95 in the OGD+Fasudil group was higher than that in the control group(P<0.05).The expressions of ROCKII,p-MYPT1 and synaptophysin showed no differences between the OGD+Fasudil group and control group(P>0.05).Conclusion:Fasudil promots synaptic regeneration and repair of SH-SY5Y cells after OGD condition.Fasudil increases the expressions of PSD-95 and synaptophysin,as well as decreases expressions of ROCKII and p-MYPT1 in SH-SY5Y cells.
Fasudil;SH-SY5Y;oxygen-glucose deprivation;ROCKII;p-myosin phosphatase-1;postsynaptic densities-95;synaptophysin
R741;R741.02
ADOI10.16780/j.cnki.sjssgncj.2017.02.002
1.山西医科大学第一临床医学院神经内科太原 030001
2.大同市第五人民医院神经内科山西 037009
3.山西中医学院“2011”协同创新中心/神经生物学研究中心太原 030024
4.复旦大学华山医院神经病学研究所上海 200025
国家自然科学基金2012年面上项目(No.81272163)
山西省回国留学人员重点科研资助项目(No.2014-重点7)山西中医学院“2011”培育计划项目(No.2011PY-1)
2016-12-02
马存根macungen2001@ 163.com

