急性腔隙性脑梗死患者cSVD负荷与颈总动脉环壁张力的相关性分析
袁晓东,熊建平,吴过
急性腔隙性脑梗死患者cSVD负荷与颈总动脉环壁张力的相关性分析
袁晓东,熊建平,吴过
目的:探讨急性腔隙性脑梗死患者脑小血管病(cSVD)负荷与颈总动脉机械动力学指标环壁张力(WT)的相关性。方法:选取急性腔隙性脑梗死患者113例为病例组,同时选取健康体检者100例为对照组,比较2组的cSVD负荷评分和颈总动脉机械动力学指标的差异;分析病例组的cSVD负荷评分与颈总动脉收缩期内径、颈总动脉舒张期末内径、收缩期最大WT、舒张期末WT的相关性。结果:病例组的cSVD负荷评分和颈总动脉机械动力学指标均高于对照组,差异均有统计学意义(P<0.05);病例组的cSVD负荷评分与颈总动脉收缩期内径、颈总动脉舒张期末内径、收缩期最大WT、舒张期末WT均呈显著正相关(P<0.01)。结论:病例组的cSVD负荷和颈总动脉WT异常增高,且cSVD负荷与颈总动脉WT密切相关。
急性腔隙性脑梗死;脑小血管病负荷;颈总动脉机械动力学;环壁张力;相关性
脑小血管病(cerebral small vessel disease,cSVD)是指病理改变主要累及颅内小血管如脑小动脉、微动脉、小静脉和毛细血管等的一组疾病,是脑血管病的重要组成部分。近十多年的研究表明,cSVD是一种常见的隐匿性脑血管病,容易被忽视,是造成老年人认知障碍、痴呆及卒中等疾病发生的病因之一[1,2]。随着临床神经影像学技术的不断提高,cSVD越来越受到临床研究者的关注,研究发现,cSVD影像学上主要表现为无症状腔隙性脑梗死、脑白质损害、脑微出血和扩大的血管周围间隙[3,4]。
目前普遍认为,动脉硬化是cSVD的发病机制之一,而大动脉缓冲衰减导致的脉冲血流和其对小血管造成的压力是引起小血管病理损伤的重要因素[5,6]。动脉硬化的血管功能和结构都发生改变,而局部机械应力的改变对其产生重要影响。在局部机械应力中,环壁张力(wall tension,WT)是导致血管功能和结构改变的最重要的机械应力之一[7]。环壁张力的升高,易引起血管壁拉伸和动脉肥大,导致动脉重塑。因此,探讨机械应力的变化对血管壁损伤带来的影响,将为脑小血管病的有效防治提供积极重要的临床意义。本研究旨在探讨局部机械应力指标环壁张力和cSVD负荷之间的相关性。
1 资料与方法
1.1 一般资料
收集2013年10月至2015年12月我院收治的急性腔隙性脑梗死(lacunar infarction,LI)患者113例为病例组,纳入标准:经临床和影像学检查确诊首发急性LI;颅脑MRI检查资料保存完整;患者家属签署知情同意书。排除标准:有心血管疾病、颅脑外伤、颅脑肿瘤及全身感染或严重器官功能不全;病情危重不能耐受MRI检查。年龄51~78岁,平均(61.58±8.75)岁;男81例,女32例;体质量指数(body mass index,BMI)(24.45±2.32)kg/m2;血糖(5.62±1.53)mmol/L,总胆固醇(4.53±1.58)mmol/L,甘油三酯(1.64±0.92)mmol/L;有吸烟史34例,饮酒史31例。同时选取在本院体检门诊健康体检的志愿者100例为对照组,年龄49~72岁,平均(60.21±9.24)岁;男64例,女36例;BMI(24.08±3.12)kg/m2;血糖(5.55± 1.72)mmol/L,总胆固醇(4.47±1.26)mmol/L,甘油三酯(1.45±0.80)mmol/L;有吸烟史38例,饮酒史35例。2组一般资料的差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 MRI检查采用德国西门子公司生产的1.5 T MRI对入选患者行颅脑扫描,头颅12通道正交线圈行T1、T2加权成像、弥散加权成像、液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列及磁敏感加权扫描。扫描参数:T1加权成像(TR/TE=2 025/ 8.4 ms),T2加权成像(TR/TE=4 000/94 ms),矩阵320× 201,视野193 mm×230 mm。
1.2.2 cSVD负荷评分cSVD负荷评分由影像学标记物共同组成:①脑白质病变(white matter lesion,WML)评分:按经典Fazekas分级法[8],深部白质出现Fazekas2级以上的改变或侧脑室周围出现Fazekas3级的改变,记为1分。②LI及腔隙评分:基底核、丘脑、皮质-皮质下或脑干部位出现的边界清楚的高信号改变,直径约为3~14 mm,且在FLAIR上出现高信号改变,记为1分。③脑微出血(cerebral microbleed,CMB)评分:磁敏感序列上的黑色信号病灶,出现圆形或卵圆形,直径为2~10 mm的低信号改变,记为1分,应注意与铁或钙沉积、外伤性弥漫轴索损伤或其他类似信号结构进行区别。④血管周围间隙扩大评分:T2高信号改变,出现边界清晰,圆形或卵圆形或线状的结构,且直径<3 mm的信号改变,且FLAIR无高信号环绕。扩大的血管周围间隙数目计数,按0~10、11~25、>25划分低、中、重3个等级;基底核层出现中或重度扩大的,记为1分。根据这4种影像学表现,形成0~4分的cSVD负荷评分体系,其得分在一定程度上反映cSVD影像学的严重程度。
1.2.3 颈总动脉机械动力学检查采用SSD-3500SV型多普勒超声诊断仪(购于日立阿洛卡医疗株式会社)和7.5 MHz的周围血管探头进行超声检查。患者平卧,头部后仰暴露颈部,距颈动脉球部约1 cm处测量颈总动脉最大收缩期内径和舒张末期内径。再调整角度测量收缩期峰值血流流速和舒张末期血流速度,若有斑块,则应在斑块上游进行测量。由2位经验丰富的操作者进行测量,以3个心动周期的平均值作为测量的最终结果。按照Laplace定律[9]计算舒张末期WT和收缩期最大WT:舒张末期WT=收缩压×舒张末期内径/2(dyne/cm2);收缩期最大WT=收缩压×最大收缩期内径/2(dyne/cm2);其中1 dyne/cm2=7.5×10-4mmHg。
1.2.4 观察指标比较2组的收缩压、舒张压的差异;比较2组的cSVD负荷评分、颈总动脉收缩期内径、颈总动脉舒张期末内径、收缩期最大WT、舒张期末WT的差异;以及病例组的cSVD负荷评分与颈总动脉机械动力学指标的相关性分析。
1.3 统计学处理
采用SPSS16.0统计软件分析数据,正态指标以(均数±标准差)表示,t检验、χ2检验,Pearson直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组血压比较
对照组和病例组的收缩压分别为(134.29± 16.61)mmHg、(148.65±15.36)mmHg,舒张压分别为(75.91±10.82)mmHg、(88.14±9.49)mmHg,病例组的收缩压和舒张压均高于对照组,有显著性差异(P<0.01)。
2.2 2组cSVD负荷评分和颈总动脉机械动力学指标比较
病例组的cSVD负荷评分和颈总动脉机械动力学指标均高于对照组,差异均有统计学意义(P<0.05),见表1。
2.3 病例组的cSVD负荷评分和颈总动脉机械动力学指标的相关性分析
Pearson直线相关结果显示,cSVD负荷评分与颈总动脉收缩期内径、颈总动脉舒张期末内径、收缩期最大WT、舒张期末WT均呈显著正相关(P<0.01),见图1A-D。
3 讨论
脑小血管是指脑的小穿支动脉和小动脉(直径40~200 μm)、毛细血管及小静脉,它们构成脑组织血供的基本单位,对脑功能的维持起重要作用。cSVD主要的临床表现为卒中(深部小梗死和脑出血)、认知和情感障碍、总体功能下降等。影像学主要表现为LI、腔隙(lacune)、WML、血管周围间隙扩大、CMB[10-12]。cSVD的发病机制的理论研究还不透彻,但因动脉硬化继发的脑小血管功能和结构损伤被普遍认为是重要的致病因素之一。局部机械应力发生变化,进一步加剧血管损伤。在cSVD疾病进展过程中WT成为关键因素之一。WT来源于跨壁压,是抵抗血管向外的扩张力,其升高降低受到血管功能、结构以及血压等因素的影响,血压升高,动脉扩张,WT升高;动脉壁增厚,WT降低。WT通过多途径影响动脉硬化的发生和发展。一方面增高的WT可刺激血管内皮细胞内基质金属蛋白酶的表达,促进微血管新生,从而导致内膜中膜增生,血管重塑。另一方面可加剧斑块内脂质的积聚,介导炎性反应,使斑块下内弹力板被降解,从而促使炎性细胞进入中膜,侵蚀胶原和弹力纤维,引起血管过度扩张重建[13,14]。
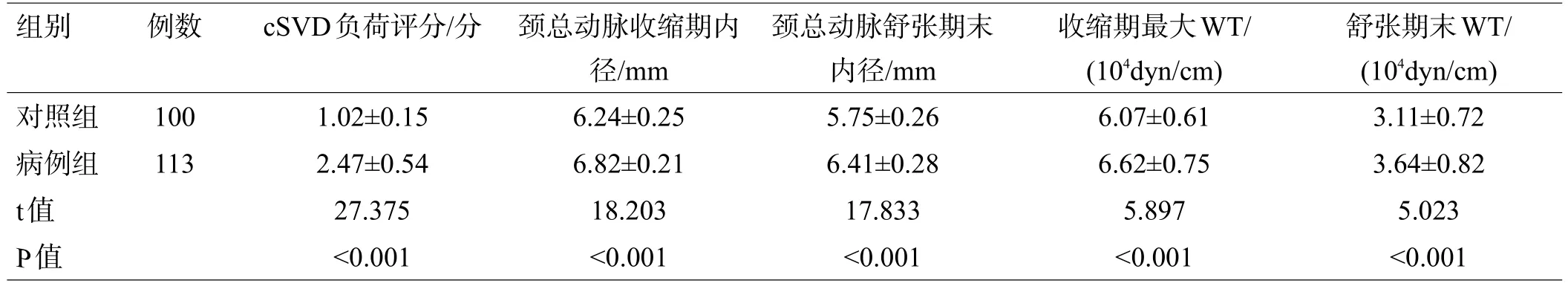
表1 2组cSVD负荷评分和颈总动脉机械动力学指标比较(x±s)
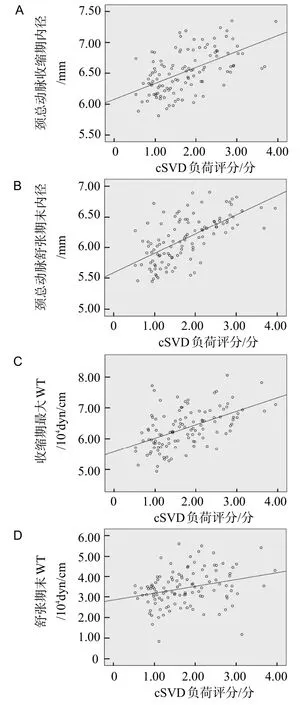
图1 散点图
cSVD负荷于近几年提出,其综合了CMB和血管周围间隙扩大这两种近年才被认可的亚临床标志物,是评价cSVD严重程度的系统性指标[15],它弥补了以前过度着眼于MRI单一cSVD标志物带来的研究偏颇,首次将4种cSVD作为一个整体进行评估。本研究显示,在矫正各项危险因素后,腔隙性梗死型cSVD负荷与颈总动脉机械应力WT呈显著正相关,病例组的cSVD负荷评分、收缩期最大WT、舒张期末WT明显高于对照组,提示WT在cSVD过程中的重要作用,也说明高WT介导的一系列血管内皮细胞的功能紊乱及血管功能和结构的变化,是导致cSVD发生发展的主要致病机制之一。陈后勤等[16]对WT和cSVD负荷两者之间的相关性也作了相似的研究,单因素分析显示年龄、高血压病史、糖尿病病史等传统脑血管病危险因素与cSVD负荷正相关;机械应力指标如收缩期WT、舒张期WT与腔隙性梗死患者的cSVD负荷亦呈显著正相关,揭示高WT对cSVD的重要影响。
本研究对腔隙性梗死cSVD负荷与颈总动脉机械应力WT之间的相关性进行了初步探讨,揭示了WT升高可能是造成小血管功能和结构损伤的重要原因之一,也是cSVD重要的发病机制之一。但因本研究为单中心横断面研究,样本量不足,且样本代表性不够,无法得出WT和cSVD负荷之间准确的因果关系,只能初步揭示两者之间的相关性。因此,临床需要更完善的多中心数据来进一步探讨WT改变和cSVD负荷之间的关系,为cSVD致病机理的研究提供详尽证据。
[1]Lam A,Hamilton-Bruce MA,Jannes J,et al.Cerebral small vessel disease:genetic risk assessment for prevention and treatment[J].Mol Diagn Ther,2008,12:145-156.
[2]Grau-Olivares M,Arboix A.Mild cognitive impairment in stroke patients with ischemic cerebral small-vessel disease:a forerunner of vascular dementia?[J].Expert Rev Neurother,2009,9:1201-1717.
[3]Heye AK,Thrippleton MJ,Chappell FM,et al.Blood pressure and sodium:association with MRI markers in cerebral small vessel disease[J].J Cereb Blood Flow Metab,2016,36:264-274.
[4]Benjamin P,Zeestraten E,Lambert C,et al.Progression of MRI markers in cerebral small vessel disease:Sample size considerations for clinical trials[J].J Cereb Blood Flow Metab,2016,36:228-240.
[5]Rincon F,Wright CB.Current pathophysiological concepts in cerebral small vessel disease[J].FrontAging Neurosci,2014,6:24.
[6]Caplan LR.Lacunar infarction and small vessel disease:pathology and pathophysiology[J].J Stroke,2015,17:2-6.
[7]Ihara M,Yamamoto Y.Emerging Evidence for Pathogenesis of Sporadic Cerebral Small Vessel Disease[J].Stroke,2016,47:554-560.
[8]Fazekas F,Kleinert R,et a1.Pathologic correlates of incidental MRl white matter signal hyperintensities[J].Neurology,1993,43:1683-1689.
[9]Okada Y,Kohara K,et al.Mechanical stresses,arterial stiffness,and brain small vessel diseases:Shimanami Health Promoting Program Study [J].Stroke,2014,45:3287-3292.
[10]Bridges LR,Andoh J,Lawrence AJ,et al.Blood-brain barrier dysfunction and cerebral small vessel disease(arteriolosclerosis)in brains of older people[J].J Neuropathol Exp Neurol,2014,73:1026-1033.
[11]Noriko S.Neuroimaging of cerebral small vessel disease[J].Brain Pathol,2014,24:519-524.
[12]曹江慧,刘广志,周军,等.脑微出血对急性脑梗死患者溶栓治疗后出血转化及功能预后的影响:一项Meta分析[J].神经损伤与功能重建, 2015,10:399-405.
[13]Hainsworth AH,Oommen AT,Bridges LR,et al.Endothelial cells and human cerebral small vessel disease[J].Brain Pathol,2015,25:44-50.
[14]Huang X,Kang X,et al.Evaluation of carotid artery elasticity changes in patients with cerebral small vessel disease[J].Int J Clin Exp Med, 2015,8:18825-18830.
[15]Pim K,Oostenbrugge RJV,Rouhl RP,et al.Ambulatory blood pressure in patients with lacunar stroke:association with total MRI burden of cerebral small vessel disease[J].Stroke,2013,44:2995-2999.
[16]陈后勤,倪白云,汪文兵,等.颈总动脉血流机械动力学与脑小血管病负荷的相关性研究[J].中华神经医学杂志,2015,14:662-664.
(本文编辑:王晶)
Correlation of cSVD Loads and Ring Wall Tension in Patients with Acute Lacunar Infarction
YUANXiao-dong,XIONGJian-ping,WUGuo.DepartmentofNeurosurgery,BazhongCenterHospital,Sichuan636000,China
Objective:To investigate the correlation of cerebral small vessel disease(cSVD)loads and mechanical dynamics index,the ring wall tension(WT),in patients with acute lacunar infarction.Methods:Total 113 cases of acute lacunar cerebral infarction(patients group)and 100 healthy controls(control group)were enrolled. The differences in the cSVD load score and the dynamic parameters of the common carotid arteries between the two groups were compared.The correlation of cSVD load score with the internal carotid artery systolic diameter, end diastolic diameter of common carotid artery,maximum systolic ring WT,and end diastolic ring WT was also analyzed.Results:The cSVD load score and the carotid artery mechanical dynamic indexes in the patients were significantly higher than those in the controls(P<0.05).The cSVD load score was positively correlated with the internal carotid artery systolic diameter,end diastolic diameter of common carotid artery,maximum systolic ring WT,and end diastolic ring WT in the patients(P<0.01).Conclusion:Patients with acute lacunar infarction show abnormally increased cSVD loads and circumferential WT of the carotid arteries with a close association.
acute lacunar infarction;loads of cerebral small vessel disease;carotid artery mechanical dynamics;circumferential wall tension
R741;R741.02
ADOI10.16780/j.cnki.sjssgncj.2017.02.004
巴中市中心医院神经外科
四川巴东636000
2016-04-25
袁晓东3112621770@qq. com

