内皮素-1及尿酸对妊娠期高血压疾病早期肾损伤的诊断价值
蔡静 张丹
·论著·
内皮素-1及尿酸对妊娠期高血压疾病早期肾损伤的诊断价值
蔡静 张丹
目的 探讨内皮素-1(endothelin-1,ET-1)及尿酸(uric acid,UA)水平对妊娠期高血压疾病(pregnancy induced hypertension,PIH)合并早期肾损伤的诊断价值。方法 选择2010年1月至2016年1月在武汉市妇女儿童医疗保健中心产科住院并确诊为PIH的303名妊娠妇女为妊高症组,同期选择100名定期体检的正常妊娠妇女作为正常对照组。依据24h尿蛋白(24h uru protein, 24h-Upro)水平将303例PIH患者分为轻度PIH(24h-Upro<0.3 g),中度PIH(0.3 g<24h-Upro<2 g)及重度PIH(24h-Upro≥2 g);另外根据肌酐清除率(creatinine clearance rate ,Ccr)水平评估PIH患者肾功能,将303例PIH患者分为肾损伤组(Ccr<80 ml/min)和肾功能正常组(Ccr≥80 ml/min)。观察ET-1及UA两种指标与PIH严重程度及肾功能损害的关系,并利用ROC曲线分析以上指标对PIH合并早期肾损伤的诊断价值。结果 妊高症组ET-1及UA水平明显高于正常对照组(P<0.01)。随着PIH病情严重程度加重,ET-1及UA水平明显升高(P<0.05)。单因素分析示,肾损伤组和肾功能正常组两组间ET-1(t=9.461,P<0.01)、UA(t=10.618,P<0.01)、收缩压水平(t=11.376,P<0.01)、舒张压水平(t=8.642,P<0.01)、肌酐(t=6.986,P<0.011)、Ccr(t=5.874,P=0.013)、同型半胱氨酸(t=12.873,P<0.01)、胱抑素C(t=7.014,P=0.010)差异有统计学意义。利用ET-1及UA对于诊断PIH的早期肾损害的ROC曲线示ET-1、UA曲线下面积分别为0.814、0.786,最佳阈值分别为81.35 ng/L、480.68 μmol/L,敏感度分别为0.772、0.822,特异度分别为0.806、0.786。结论 联合检测ET-1及UA水平对PIH早期肾损伤具有较高的诊断价值。
内皮素-1;尿酸;早期肾损伤;诊断价值
妊娠期高血压疾病(pregnancy induced hypertension,PIH)简称妊高症,是产科较为常见的合并症,临床上主要表现为高血压、蛋白尿、水肿、头痛等一系列综合征,严重者可出现昏迷、抽搐、颅内水肿等。PIH常出现在妊娠20周以后,随着病程进展最终可致孕妇全身各组织器官的不可逆性损伤,其中以肾脏受损最为显著[1]。有研究表明,肾损伤早期肌酐不能及时反映肾功能减退程度,从而导致PIH早期肾衰竭患者的漏诊及误诊[2]。妊娠期一旦出现肾功能不全易致早产、流产及死胎等严重不良后果[3]。因此,临床上寻找早期诊断PIH合并早期肾损伤的相关指标显得尤为重要[4]。本研究主要探讨联合检测内皮素-1(endothelin-1,ET-1)及尿酸(uric acid,UA)对PIH合并早期肾损伤的诊断价值。
资料与方法
一、研究对象
选择2010年1月至2016年1月武汉市妇女儿童医疗保健中心产科住院的303例PIH患者为妊高症组,年龄20~40岁,平均年龄为(26.7±4.7)岁,孕周>20周,平均孕周(23.8±1.5)周;其中妊娠期高血压177例,轻度子痫前期68例,重度子痫前期44例,子痫期14例。纳入标准:①所有患者均符合第6版《妇产科学》中的诊断标准[5];②均为单胎妊娠的初产妇;③入院前未经有效治疗,无严重心力衰竭、终末期肝肾等疾病;④签署知情同意书。排除标准:其他肾脏疾病如慢性肾小球肾炎、高血压肾病及糖尿病肾病等所致的肾功能异常。同期选择100名定期体检的正常妊娠妇女作为正常对照组,年龄20~40岁,平均年龄为(25.7±4.4)岁,孕周>20周,平均孕周(25.3±2.1)周。妊高症组与正常对照组患者的年龄、孕周、体质量等相关资料差异均无统计学意义(P>0.05),具有可比性。
二、方法
1.检测指标 收集303名PIH患者相关资料,如姓名、年龄、收缩压、舒张压、既往有无糖尿病及过期妊娠等病史;并于次日清晨抽取患者空腹静脉血液检测相关指标,如肌酐(SCr)、24h尿蛋白(24h uric protein, 24h-Upro)、ET-1、UA、同型半胱氨酸(homocysteine,Hcy)、空腹血糖(fasting blood glucose,FBG)、胱抑素C(Cystatin C,Cys-C)及留取24 h尿液行24h-Upro检测等;同时患者肌酐清除率(creatinine clearance rate ,Ccr)采用Cockcroft公式计算,即Ccr(ml/min)=[(140-年龄)×体质量(kg)]/[0.818×SCr(μmol/L)]×0.85。SCr测定采用肌氨酸氧化酶两点终点法,试剂盒由烟台奥斯邦公司提供;ET-1测定采用放射免疫法,试剂盒由武汉博士德有限公司提供;而24h-Upro、UA及其他相关生化指标均采用免疫比浊法;FBG及Hcy试剂盒由北京科美生物有限公司提供;而24h-Upro、UA、Cys C等试剂盒均由浙江省康特生物制药有限公司提供;以上各指标由我院检验科引进的日本日立OlympusAU640全自动生化分析仪进行检测。
2.相关标准 参考相关文献[6],依据24h-Upro水平分为轻度PIH(24h-Upro<0.3 g),中度PIH(0.3 g<24h-Upro<2 g)及重度PIH(24h-Upro≥2 g)。另外根据Ccr水平评估PIH患者肾功能,将303例PIH患者分为肾损伤组(Ccr<80 ml/min)和肾功能正常组(Ccr≥80 ml/min)。
三、统计学处理
利用SPSS19.0进行统计分析;正态分布的计量资料采用均数±标准差表示,方差齐的计量资料,两组间比较采用单独样本t检验,方差不齐的计量资料,两组间比较采用t′检验;计数资料采用率或构成比表示,组间比较采用卡方检验;运用ROC曲线下面积(AUC)评价各相关指标的诊断价值;均行双侧检验,P<0.05表示差异具有统计学意义。
结 果
一、妊高症组和正常对照组的ET-1、UA水平比较
妊高症组ET-1、UA水平明显高于正常对照组(P<0.01)。(表1)
二、ET-1、UA水平与PIH严重程度的关系
303例PIH患者中轻度PIH 124例,中度PIH 97例,重度PIH 82例。随着妊高症病情的严重程度升高,其患者ET-1、UA水平明显升高(P<0.05)。(表2)

表1 2组ET-1、UA水平比较
注:与妊高症组比较,aP<0.01

表2 妊高症患者ET-1、UA水平与病情严重程度的关系
注:与轻度相比,aP<0.05;与中度相比,bP<0.05
三、肾功能与相关指标的关系
入组的303例妊高症患者的中肾损伤者有112例,肾功能正常患者191例;2组间的ET-1、UA、收缩压水平、舒张压、肌酐、肌酐清除率、Cys-C、Hcy差异有统计学意义。(表3)
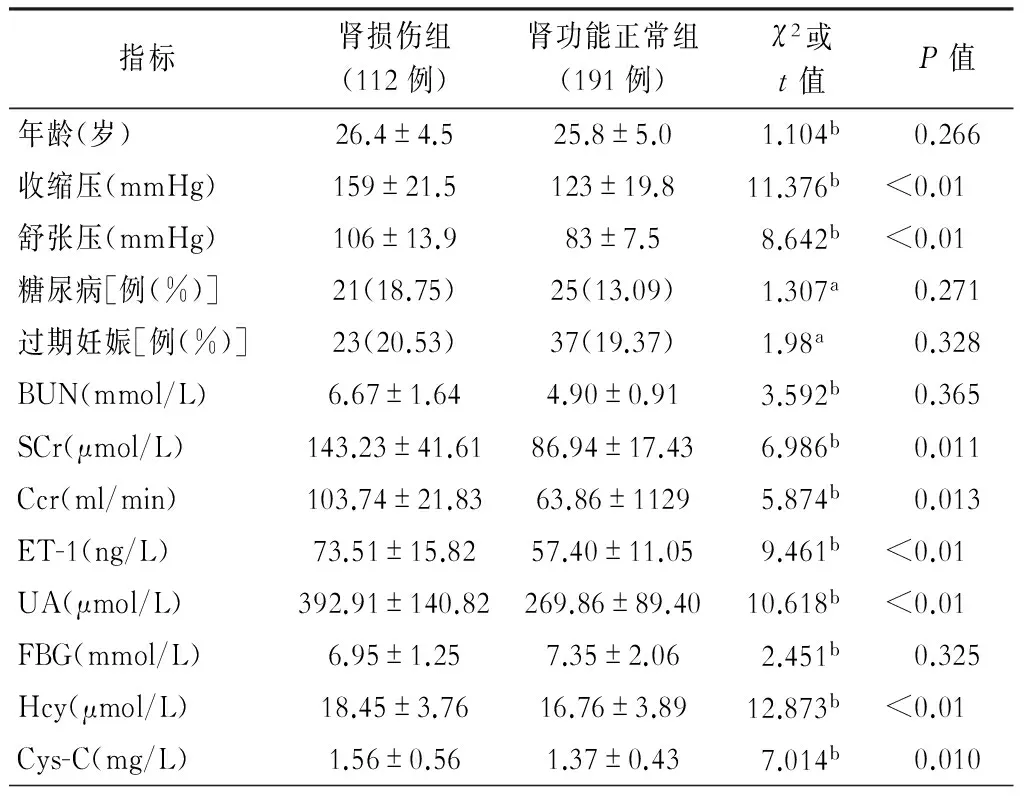
表3 肾功能与相关指标的关系
注:a为χ2值,b为t值
四、ET-1、UA诊断价值的ROC曲线分析
ROC曲线示,ET-1曲线下面积为0.814,最佳阈值为81.35 ng/L,敏感度为0.772,特异度为0.806;UA曲线下面积为0.786,最佳阈值为480.68 μmol/L,敏感度为0.822,特异度为0.78。(图1)
讨 论
目前关于PIH的发病机制尚未完全阐明,其中最为公认的发病机制为免疫失衡及血管内皮功能受
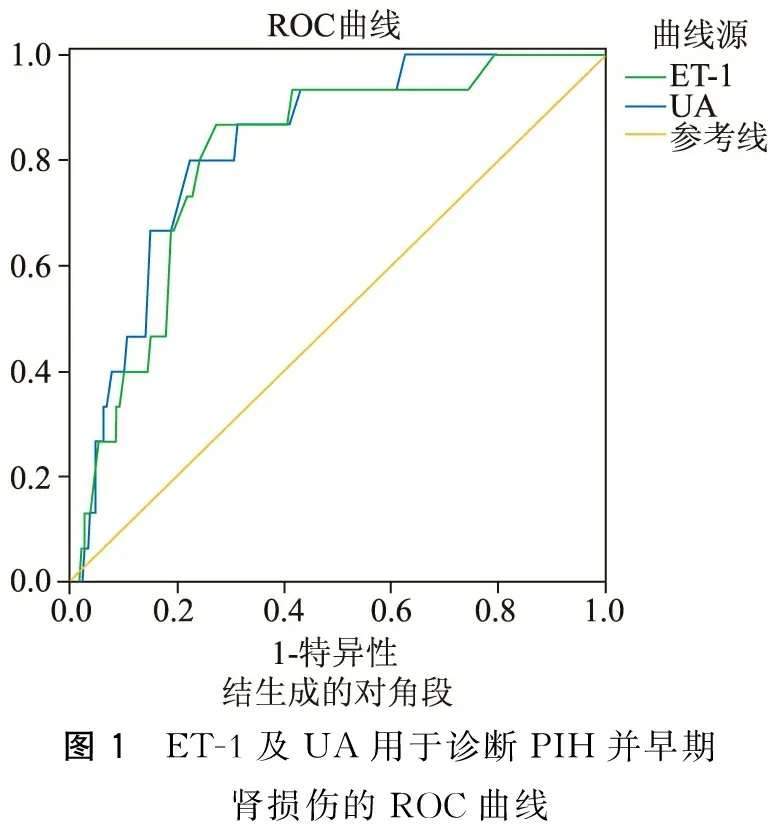
图1 ET-1及UA用于诊断PIH并早期肾损伤的ROC曲线
损等。PIH基本病理改变为全身细小动脉痉挛,各脏器有效灌注量锐减。当累及肾脏组织出现肾损伤时继而出现血压升高、全身水肿及蛋白尿等一系列综合征[7]。故寻找能够反映PIH早期肾损伤的诊断指标是近年来大多数研究者所关注的焦点[8]。
本研究中通过对妊高症组与正常对照组患者相关指标的比较发现,妊高症组患者ET-1、UA水平明显高于对照组(P<0.01),与肖云等[9]研究结果相符,说明妊高症可以导致妊娠期期妇女ET-1、UA水平明显升高。相关研究表明[10],PIH患者体内UA水平显著升高,且明显高于正常孕妇。UA是嘌呤核苷酸的最终代谢产物,主要通过肾脏排泄。当体内UA明显增多或肾排出障碍时均导致血UA升高。PIH患者因全身小动脉收缩,胎盘血流骤减,最终因黄嘌呤代谢紊乱而体内UA表达上调;另外,肾入球小动脉痉挛使肾小管缺血缺氧性损伤,血管通透性升高,最终UA滤过减少而体内含量上升[11]。ET-1具有收缩血管及促进血管平滑肌增生作用,为内源性血管活性物质之一,共同参与调节血流及血压变化[12]。PIH患者体内ET-1 表达上调,大量释放入血使血管内皮强烈收缩、痉挛,肾有效血流量骤减,最终导致肾损伤[13]。贾素娟等[14]研究证实PIH患者血清ET-1水平明显升高,随着病情进展恶化,ET-1 水平逐渐升高,尤其当肾脏损伤时ET-1升高最为明显。
本研究亦提示随着PIH病情严重程度的上升,ET-1及UA的水平也明显上升,说明ET-1及UA水平与PIH病情严重程度呈明显相关性,故可以用以上三者用于评估PIH患者的病情严重程度。另外通过将PIH患者的肾功能正常与否分为肾功能损害组及肾功能正常组,比较2组间基线资料与相关指标发现,2组间ET-1、UA水平差异具有统计学意义,说明可以通过上述3种指标用于诊断早期肾功能损伤程度。本结果亦发现,肾损害组与肾正常组间Cys-C与Hcy水平差异有统计学意义。Hcy可能通过损伤血管内皮细胞,使收缩血管因子增多而舒张因子减少,另外内皮细胞所致的血小板黏附聚集作用增强,与全身小血管痉挛收缩共同参与形成PIH[15],最终导致肾缺血性损伤。Cys-C是小分子蛋白质,在有核细胞内恒定表达,其在体内水平不受性别、年龄营养状态的影响[16]。生理状况下,Cys-C由肾小球完全滤过而不被肾小管重吸收及分泌[17]。Cys-C是反映肾小球滤过率较为敏感及特异的指标,目前已广泛用于评估早期肾功能损伤程度。本研究中在PIH合并早期肾损伤的单因素分析显示Hcy、Cys-C均是其危险因素(P<0.05),这与李欣等[18]研究结果相符。
综上可知,ET-1 及UA水平均与PIH患者病情严重程度呈显著相关性,且上述两种指标用于诊断PIH并早期肾损伤具有高度敏感性及特异性,这对于发现PIH患者早期肾功能损伤程度尤为重要,为早期治疗及改善患者预后提供重要指导作用,在临床上值得推广。
[1] Wang IK, Muo CH, Chang YC, et al. Association between hypertensive disorders during pregnancy and end-stage renal disease: a population-based study[J]. CMAJ, 2013, 185(3): 207-213.
[2] 王维俊, 陆薇. 血尿多项指标测定在妊娠期高血压疾病早期肾功能损害中的应用价值[J]. 中国妇幼保健, 2012, 27(19): 3034-3035.
[3] Zezza L, Ralli E, Conti E, et al. Hypertension in pregnancy: the most recent findings in pathophysiology,diagnosis and therapy[J]. Minerva Ginecol, 2014, 66(1): 103-126.
[4] Brown CM, Garovic VD. Drug treatment of hypertension in pregnancy[J]. Drugs, 2014, 74(3): 283-296.
[5] 李华. 妊娠高血压综合症患者产后并发肾损害的临床特点及相关因素分析[J]. 中国保健营养(下旬刊), 2014, 24(2): 709.
[6] 张焕改, 郭玮, 谷惠芳, 等. 孕母妊娠高血压对新生儿多系统的影响[J]. 临床儿科杂志, 2014, 32(11): 1042-1047.
[7] Palma-Reis I, Vais A, Nelson-Piercy C, et al. Renal disease and hypertension in pregnancy[J]. Clin Med, 2013, 13(13): 57-62.
[8] Mustafa R, Ahmed S, Gupta A, et al. A comprehensive review of hypertension in pregnancy[J]. J Pregnancy, 2012, 2012(4): 105918.
[9] 肖云, 沈漪萍, 王翠玉. 尿素氮、肌酐、尿酸联合检测在妊娠期高血压疾病肾损害评估中的应用[J]. 安徽医药, 2016, 20(5): 921-923.
[10]高慧, 蒙长虹, 于四勇. 血清C 反应蛋白、尿酸、尿蛋白水平与妊娠期高血压关系的研究[J]. 中国妇幼保健, 2011, 26(15): 2268-2269.
[11]李彦平, 武明虎. C 反应蛋白在慢性肾功能衰竭病程进展中的作用[J]. 山西医药杂志, 2005, 34(11): 943.
[12]Wolf D, Tseng N, Seedorf G, et al. Endothelin-1 decreases endothelial PPAR gamma signaling and impairs angiogenesis after chronic intrauterine pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(4): L361-371.
[13]Saleh MA, Pollock DM. Endothelin in renal inflammation and hypertension[J]. Contrib Nephrol, 2011, 172(172): 160-170.
[14]贾素娟, 高菲菲, 王丹. 内皮素-1、胱抑素C和一氧化氮对妊娠期高血压疾病早期肾损伤的诊断价值[J]. 河北医药, 2015, 37(9): 1330-1332.
[15]武春梅, 杜叶平, 尹莉莉, 等. 同型半胱氨酸与妊娠高血压疾病的相关性研究[J]. 国际检验医学杂志, 2013, 34(16): 2187-2189.
[16]郑淑华, 周才. 正常妊娠孕妇血清胱抑素C 水平变化分析[J]. 国际检验医学杂志, 2013, 34(4): 473-475.
[17]Obrenovicl R, Petrovic D, Majkic SN, et al. Serum cystatin C levels in normal pregnancy[J]. Clin Nephrol, 2011, 76(1): 174-179.
[18]李欣, 李楠. 同型半胱氨酸、胱抑素C、D-二聚体及超敏C反应蛋白与妊娠期高血压疾病的相关性探讨[J]. 陕西医学杂志, 2016, 45(2): 185-187.
Diagnostic value of ET-1 and UA in early kidney injury of pregnancy-induced hypertension
CAIJing,ZHANGDan.DepartmentofObstetricsandGynecology,WuhanChildren’sHospital
(WuhanmaternalandChildHealthcareHospital),TongjiMedicalCollege,HuazhongUniversityofScience&Technology,Wuhan430015,China
Objective To observe the diagnostic value of endothelin-1 (ET-1) and uric acid (UA) in early kidney injury of pregnancy-induced hypertension (PIH).Methods From January 2010 to January 2016, 303 PIH patients were enrolled to the Obstetrics and Gynecology Department of Wuhan Medical & Healthcare Center for Women and Children as PIH group, and 100 normal pregnant women served as control group. PIH group was assigned into mild with 124 cases, moderate 97 cases and severe 82 cases according to the severity of PIH. Then PIH patients were also divided into two groups: kidney injury group (n=112) and normal group (n=191) based on the kidney function. The relationship between the levels ET-1, UA with the severity of PIH and kidney injury was observed. The diagnostic value was verified on the risk factors by receiver operating characteristic (ROC) curve.Results The levels of ET-1 and UA in PIH group were significantly higher than in the control group (P<0.01). The levels of ET-1 and UA were related to the severity of PIH. Univariate analysis showed there was significant difference between kidney injury group and normal group in ET-1 (t=9.461,P<0.01), UA (t=10.618,P<0.01), systolic blood pressure (t=11.376,P<0.05), diastolic blood pressure (t=8.642,P<0.01), SCr (t=6.986,P=0.011), Ccr (t=5.874,P=0.013), Hcy (t=6.618,P<0.01), and Cys C (t=7.014,P=0.010); ROC curve analysis revealed that the optimal cutoff of ET-1 was 81.35 ng/L (AUC=0.814, sensitivity 0.772, specificity 0.806); and the optimal cutoff of UA was 480.68 μmol/L (AUC=0.786, sensitivity 0.822, specificity 0.786).Conclusions It is proven that the ET-1 combined with UA had an important value in diagnosing PIH patients with early kidney injury.
Endothelin-1; Uric acid; Early kidney injury; Diagnostic value
10.3969/j.issn.1671-2390.2017.01.007
430015 武汉,华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)妇产科
2016-08-11
2016-11-15)

