左卡尼汀通过激活Nrf2/ARE通路改善大鼠横纹肌溶解急性肾损伤
张媛媛 张建荣 耿燕秋 张艳霞
·实验研究·
左卡尼汀通过激活Nrf2/ARE通路改善大鼠横纹肌溶解急性肾损伤
张媛媛 张建荣 耿燕秋 张艳霞
目的 探讨左卡尼汀对大鼠横纹肌溶解急性肾损伤的保护作用及其作用机制。方法 取36只健康雄性成年大鼠,将其随机分为空白组、模型组及左卡尼汀治疗组,每组12只。模型组和治疗组通过肌肉注射50%甘油法(10 ml/kg)制备横纹肌溶解急性肾损伤模型,此外治疗组腹腔注左卡尼汀(200 mg/kg)。处死大鼠后心内采血并留取肾脏组织。应用自动生化仪检测血清肌酸激酶(creatine kinase,CK)、尿素氮(BUN)和肌酐(SCr)水平。光镜下观察大鼠肾脏组织的病理变化;用实时定量聚合酶链反应和免疫组化法分别检测大鼠肾脏组织的核因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)及血红素加氧酶(heme oxygenase 1,HO-1);酶联免疫吸附法检测大鼠肾脏组织的超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malonaldehyde,MDA)。结果 与空白组相比,模型组及治疗组的血清CK、BUN、SCr,肾脏组织的Nrf2、HO-1、MDA水平和急性肾小管坏死(acute tubular necrosis,ATN)评分明显升高,SOD水平明显下降,差异具有统计学意义(P<0.05);与模型组相比,治疗组血清CK、BUN、SCr,肾脏组织MDA水平和ATN评分明显降低,肾脏组织Nrf2、HO-1和SOD明显升高,差异具有统计学意义(P<0.05)。结论 左卡尼汀对横纹肌溶解急性肾损伤具有保护作用,其机制可能与激活Nrf2/ARE通路增强HO-1的表达及抑制MDA的合成有关系。
左卡尼汀;横纹肌溶解;急性肾损伤;氧化应激
横纹肌溶解(rhabdomyolysis,RM)是由于挤压、运动等原因所致横纹肌破坏,引起内环境紊乱的一组临床综合征,常可引起急性肾损伤(acute kidney injury,AKI)[1]。目前尚无能有效缓解RM致AKI的药物,患者预后也较差。研究发现,氧化应激参与了RM致AKI的发生发展[2]。左卡尼汀是机体内的一种特殊氨基酸,其基本生理功能是转运脂肪酸进入细胞线粒体,通过三羧酸循环为机体提供能量。研究表明,左卡尼汀具有抗氧化应激的作用[3]。本研究探讨左卡尼汀对RM致AKI的保护作用及其作用机制。
资料与方法
一、实验动物
健康雄性成年Sprague-Dawley(SD)大鼠,36只,平均体质量210 g,中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2012-0004。
二、分组及处理
将36只健康雄性成年大鼠随机分为空白组、模型组及治疗组,每组12只。空白组:不予特殊处理;模型组:双后侧肢肌注50%甘油(10 ml/kg),余无特殊;治疗组:双后侧肢肌注50%甘油(10 ml/kg)同时在24 h后腹腔注射左卡尼汀200 mg/kg。每组在肌注甘油后第48h、72h、96h各处死4只大鼠,心内采血并留取肾脏组织,1/4肾组织置于福尔马林液固定行肾脏病理检查,其余组织置于-80 ℃冰箱待测核因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)、血红素加氧酶(heme oxygenase 1,HO-1)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)。
三、血清指标检测
应用自动生化仪检测血清肌酸激酶(creatine kinase,CK)、肌酐(SCr)和尿素氮(BUN)。
四、制备切片
按照石蜡切片一般步骤制作石蜡切片。将切片进行HE染色,中性树脂封片,采用奥林巴斯光学显微镜读片并采集图像。就光镜下HE染色标本,对肾小管损伤进行评分。急性肾小管坏死(acute tubular necrosis,ATN)评分标准:每张切片×200倍镜下取10个视野,0=正常,1=轻微损伤(受损肾小管<5%),2=轻度损伤(受损肾小管5%~25%),3=中度损伤(受损肾小管25%~75%),4=重度损伤(受损肾小管>75%),半定量计算平均值,作为肾小管损伤的评分指数。
五、免疫组化法测肾脏组织Nrf2、HO-1
按照SABC法免疫组化染色,DAB显色显示阳性颗粒呈棕黄色,采用奥林巴斯光学显微镜观察并采集图像。用积分综合计量法计算出的结果评价免疫组化染色结果。即采用双盲法,每张切片×200倍镜下取10个视野,对染色强度进行评分:不着色为阴性记为0分,浅黄色为弱阳性记为1分,黄色为阳性记为2分,棕黄色为强阳性记为3分。每种阳性强度对应的值×该强度细胞的百分比,求和(1×弱阳性百分比+2×中等阳性百分比+3×强阳性百分比),0为阴性,0-1为弱阳性,1-1.5为中等阳性,大于1.5为强阳性。
六、实时定量聚合酶链反应测肾脏组织Nrf2、HO-1
按照产品说明书操作提取总RNA,进行反转录,再进行扩增反应,将PCR产物行琼脂糖凝胶电泳,采用凝胶图像分析系统进行半定量分析。Nrf2上游引物序列tcctctgctgccattagtca,下游引物序列gtgccttcagtgtgcttctg,退火温度58.8 ℃,产物长度107 bp;HO-1上游引物序列cagagtttcttcgccagagg,下游引物序列tgagtgtgaggacccatcg,退火温度59.78 ℃,产物长度1 168 bp;内参选用β-actin,上游引物序列ccacacccgccaccagttcg,下游引物序列ctagggcggcccacgatgga,退火温度66 ℃,产物长度140 bp。
七、酶联免疫吸附法测肾脏组织SOD、MDA
按照试剂盒步骤操作,据标准品的浓度及对应的OD值计算标准曲线的直线回归方程,再依据样品的OD值在回归方程上计算出其相对应的SOD、MDA样品浓度。
八、统计学处理
应用SPSS 17.0软件进行统计分析,正态分布资料以均数±标准差表示,组间比较用单因素方差分析法;非正态分布资料以中位数表示;P<0.05表示差异具有统计学意义。
结 果
一、血清指标比较
与空白组相比,模型组及治疗组CK、BUN、SCr均明显升高(P<0.05);与模型组相比,治疗组CK、BUN、SCr则明显下降(P<0.05)。(表1)

表1 不同时间段血清指标的比较 ±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05
二、肾脏组织变化
1.光镜观察 空白组:大鼠肾脏肾小球及肾小管结构完整,细胞形态正常。模型组:肾小球增大肿胀,肾小管上皮细胞变性坏死,管腔内有大量管型及细胞碎片,间质有大量炎性细胞。治疗组:肾小球结构基本完整,肾小管结构尚完整,细胞轻度变性、肿胀,管腔内偶见渗出物。 2.ATN评分 与空白组相比,模型组及治疗组ATN评分均明显升高(P<0.05),与模型组相比,治疗组,ATN评分则明显下降(P<0.05)。(表2)
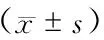
表2 ATN评分统计表
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05
3.肾脏组织Nrf2、HO-1的mRNA含量比较
与空白组相比,模型组及治疗组的Nrf2、HO-1的mRNA含量均明显升高(P<0.05);与模型组相比,治疗组的Nrf2、HO-1的mRNA含量明显升高(P<0.05)。(图1~2)

注:与空白组比较,aP<0.05;与模型组比较,bP<0.05图1 各组大鼠肾组织HO-1mRNA含量比较(A,x±s)
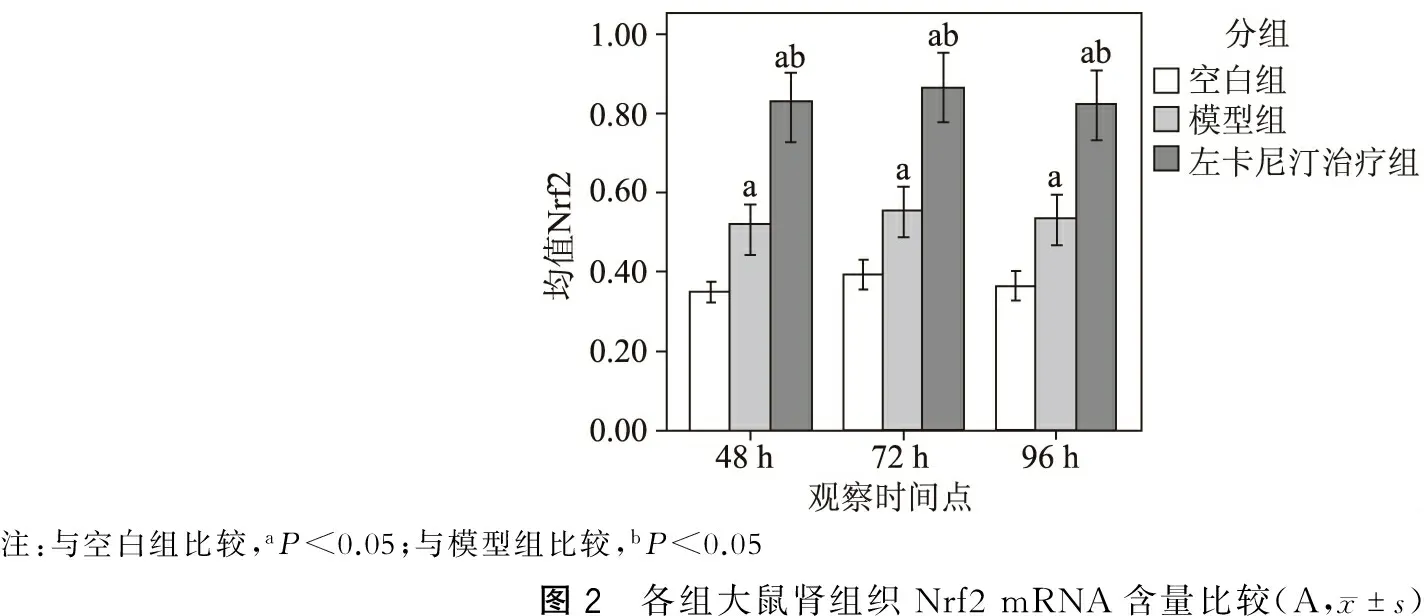
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05图2 各组大鼠肾组织Nrf2mRNA含量比较(A,x±s)
4.免疫组化检测肾脏组织Nrf2、HO-1 与空白组相比,模型组及治疗组的HO-1、Nrf2的含量均明显升高(P<0.05);与模型组相比,治疗组的HO-1及Nrf2的含量明显升高(P<0.05)。(表3)
5.左卡尼汀对大鼠肾脏组织SOD、MDA的影响 与空白组相比,模型组及治疗组SOD均明显降低(P<0.05);与模型组相比,治疗组SOD则明显升高(P<0.05)。MDA的变化则与SOD相反,与空白组相比,模型组及治疗组MDA均明显升高(P<0.05);与模型组相比,治疗组MDA则明显下降(P<0.05)。(表4)
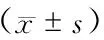
表3 各组大鼠肾组织Nrf2、HO-1定量比较
注:与空白组比较,F=88.91-173.46,q=6.89-16.88,aP<0.05;与模型组比较,q=5.88-12.12,bP<0.05
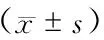
表4 各组大鼠肾脏组织SOD、MDA浓度
注:与空白组比较,F=45.23-163.80,q=5.42-18.93,aP<0.05;与模型组比较,q=4.15-15.39,bP<0.05
讨 论
RM是常见的肌肉损伤导致的肌红蛋白尿、电解质紊乱等临床综合症,常可导致AKI[4]。损伤肌肉释放的肌红蛋白本身具有过氧化物酶样活性,能使脂质、生物分子过氧化,并增加异前列腺素的产生,引起肾血管收缩导致肾脏灌注减少;同时随着肌红蛋白的降解,毒性代谢产物在酸性环境的作用下形成肌红蛋白管型,堵塞肾小管并使肾脏灌注减低;肌红蛋白亦诱导氧化应激反应[5-6]。大量的活性氧通过脂质过氧化反应损伤肾脏,其诱导产生的MDA可使蛋白质及DNA发生聚合从而损伤肾脏[7]。本研究即通过测定MDA的水平来反应机体脂质过氧化损伤的程度,间接反应细胞氧化损伤的程度,证实了脂质过氧化参与了RM致AKI的发病机制[1]。
机体拥有复杂的氧化应激应答系统来缓解自由基及有毒物质对机体的损伤,这是由保护性蛋白DNA上游调节区的抗氧化反应原件(antioxidant responsive element,ARE)来调控的[8-9]。Nrf2/ARE通路是迄今为止发现的机体最重要的内源性抗氧化应激通路[7]。近年来研究发现,Nrf2是ARE的激活因子[10]。Nrf2的缺失或者激活障碍均能加重氧化应激源对机体细胞的损伤,继而导致细胞功能障碍、凋亡以及死亡[9]。Nrf2包含一个高度保守的碱性亮氨酸拉链结构。Nrf2包括Neh1到Neh6,共6部分,其中Neh1是碱性亮氨酸拉链基本的序列,是Nrf2与ARE结合的区域[11,12]。在生理状态下,Kelch样氯丙烷相关蛋白(Keap1)与Nrf2蛋白结合,使其固定在细胞质内,由Cullin3-Rbx-E3连接酶介导Nrf2的泛素化,通过26s蛋白酶体降解使其在细胞质内保持低转录性[13-14]。细胞发生氧化应激时,Keap1改变构象使其与Nrf2解偶联,Nrf2转入细胞核内[14-15]。转入细胞核内的Nrf2与ARE结合,调节下游的基因转录,包括HO-1在内的抗氧化基因的表达[16]。肾功能受损时HO-1的表达增加是肾脏组织的一种自我保护机制[17]。HO-1是血红素降解的限速酶,可催化血红素生成胆红素、一氧化碳(CO)和铁,HO-1的抗氧化功能一方面表现在其阻止游离血红素参与氧化反应,另一方面表现在HO-1及其酶解产物胆红素、CO共同发挥清除自由基、抗脂质过氧化作用[4]。ARE是一个特异性的DNA-启动子结合序列,位于SOD和谷胱甘肽S-转移酶等保护性基因的5,端启动序列[18]。SOD是机体重要的抗氧化酶,在细胞抗氧化损伤中起着重要的作用。
左卡尼汀是一种结构上与氨基酸相似的维他命类似物,主要作用是转运长链脂肪酸到线粒体基质中进行β氧化及以ATP的形式供应能量。左卡尼汀可以清除氧自由基,缓解氧化应激反应,防止脂质过氧化产物的累积[19]。研究亦显示,左卡尼汀能够减轻脂质过氧化反应,从而减轻肾脏缺血再灌注损伤进而保护肾功能[20]。Uatundag等[21]的研究表明,左卡尼汀可以从功能、形态学、生物化学方面对RM致AKI具有保护作用。Barhwal等[22]的研究结果显示,左卡尼汀可以通过上调Nrf2/ARE通路,从而减轻海马神经元的氧化应激损害及低氧引起的神经退行性病变。本研究结果显示RM模型组的Nrf2及HO-1的表达均明显升高,证实了氧化应激可以激活Nrf2/ARE通路,亦即Nrf2/ARE通参与了RM所致AKI的发生发展;同时左卡尼汀组Nrf2、HO-1的表达均进一步升高,证实了左卡尼汀可以通过上调Nrf2/ARE通路对RM所致AKI具有保护作用。
综上所述,左卡尼汀对横纹肌溶解所致急性肾损伤具有保护作用,其机制之一可能与其上调Nrf2/ARE通路、增强HO-1的表达并增加SOD的合成及抑制MDA的合成有关系,从而发挥清除自由基及抗脂质过氧化等肾脏保护作用。
[1] 谢院生, 刘晓峦, 陈香美, 等. 横纹肌溶解致急性肾损伤的诊治[J]. 中国血液净化, 2009, 8(3): 120-123.
[2] Sere Yuksel, Mehmet Tugrul Sezer, Onder Sahin, et al. The Role of Carnitine in Preventing Renal Damage Developed as a Result of Infrarenal Aortic Ischemia- Reperfusion[J]. Ren Fail, 2011, 33(4): 440-449.
[3] Gül in I. Antioxidant and antiradical activities of L-carnitine[J]. Life Sci, 2006, 78(8): 803-811.
[4] Lima RS, da Silva Junior GB, Liborio AB, et al. Acute kidney injury due to rhabdomyolysis[J]. Saudi J Kidney Dis Transpl, 2008, 19(5): 721-729.
[5] Zager RA, Johnson AC, Becker K. Plasma and urinary heme oxygenase-1 in AKI[J]. J Am Soc Nephrol, 2012, 23(6): 1048-1057.
[6] Nadezda Petejova, Arnost Martinek. Acute Kidney Injury due to rhabdomyolysis and renal replacement therapy:a critical review[J]. Crit Care, 2014, 18(3): 224.
[7] Nadezda Petejova, Arnost Martinek. Acute Kidney Injury due to rhabdomyolysis and renal replacement therapy:a critical review[J]. Crit Care, 2014, 18(3): 224.
[8] 李航, 段惠军. Nrf2/ARE信号通路及其调控的抗氧化蛋白[J]. 中国药理学通报, 2011, 27(3): 300-303.
[9] 林晓萍, 李雯, 沈华浩, 等. 抗氧化应激转录因子-Nrf2的研究进展[J]. 中国病理生理杂志, 2011, 27(6): 1234-1239.
[10]Itoh K, Wakabayashi N, Katoh Y, et al.Keap1 regulates both cytoplasmic-nuclear shuttling and degradation of Nrf2 in response to eletrophiles[J]. Gence Cells, 2003, 8(4): 379-391.
[11]刘文博, 谭晓斌, 贾晓斌, 等. 基于Nrf2 通路的中药化学预防肿瘤的研究思路[J]. 中草药, 2011, 42(7): 1429-1434.
[12]潘晓菲, 谭初兵, 时丽丽, 等. Nrf2/ARE信号通路及其相关药物研究进展[J]. 药物评价研究, 2013, 36(1): 54-58.
[13]Kobayashi M, Li L, Iwamoto N, et al. The antioxidant defense system Keap1-Nrf2 comprise a multiple sensing mechnism for responding to a wide range of chemical compounds[J]. Mol Cell Boil, 2009, 29(2): 493-502.
[14]李奎, 高健刚, 祝海, 等. 左卡尼汀减轻大鼠肾缺血再灌注损伤及其机制的研究[J]. 中华器官移植杂志, 2012, 33(7): 430-434.
[15]Copple IM, Golding CE, Kitteringharn NR, et al. The Nrf2-Keap1 defense pathway:role in protection against drug-induced toxicity[J]. Toxicology, 2008, 246(1): 24-33.
[16]Wang Z, Shah SV, Liu H, et al. Inhibition of cytochrome P450 2E1 and activati- on of transcription factor Nrf2 are renoprotective in myoglobinuric acute kidney injury[J]. Kidney Int, 2014, 86(2): 338-349.
[17]Ferenbach DA, Ramdas V, Spencer N, et al. Macrophages expressing heme oxygenase-1 improve renal function in ischemia/reperfusion injury[J]. Mol Ther, 2010, 18(9): 1706-1713.
[18]Lee JM, Calkins MJ, Chan K, et al. Identification of the NF-E2- related factor-2-dependent genes conferring protection against oxidative stress in primary cortical astrocytes using oligonucleoti- demicroarray analysis[J]. J Biol Chem, 2003, 278(14): 12029-12038.
[19]Estaphan S, Eissa H, Elattar S, et al. A study on the effect of cimetidine and L-carnitine on myoglobinuria acute kidney injury in male rats[J]. Injury, 2015, 46(7): 1223-1230.
[20]Akin M, Kurukahvecioglu O, Gulbahar O, et al. Comparision of the effects of sodium nitroprusside and Lcarnitine in experimental ischemia-reperfusion injury in rats[J]. Transplant Proc, 2007, 39(10): 2997-3001.
[21]Ustundag S, Sen S, Yalcin O, et al. L-carnitine Ameliorates Glycerol- Induced Myoglobinuric Acute Renal Failure in Rats[J]. Ren Fail, 2009, 31(2): 124-133.
[22]Barhwal K, Hota SK, Jain V, et al. Acetyl-L-carnitine(ALCAR)prevents hypobaric hypoxia-indued spatial memory impairment through extracellular related kinase-mediated nuclear factor erythroid 2-related factor 2 phosphorylation[J]. Neuroscience, 2009, 161(2): 501-514.
Protective effect of L-carnitine on rhabdomyolysis-induced acute kidney injury via Nrf2/HO-1 activation
ZHANGYuan-yuan,ZHANGJian-rong,GENGYan-qiu,ZHANGYan-xia.
DepartmentofNephropathy,ChinesePeople'sArmedPoliceGeneralHospital,Beijing100039,China
ZHANGJian-rong,E-mail:Zhangjr0317@126.com
Objective To observe the protective effects of L-carnitine on renal function in rhabdomyolysis-induced acute kidney injury (AKI) in rats and the underlying mechanism.Methods Thirty-six adult rats were randomly divided into 3 groups: control group, AKI model group, and L-carnitine treatment group [rhabdomyolysis-induced AKI rats given L-carnitine (200 mg/kg)]. 50% glycerin was intramuscularlly injected to establish rhabdomyolysis-induced AKI models in rats. Blood samples were taken from the heart from rats and the kidneys were harvested. Serum creatine kinase (CK), blood urea nitrogen (BUN), serum creatinine (SCr) levels were measured, and renal pathological changes were observed under light microscope. RT-PCR and immunohistochemistry were used to detect the expression of Nrf2 and HO-1 in renal tissues. Enzyme linked immunosorbent assay (ELISA) was applied to detect the expression of SOD and MDA in renal tissues.Results As compared with control group, CK, BUN, SCr, Nrf2, HO-1, MDA and ATN were significantly elevated, and SOD was significantly reduced in model group and L-carnitine treatment group (F=8.78-200.77,q=5.42-19.40,P<0.05). As compared with model group, CK, BUN, SCr, MDA and ATN were significantly decreased, and Nrf2, HO-1 and SOD were significantly elevated in L-carnitine treatment group (q=4.15-15.39,P<0.05).Conclusions L-carnitine can ameliorate rhabdomyolysis-induced AKI, which may be related with its anti-oxidative stress.
L-carnitine; Rhabdomyolysis; Acute kidney injury; Oxidative stress
10.3969/j.issn.1671-2390.2017.01.012
重大灾害医学救援卫星综合应用服务示范项目[No.发改办高技(2013)2140号]
221004 徐州,徐州医科大学研究生学院(张媛媛);100039 北京,武警总医院肾内科(张建荣,耿燕秋,张艳霞)
张建荣,E-mail: Zhangjr0317@126.com
2016-06-13
2016-10-07)

