可溶性环氧化物水解酶抑制剂在TGF-β1诱导的人脐静脉内皮细胞内皮-间质转化中的作用*
郭亚男,杨海波,赵荫涛,刘 源,李 凌,周岩强
郑州大学第一附属医院心血管内科 郑州 450052
可溶性环氧化物水解酶抑制剂在TGF-β1诱导的人脐静脉内皮细胞内皮-间质转化中的作用*
郭亚男,杨海波#,赵荫涛,刘 源,李 凌,周岩强
郑州大学第一附属医院心血管内科 郑州 450052
#通信作者,男,1975年1月生,博士,教授,研究方向:心血管病介入治疗,E-mail:yanghaibo1975@126.com
可溶性环氧化物水解酶抑制剂;内皮-间质转化;脐静脉内皮细胞;心肌纤维化
目的:观察可溶性环氧化物水解酶抑制剂t-AUCB对TGF-β1诱导的人脐静脉内皮细胞(HUVEC)内皮-间质转化(EndMT)的影响。 方法:采用t-AUCB(50 μmol/L)预处理HUVEC 40 min后,用TGF-β1(10 μg/L)诱导HUVEC 24 h,采用Western blot法检测Smad2/3的磷酸化水平;诱导72 h后,光镜观察细胞形态的变化,采用CCK-8试剂盒检测细胞活性,采用实时荧光定量PCR检测内皮细胞标记物(CD31)、间质细胞标记物(collagen Ⅰ、 collagen Ⅲ、vimentin)及EndMT中重要的下游转录因子(snail1、twist1、twist2、ZEB1)mRNA的表达。同时设TGF-β1和t-AUCB单独作用组。结果:光镜下,TGF-β1组细胞转变为狭长形,细胞间隙疏松,TGF-β1+t-AUCB组、t-AUCB组细胞形态正常。TGF-β1组细胞CD31 mRNA表达下调,collagen Ⅰ、 collagen Ⅲ、vimentin mRNA表达上调,snail1、twist1、twist2、ZEB1 mRNA表达上调,Smad2及Smad3蛋白磷酸化水平升高(P<0.05)。与TGF-β1组比较,TGF-β1+t-AUCB组、t-AUCB组上述指标的表达均有一定程度的逆转(P<0.05)。结论:t-AUCB可通过抑制内皮细胞的EndMT而发挥抗纤维化作用。
creased(P<0.05). Compared with those of TGF-β1 group, the indexes mentioned above in TGF-β1+t-AUCB group and t-AUCB group showed reversed effect to a certain extent(P<0.05).Conclusion: t-AUCB has an anti-fibrosis effect on the HUVEC by inhibiting the progress of EndMT.
心肌纤维化是由各种病理情况下心肌成纤维细胞的过度增殖和细胞外基质的过度沉积造成的,表现为心肌微毛细血管密度的降低和心脏结构的改变[1],是临床上多种疾病包括心肌缺血、心肌病、高血压、糖尿病等常见的并发症和共同的病理表现。目前临床上尚无特异性的抗心肌纤维化治疗药物[2],因此寻找特异性的抗心肌纤维化药物,减少心肌重构成为当前研究的热点。研究[3]表明,心肌成纤维细胞除了来源于固有的成纤维细胞及祖细胞外,还可由骨髓来源的循环纤维细胞、单核细胞、周细胞及上皮细胞通过内皮-间质转化(endothelial-mesenchymal transition,EndMT)等转化而来,EndMT在心肌纤维化中的作用受到越来越多的重视[4]。多种信号通路可以调节EndMT的发生,其中TGF-β1/Smads信号通路是研究最为深入的一种[5]。可溶性环氧化物水解酶抑制剂(soluble epoxide hydrolase inhibitor,sEHI)与多种心血管疾病密切相关,它具有抗高血压[6]、减少心肌缺血再灌注损伤[7]、调节血脂[8]及抗心肌纤维化等作用。作者用TGF-β1诱导人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)发生EndMT,并观察sEHI干预对这一过程的影响,探讨sEHI与EndMT的关系。
1 材料与方法
1.1 细胞及主要仪器、试剂
1.1.1 细胞 细胞株HUVEC-12购自YRGene(NC006),用含体积分数10%胎牛血清的DMEM培养液在37 ℃、体积分数5%CO2培养箱中培养。当细胞贴壁约80%后用2.5 g/L胰蛋白酶消化并传代。实验前将细胞置于含有体积分数0.2%胎牛血清、0.1 g/L肝素及DMEM的无血清培养基中进行6 h的饥饿处理。
1.1.2 主要仪器、试剂 t-AUCB(sEHI)购自Cayman公司(分子式:C24H32N2O4,纯度≥99%,货号16568),取4.12 mg t-AUCB溶解于1 mL二甲基亚砜(DMSO)中配制实验所用母液(10 mmol/L),实验过程中DMSO在液体中的浓度低于0.02%。TGF-β1购自美国PEPROTECH公司,ECGS购自美国ScienCell公司,细胞毒性检测试剂盒CCK-8购自日本同仁化学;信号转导分子及其磷酸化分子抗体Smad2、Smad3、 p-Smad2、p-Smad3购自美国Cell Signaling Technology公司。多功能微孔板检测系统SynergyHT购自美国BioTek公司,紫外分光光度计NANODROP 2000c购自美国Thermo Scientific公司,反转录仪Veriti 96 well Thermal Lycler购自美国Applied Biosystems公司,实时荧光定量PCR仪Light Lycler 480购自瑞士Roche公司。
1.2 实验分组 实验分为3组,以仅用饥饿液持续培养的HUVEC作空白对照。TGF-β1诱导组:用含有TGF-β1(10 μg/L)的饥饿液持续培养HUVEC;t-AUCB组:HUVEC采用t-AUCB(50 μmol/L)预处理40 min后,继续采用含有TGF-β1(10 μg/L)与t-AUCB(50 μmol/L)的饥饿液持续培养;t-AUCB组:单用含有t-AUCB(50 μmol/L)的饥饿液持续培养HUVEC。培养24 h后,测定各组细胞中Smad2/3蛋白磷酸化水平;培养72 h后,进行细胞形态观察,并检测细胞活性及EndMT相关因子mRNA的表达水平。
1.3 细胞活性检测 采用CCK-8试剂盒进行细胞活性检测。细胞分组处理后,弃去培养基,在96孔板中加入含10 μL CCK-8的无胎牛血清培养基100 μL,于培养箱中孵育2.0~2.5 h,然后用酶标仪测定波长450 nm处的OD值。每组5孔。细胞活性=实验组OD/空白对照OD×100%。
1.4 Smad2/3磷酸化水平的检测 冰上裂解细胞10 min,置于1.5 mL离心管中,超声裂解仪5 kHz裂解10~15 s,4 ℃12 000 r/min离心15 min,将上清液移至离心管中,BCA定量检测蛋白浓度并将蛋白浓度调整一致后置于煮沸仪上将其变性。每组样本混匀后取10 μL行100 g/L SDS-PAGE凝胶电泳,检测内参GAPDH,根据OD值调整上样量,使其与GAPDH的OD值保持一致,之后每组以校正后的上样量进行凝胶电泳,将蛋白以恒压100 V 90 min后转移至PVDF膜上,用含50 g/L脱脂奶粉的TBST进行封闭,然后加一抗(p-Smad2、p-Smad3、Smad2、Smad3,抗体稀释度均为11 000)于4 ℃环境下孵育过夜,加入二抗室温孵育1 h,再用TBST洗3次,放入荧光检测仪中,应用Odyssey图像分析软件检测目的蛋白的OD值。以磷酸化蛋白与总蛋白表达水平的比值表示目的蛋白的磷酸化水平,以实验组与空白对照磷酸化水平的比值表示该组目的蛋白的磷酸化水平。
1.5 EndMT相关因子mRNA表达水平的检测 使用Trizol试剂按步骤提取细胞总RNA,取总RNA大约5 μL,以GAPDH为内参,应用Light Lycler 480实时定量PCR仪进行扩增,按照说明书操作,测定snail1、E盒结合锌指蛋白1(zinc finger E-box binding homeobox 1,ZEB1)、扭曲蛋白(twist)、Ⅰ型胶原蛋白(collagen Ⅰ)、Ⅲ型胶原蛋白(collagen Ⅲ)、波形蛋白(vimentin)、CD31 mRNA的表达。引物由上海生工生物工程技术有限公司合成,引物序列见表1。以目的mRNA与内参表达量的比值表示目的mRNA的相对表达水平,以实验组与空白对照相对表达水平的比值表示该组目的mRNA的表达水平。
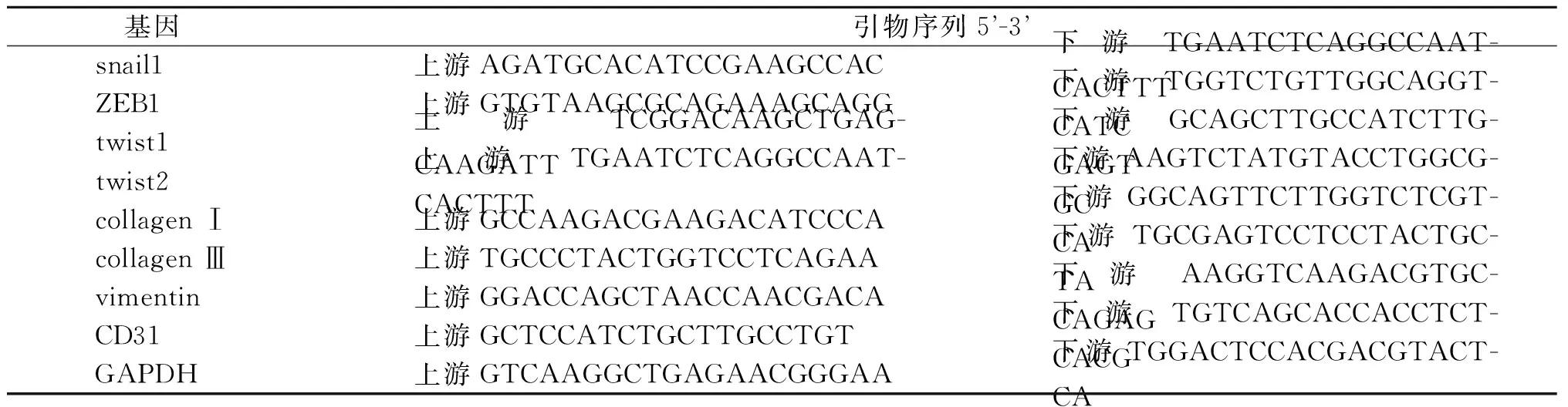
表1 引物序列
1.6 统计学处理 采用SPSS 19.0进行数据分析,3组间各指标的比较采用单因素方差分析,两两比较采用SNK-q法(方差齐)或Dunnett′s T3(方差不齐)检验,检验水准α=0.05。
2 结果
2.1 3组细胞活性的比较 TGF-β1组、TGF-β1+t-AUCB组、t-AUCB组细胞活性分别为(98.2±9.6)%、(99.1±13.2)%、(98.4±6.8)%,3组间比较,差异无统计学意义(F=0.989,P=0.011)。
2.2 3组细胞形态 光镜下,空白对照细胞间连接紧密,呈鹅卵石样。TGF-β1组细胞变狭长形,连接较松散。TGF-β1+t-AUCB组细胞形态为鹅卵石样,连接较紧密。t-AUCB组细胞形态与空白对照相似(图1)。
2.3 3组细胞Smad2/3蛋白的磷酸化水平 见图2、表2。
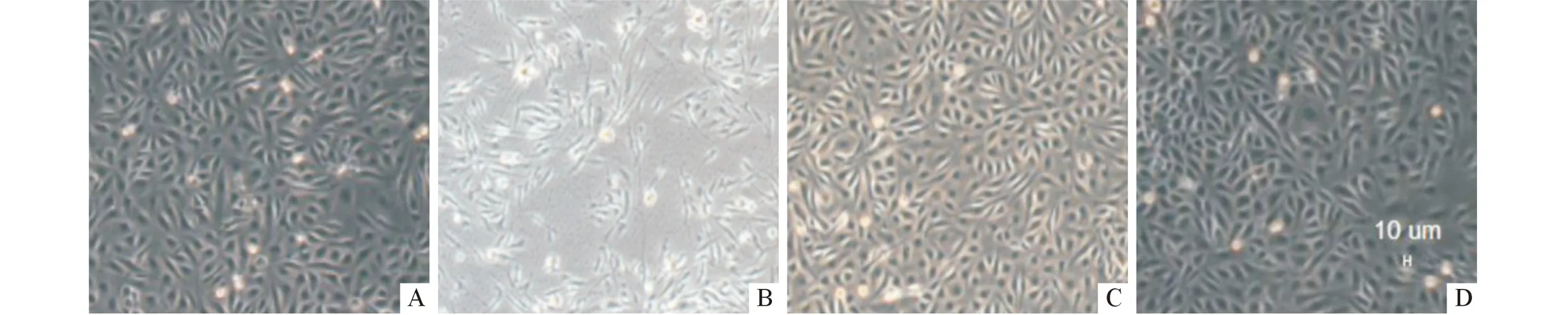
A:空白对照;B:TGF-β1组;C:TGF-β1+t-AUCB组;D:t-AUCB组。图1 不同处理因素处理后HUVEC细胞的形态(×400)
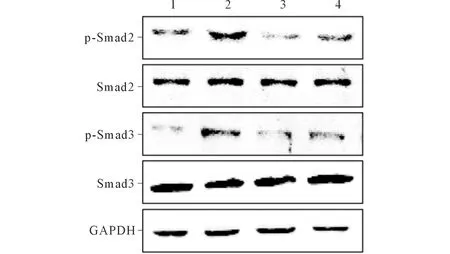
1:空白对照;2:TGF-β1;C:TGF-β1+t-AUCB组;D:t-AUCB组。图2 3组细胞Smad2/3蛋白磷酸化水平的检测
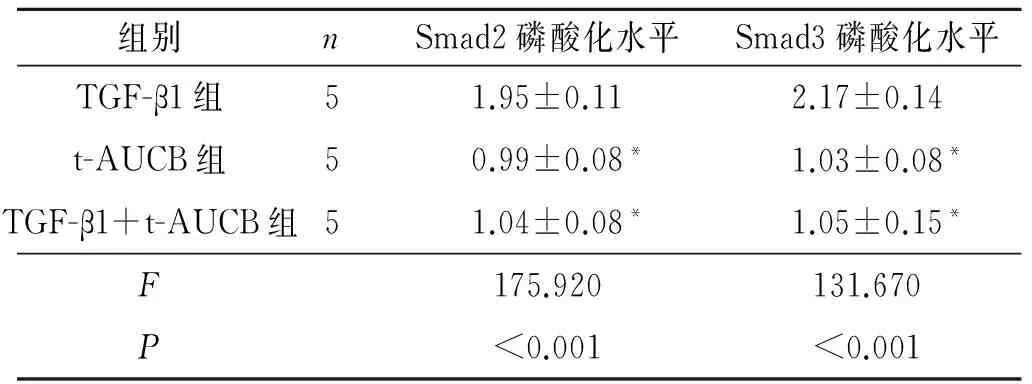
表2 3组细胞Smad2/3蛋白的磷酸化水平
*:与TGF-β1组比较,P<0.05。
2.4 3组细胞EndMT相关因子的表达 见表3、4。
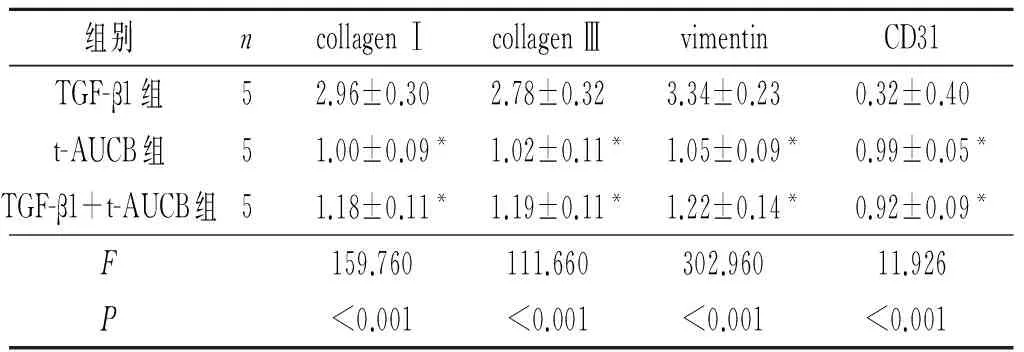
表3 3组EndMT过程中内皮和间质细胞标记物mRNA的表达
*:与TGF-β1组比较,P<0.05。
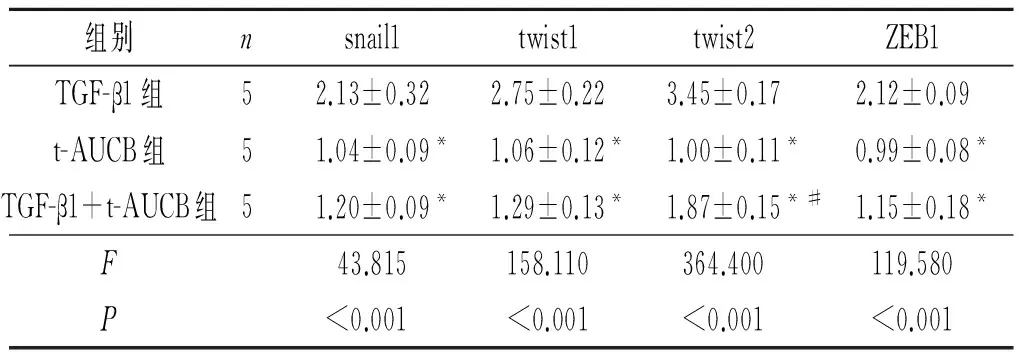
表4 4组EndMT过程中重要下游转录因子mRNA的表达
*:与TGF-β1组比较,P<0.05;#:与t-AUCB组比较,P<0.05。
3 讨论
心肌纤维化是由各种病理情况下心肌成纤维细胞的过度增殖和细胞外基质的过度沉积造成的,易引起心室壁顺应性及舒张功能的下降,最终可使心肌收缩功能受损而引起心力衰竭[9]。研究[3]表明,心肌成纤维细胞除了来源于固有的成纤维细胞及祖细胞外,还可由骨髓来源的循环纤维细胞、单核细胞、周细胞及上皮细胞等通过EndMT转化而来。相关研究[10]表明,经上皮细胞转化而来的成纤维细胞占成纤维细胞总数的30%左右。在EndMT过程中,内皮细胞逐渐失去极性和紧密连接的特性而变成狭长的梭形,且细胞间的连接变得疏松[11]。多种信号通路可以调节EndMT的发生,其中TGF-β1/Smads信号通路是研究最为深入的一种[5]。TGF-β1首先与胞外的受体结合从而引起Smad2/3磷酸化,然后磷酸化Smad2/3再与Smad4结合成复合物进入细胞核,与核内特异的DNA片段结合,调节ZEB1、snail、twist等下游转录因子的表达[12],从而促进EndMT的发生。sEHI与多种心血管疾病密切相关,它具有抗高血压[6]、减少心肌缺血再灌注损伤[7]、调节血脂[8]及抗心肌纤维化等作用。Xu等[13]发现sEHI可以通过阻断核因子κB而发挥抗心肌纤维化的作用。Sirish等[10]的研究证明sEHI可显著抑制心肌梗死后C57BL/6j小鼠的心肌纤维化并改善小鼠的心功能。然而sEHI在EndMT中的作用尚无人报道。因此,作者观察了t-AUCB(一种sEHI)干预对TGF-β1诱导的EndMT过程中HUVEC细胞活性及相关因子表达的影响,探讨sEHI在EndMT中的作用。
因Smad2及Smad3的磷酸化发生在较早期,在下游基因出现改变之前即有变化,而且预实验结果也支持TGF-β1刺激HUVEC 12 h后Smads信号通路的磷酸化水平较高,故该实验中选择在干预细胞24 h后检测Smad2/3磷酸化水平,选择在干预细胞72 h后检测下游基因的表达及细胞形态。预实验中作者选择了多个t-AUCB药物浓度,结果提示100 μmol/L t-AUCB干预可使细胞活性显著降低,而药物浓度≤50 μmol/L则无此影响,因此作者选择50 μmol/L的t-AUCB进行了后续实验。该研究结果表明,TGF-β1可引起HUVEC Smad2及Smad3蛋白的磷酸化水平显著升高,促进HUVEC细胞向间质细胞表型的转化,表现为内皮细胞标记物CD31 mRNA表达下调,间质细胞标记物collagen Ⅰ、collagen Ⅲ、vimentin mRNA表达上调,而EndMT下游转录因子snail1、twist1、twist2、ZEB1 mRNA的表达均显著升高。TGF-β1与t-AUCB联合干预后,HUVEC细胞间质转化过程部分被逆转。
综上所述,作者认为,t-AUCB可抑制TGF-β1诱导的HUVEC的EndMT,为t-AUCB在抗心肌纤维化治疗中的临床应用提供了更多的实验依据,但EndMT涉及多条信号通路及下游转录因子,该研究尚未就t-AUCB对其他信号通路的影响进行研究,同时也未能在动物模型中进行相关实验,因此还需进一步完善实验方案,以明确其作用机制。
[1]VASAN RS,BENJAMIN EJ.Diastolic heart failure:no time to relax[J].N Engl J Med,2001,344(1):56
[2]KRENNING G,ZEISBERG EM,KALLURI R.The origin of fibroblasts and mechanism of cardiac fibrosis[J].J Cell Physiol,2010,225(3):631
[3]BUJAK M,REN G,KWEON HJ,et al.Essential role of Smad3 in infarct healing and in the pathogenesis of cardiac remodeling[J].Circulation,2007,116(19):2127
[4]WIDYANTORO B,EMOTO N,NAKAYAMA K,et al.Endothelial cell-derived endothelin-1 promotes cardiac fibrosis in diabetic hearts through stimulation of endothelial-to-mesenchymal transition[J].Circulation,2010,121(22):2407
[5]FENG XH,DERYNCK R.Specificity and versatility in tgf-beta signaling through Smads[J].Annu Rev Cell Dev Biol,2005,21(21):659
[6]DAVIS BB,THOMPSON DA,HOWARD LL,et al.Inhibitors of soluble epoxide hydrolase attenuate vascular smooth muscle cell proliferation[J].Proc Natl Acad Sci USA,2002,99(4):2222
[7]QIN J,SUN D,JIANG H,et al.Inhibition of soluble epoxide hydrolase increases coronary perfusion in mice[J].Physiol Rep,2015,3(6):12427
[8]SHEN L,PENG H,ZHAO S,et al.A potent soluble epoxide hydrolase inhibitor, t-AUCB, modulates cholesterol balance and oxidized low density lipoprotein metabolism in adipocytes in vitro[J].Biol Chem,2014,395(4):443
[9]PORTER KE,TURNER NA.Cardiac fibroblasts: at the heart of myocardial remodeling[J].Pharmacol Ther,2009,123(2):255
[10]SIRISH P,LI N,LIU JY,et al.Unique mechanistic insights into the beneficial effects of soluble epoxide hydrolase inhibitors in the prevention of cardiac fibrosis[J].Proc Natl Acad Sci U S A,2013,110(14):5618
[11]MARKWALD RR,FITZHARRIS TP,MANASEK FJ.Structural development of endocardial cushions[J].Am J Anat,1977,148(1):85
[12]VALCOURT U,KOWANETZ M,NIIMI H,et al.TGF-beta and the Smad signaling pathway support transcriptomic reprogramming during epithelial-mesenchymal cell transition[J].Mol Biol Cell,2005,16(4):1987
[13]XU D,LI N,HE Y,et al.Prevention and reversal of cardiac hypertrophy by soluble epoxide hydrolase inhibitors[J].Proc Natl Acad Sci USA,2006,103(49):18733
(2016-06-23收稿 责任编辑王 曼)
Effect of soluble epoxide hydrolase inhibitor on endothelial-to-mesenchymal transition of human umbilical vein endothelial cells induced by TGF-β1
GUOYanan,YANGHaibo,ZHAOYintao,LIUYuan,LILing,ZHOUYanqiang
DepartmentofCardiology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
soluble epoxide hydrolase inhibitor;endothelial-to-mesenchymal transition;HUVEC;myocardial fibrosis
Aim: To observe the effect of soluble epoxide hydrolase inhibitor t-AUCB on TGF-β1 induced endothelial-to-mesenchymal transition(EndMT) of human umbilical vein endothelial cell(HUVEC). Methods: The HUVEC were pretreated by t-AUCB(50 μmol/L) for 40 min,then were induced by TGF-β1(10 μg/L) for 24 h,and Western blot was used to detect the phosphorylation levels of Smad2/3; after 72 h, light microscope was used to observe cell morphology, CCK-8 kit was used to test cell viability, and Real-time PCR was used to determine the mRNA expressions of epithelial marker(CD31) and mesenchymal markers(collagen Ⅰ,collagen Ⅲ,vimentin), as well as the key downstream transcription factors(snail1,twist1,twist2,ZEB1). TGF-β1 group and t-AUCB group were set.Results: The cells in TGF-β1 group changed into a long and narrow shape with intercellular porosis, while the cells in TGF-β1+t-AUCB group and t-AUCB group had normal forms. In TGF-β1 group,CD31 mRNA expression was down-regulated, but those of collagen Ⅰ, collagen Ⅲ, vimentin,snail1,twist1,twist2,and ZEB1 were up-regulated,and Smad2 and Smad3 protein phosphorylation levels in---------------------
10.13705/j.issn.1671-6825.2017.02.014
R542.2+3
*郑州大学第一附属医院院内青年创新基金项目

