GRP78、CHOP在α-细辛醚诱导的Eca109细胞凋亡中的作用*
王白燕,韩倩倩,朱艳琴,李 光,石佳佳
河南中医药大学基础医学院实验教学中心 郑州 450046
GRP78、CHOP在α-细辛醚诱导的Eca109细胞凋亡中的作用*
王白燕,韩倩倩,朱艳琴#,李 光,石佳佳
河南中医药大学基础医学院实验教学中心 郑州 450046
#通信作者,女,1956年11月生,硕士,教授,研究方向:中药抗肿瘤,E-mail:jc.zyqin@163.com
α-细辛醚;Eca109细胞;增殖抑制;凋亡;GRP78;CHOP
目的:研究葡萄糖调节蛋白78(GRP78)和C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(CHOP)在α-细辛醚诱导的人食管癌Eca109细胞凋亡中的作用。方法:采用0.25、0.50及1.00 g/L的α-细辛醚作用于体外培养的Eca109细胞,并以无干预的细胞作为对照。分别于培养后12、24、36、48 h,采用MTT法检测Eca109细胞的增殖抑制情况;采用免疫荧光染色法检测细胞凋亡情况;运用Real-time PCR和Western blot检测凋亡相关基因GRP78和CHOP的表达水平。结果:α-细辛醚对Eca109细胞的增殖具有抑制作用(P<0.05),且具有时间、剂量效应关系。α-细辛醚作用48 h后,GRP78和CHOP mRNA和蛋白的相对表达量明显增加(P<0.05)。结论:α-细辛醚可抑制Eca109细胞增殖和诱导细胞凋亡,其机制与调节内质网应激相关蛋白GRP78、CHOP表达有关。
食管癌(esophageal carcinoma,EC)是常见的上消化道恶性肿瘤,严重影响着人们的健康和生活质量[1]。食管癌的发生、发展是一个复杂的多因素综合作用的结果。α-细辛醚是中药石菖蒲挥发油中的主要活性成分,祖国医学认为石菖蒲有化痰开窍、镇静和抗惊厥之功效,可用于治疗癫痫[2]。也有文献[3]报道中药石菖蒲挥发油中的另一主要成分β-细辛醚在诱导肠癌细胞凋亡中起到了一定的作用,其机制可能与线粒体途径有关。而对于α-细辛醚抗肿瘤的研究尚未见报道。作者所在的课题组[4]在前期的研究中初步发现,α-细辛醚可诱导人食管癌Eca109细胞发生凋亡,该研究进一步对其凋亡机制进行探讨。
1 材料与方法
1.1 主要试剂和仪器 α-细辛醚注射液(批号201308,规格2 mg);Eca109细胞购自南京凯基生物科技发展有限公司;新生小牛血清购自杭州四季青生物工程材料有限公司;吖啶橙/溴化乙锭(AO/EB)双染试剂盒购自北京Solarbio公司;鼠多抗GRP78购自Abcam公司;鼠多抗CHOP购自Cell Signaling公司;鼠抗人β-actin单克隆抗体购自Santa Cruz公司;TECAN酶联免疫检测仪为Bio-Rad公司产品;全波长扫描式多功能读数仪为Thermo Fisher公司产品;生物分子成像仪为日本富士产品。
1.2 细胞培养与分组 取对数生长期的Eca109细胞,制成2×104mL-1的细胞悬液,接种于96孔板,分别用0.25、0.50、1.00 g/L α-细辛醚处理,不干预的作对照。每组设6个复孔,培养24 h后,进行药物干预。
1.3 MTT 检测细胞增殖抑制情况 细胞继续培养12、24、36、48 h后每孔直接加入MTT溶液20 μL,4 h后吸弃液体,加入150 μL二甲基亚砜,置摇床上低速振荡10 min,在酶标仪490 nm处测量各孔的吸光度(A)值,重复3次。细胞增殖抑制率=(1-实验组A值 / 对照组A值)×100%。
1.4 免疫荧光染色法检测细胞凋亡情况 用胰蛋白酶消化培养48 h、贴壁生长的细胞。收集细胞,PBS洗涤2遍,1 500 r/min离心5 min,弃上清液,加入50 μL PBS重悬;按AO/EB双染试剂盒说明书染色,吸取混合液10 μL,滴于载玻片上,盖玻片封片,在510 nm波长处激发荧光,倒置荧光显微镜下观察。
1.5 Real-time PCR法检测GRP78和CHOP mRNA的表达 培养48 h后,取对数生长期的细胞,按说明书提取细胞总RNA,反转录合成cDNA。反应体系:2 × Ultra SYBR Mixture 10 μL,上、下游引物各0.5 μL,cDNA 2 μL,无菌水7 μL,总体积20 μL。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。引物序列见表1。每个样本设3个复孔和2个阴性对照,mRNA含量根据各个样本的β-actin含量进行标准化,结果用相对定量2-ΔΔCT法分析。
1.6 Western blot法检测GRP78和CHOP蛋白的表达 培养48 h后,收集各组细胞用PBS洗涤2遍,弃上清,常规冰浴裂解50 min,14 000 r/min离心5 min,取上清即为细胞总蛋白样品,BCA法测定蛋白浓度。每孔上样量为30 μg蛋白,SDS-PAGE凝胶电泳的分离胶浓度为120 g/L,蛋白分离后,湿转法将蛋白转移至PVDF膜上,转膜条件:恒流300 mA,1.5 h。转膜结束后用TBST洗膜,5 min×3次。室温下振摇封闭2 h,然后分别加鼠抗人GRP78、CHOP抗体(稀释1 000倍),4 ℃孵育过夜,再与HRP 标记的羊抗鼠IgG二抗(稀释1 000倍)结合,TBST漂洗。化学发光法显色照相。
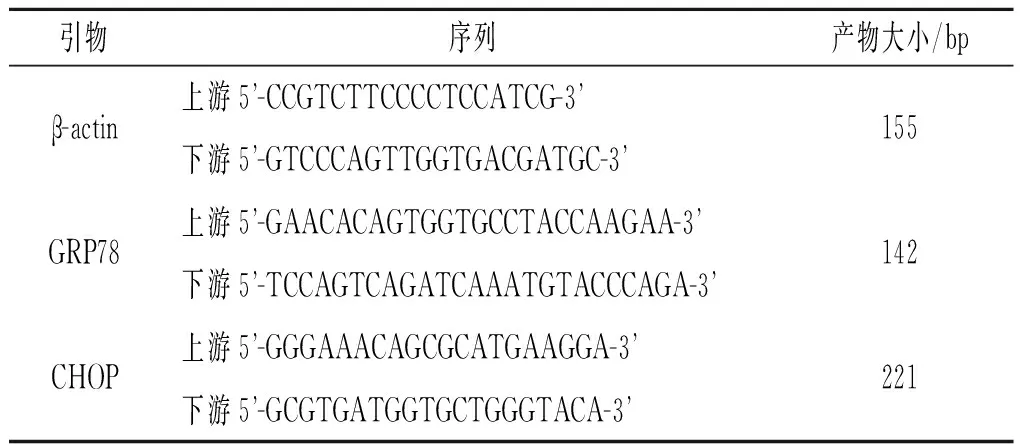
表1 引物序列
1.7 统计学处理 应用SPSS 17.0进行分析,各组细胞增殖抑制情况的比较采用析因设计的方差分析,GRP78和CHOP mRNA以及蛋白表达情况的比较采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2 结果
2.1 各组Eca109细胞增殖抑制情况 见表2。

表2 各组Eca109细胞增殖抑制情况(n=6)
F组间=66.891,F时间=297.823,F交互=16.624,P均﹤0.001。
2.2 各组细胞凋亡情况 α-细辛醚作用于Eca109 细胞48 h后,即发生明显的细胞形态变化。AO/EB双染后倒置显微镜下可见对照组细胞处于存活状态(绿色荧光),未见凋亡细胞;α-细辛醚处理组细胞的部分细胞核呈现出早期(橘红色荧光)或晚期(红色荧光)凋亡状态(图1)。
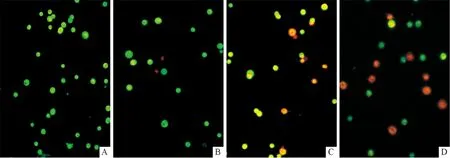
A:对照组;B:0.25 g/L α-细辛醚处理组;C:0.50 g/L α-细辛醚处理组;D:1.00 g/L α-细辛醚处理组。图1 各组Eca109 细胞AO/EB双染观察结果(×400)
2.3 各组GRP78和CHOP mRNA的表达情况 见表3。

表3 各组GRP78和CHOP mRNA的表达情况 (n=3)
*:与对照组相比,P<0.05;#:与0.25 g/L α-细辛醚处理组相比,P<0.05;△:与0.50 g/L α-细辛醚处理组相比,P<0.05。
2.4 各组GRP78和CHOP 蛋白的表达情况 见图2和表4。
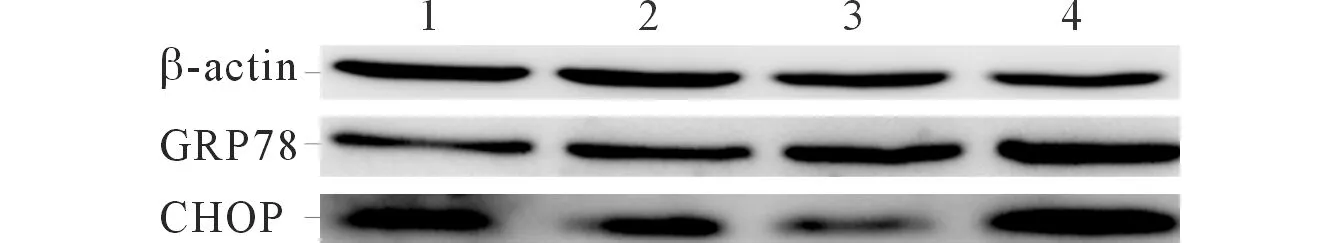
1:对照组;2:0.25 g/L α-细辛醚处理组;3:0.50 g/L α-细辛醚处理组;4:1.00 g/L α-细辛醚处理组。图2 各组GRP78和CHOP蛋白的表达
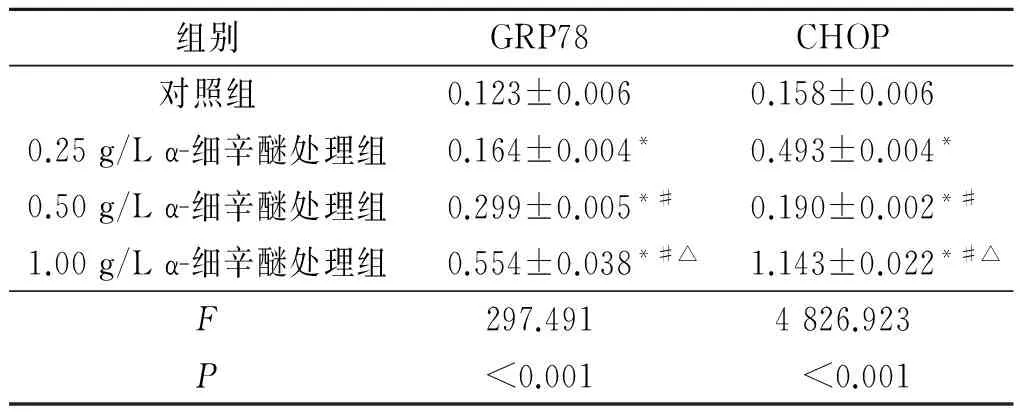
表4 各组GRP78和CHOP蛋白的表达情况(n=3)
*:与对照组相比,P<0.05;#:与0.25 g/L α-细辛醚处理组相比,P<0.05;△:与0.50 g/L α-细辛醚处理组相比,P<0.05。
3 讨论
内质网是细胞质内参与蛋白质合成、修饰与加工的重要细胞器,是调节细胞应激反应及细胞内钙浓度的场所。当细胞受到低氧等有害刺激时,可使内质网正确折叠蛋白的能力被削弱,导致未折叠或错误折叠的蛋白质积聚,引起内质网应激(endoplasmic reticulum stress,ERS),继而导致促凋亡编码基因的激活[5-6]。ERS可通过线粒体Apaf.1依赖途径、Caspase-12活化途径、Bcl-2家族、Ca2+、CHOP等多条信号通路诱导细胞凋亡[7]。其中 CHOP 是介导ERS诱导细胞凋亡的特异性转录因子,可抑制Bcl-2的启动,其在正常的细胞中低表达,而在ERS时激活并伴 mRNA 及蛋白水平表达升高,通过活化胱天蛋白酶 9 前体、启动胱天蛋白酶级联反应,最终诱导细胞凋亡[8-9]。
GRP78也称为免疫球蛋白重链结合蛋白 BIP,是内质网内的一种分子伴侣,参与内质网内蛋白质的折叠和转运,是促进蛋白质正常合成和成熟、维持细胞正常生理功能的一种重要分子[10]。GRP78也是内质网上的一种应激蛋白,在细胞受刺激时高表达从而维持内质网的稳定,对细胞有保护作用[11]。有研究[12]表明,GRP78 在多种肿瘤细胞中的表达水平比在正常细胞中高,推测GRP78在肿瘤的生长和转移中起到一定的调控作用。
该研究结果发现不同浓度α-细辛醚处理可抑制Eca109细胞增殖,促进Eca109细胞凋亡,Real-time PCR和Western blot检测发现α-细辛醚处理组细胞GRP78与CHOP mRNA和蛋白高表达,提示药物处理后细胞发生了ERS,继而通过ERS下游靶基因CHOP信号通路使CHOP mRNA 高表达,从而诱导Eca109细胞凋亡。但CHOP诱导凋亡的下游信号机制还需要进一步研究。
[1]郝鹏程,李自亨,魏煜程,等.GRP78在食管鳞状细胞癌、不典型增生及正常食管鳞状上皮组织中的表达[J].现代生物医学进展,2011,11(19):3669
[2]刘秋弟,刘夕霞,吴原,等.α-细辛醚对KA癫痫大鼠海马组织中Bax、Bcl-2的影响[J].中风与神经疾病杂志,2013,30(4):312
[3]吴坚,张星星,陈敏,等.β-细辛醚对肠癌细胞 HT-29生物行为学的影响及机制[J].时珍国医国药,2014,25(5):1103
[4]王甜甜,吴芳,朱艳琴,等.α-细辛醚诱导人食管癌细胞系Eca-109凋亡的实验研究[J].中医学报,2014,29(4):473
[5]曹珊,周慧茹,朱艳琴.苦参素对食管癌 Eca-109细胞 BIP 和 CHOP mRNA 表达的影响[J].郑州大学学报(医学版),2014,49(1):1
[6]叶蕾,李剑霜,陈芝芸,等.银杏叶提取物对肝纤维化大鼠肝组织GRP78及CHOP表达的影响[J].中国临床药理学与治疗学,2014,19(4):377
[7]卢红艳,高楚楚,唐炜,等.沉默葡萄糖调节蛋白78基因增强高氧诱导的肺泡上皮细胞凋亡[J].细胞与分子免疫学杂志,2014,30(12):1247
[8]韦碧柳,李国平,蒲泽锦,等.腺苷诱导人食管癌EC109细胞凋亡及其内质网分子机制[J].中国药理学与毒理学杂志,2011,25(6):532
[9]MA J,QIU Y,YANG L,et al.Desipramine induces apoptosis in rat glioma cells via endoplasmic reticulum stress-dependent CHOP pathway[J].J Neurooncol,2011,101(1):41
[10]THON M,HOSOI T,YOSHII M,et al.Leptin induced GRP78 expression through the PI3K-mTOR pathway in neuronal cells[J].Sci Rep,2014,4:7096
[11]沈晓君,何航.葛根素对HCY诱导的血管内皮细胞凋亡及GRP78表达的影响[J].中药药理与临床,2009,25(4):12
[12]付政祺,镇鸿燕,刘丽江.GRP78在胃癌生长中的作用[J].中国病理生理杂志,2014,30(4):625
(2016-08-26收稿 责任编辑李沛寰)
Effects of GRP78 and CHOP on apoptosis of human esophageal carcinoma Eca109 cells induced by α-asarone
WANGBaiyan,HANQianqian,ZHUYanqin,LIGuang,SHIJiajia
ExperimentTeachingCenter,BasicMedicalSchool,HenanUniversityofChineseMedicine,Zhengzhou450046
α-asarone;Eca109 cell line;proliferation inhibition;apoptosis;GRP78;CHOP
Aim: To investigate the effect of GRP78 and CHOP on apoptosis of human esophageal carcinoma Eca109 cell line induced by α-asarone. Methods: Eca109 cells were cultured for 24 h, and were treated with various concentrations(0.25, 0.50 and 1.00 g/L) of α-asarone for 12, 24, 36 and 48 h, respectively. MTT assay was used to detect the proliferation of Eca109 cells. The apoptosis morphological changes of Eca109 cells were observed with an inverted microscope. The expression level of GRP78 and CHOP were measured by Real-time PCR and Western blot, respectively.Results: α-asarone had obvious time- and dose-dependent inhibition effects on the proliferation of Eca109 cells(P<0.05). After Eca109 cells were treated with various concentrations of α-asarone for 48 h,the expressions of both GRP78 and CHOP were increased significantly(P<0.05). Conclusion: α-asarone could inhibit the proliferation of Eca109 cells and induce cell apoptosis by regulating the expressions of GRP78 and CHOP.
10.13705/j.issn.1671-6825.2017.02.001
*郑州市科技攻关项目 131PPTGG417-1;郑州市科技创新团队项目 121PCXTD520
R735.1

