HPLC法对贺兰山东麓干红葡萄酒中酚类物质的测定与分析
孙佳莹,刘娟,王宏,张军翔*
(1. 宁夏大学农学院,银川 750021;2. 银川市气象局,银川 750002;3. 宁夏米擒酒庄,银川 750021;4. 宁夏葡萄与葡萄酒研究院/宁夏大学葡萄酒学院,银川 750021)
HPLC法对贺兰山东麓干红葡萄酒中酚类物质的测定与分析
孙佳莹1,刘娟2,王宏3,张军翔4*
(1. 宁夏大学农学院,银川 750021;2. 银川市气象局,银川 750002;3. 宁夏米擒酒庄,银川 750021;4. 宁夏葡萄与葡萄酒研究院/宁夏大学葡萄酒学院,银川 750021)
本文利用高效液相色谱法(HPLC)测定贺兰山东麓干红葡萄酒中酚类物质。为了确定最佳检测条件,首先对色谱检测条件的色谱柱、流动相和洗脱程序进行了对比选择。利用最佳的HPLC分析方法对黑比诺、西拉、蛇龙珠、美乐和赤霞珠5种葡萄酒中的酚类物质进行了测定,得出单体酚总量最大的是美乐,为794.99 mg/L;最少的是黑比诺,为355.27mg/L。花色苷酚总量最大的是蛇龙珠,为413.59 mg/L;最少的是也黑比诺,为213.61 mg/L,且在黑比诺葡萄酒中花青素单葡萄糖苷并未被检测到。由此可见,不同品种葡萄酒中酚类物质的种类和含量具有较大的差异,因此利用HPLC测定方法可以进行不同葡萄酒品种的鉴定。
高效液相色谱;干红葡萄酒;酚类物质;贺兰山东麓
随着葡萄酒产业的迅速发展,我国葡萄酒的生产和消费水平也呈现快速增长趋势。因葡萄酒中的酚类物质具有一定的营养和保健价值,已然成为人们喜爱的健康饮品之一。根据其颜色的不同,可把葡萄酒中的多酚类物质分为无色多酚和有色多酚两大类,无色多酚物质主要包括单宁和酚酸等单体酚,其中酚酸类化合物多数为对羟基苯甲酸和对羟基苯丙烯酸(肉桂酸)的衍生物[1],如没食子酸、水杨酸、安息香酸、咖啡酸、香豆酸、阿魏酸等,有色多酚物质主要包括黄酮类和花色苷类,葡萄酒中常见的花色苷有花翠素单葡萄糖苷、花青素单葡萄糖苷、甲基花翠素葡萄糖苷、甲基花青素葡萄糖苷、二甲花翠素单葡萄糖苷、甲基花青素乙酰化葡萄糖苷、二甲花翠素乙酰化葡萄糖苷、甲基花青素香豆酰化葡萄糖苷、二甲花翠素香豆酰化葡萄糖苷等。这些酚类化合物是葡萄酒重要的组成成分,它们构成了葡萄酒的“骨架”,赋予了葡萄酒独特的颜色、口感、气味等感官特征,所以建立一种快速高效检测葡萄酒中酚类物质的分析方法具有重要意义[2]。
高效液相色谱法(HPLC)是检测葡萄酒中酚类化合物的常用方法之一,具有分离效果好、准确性高、分析速度快以及仪器自动化程度高等特点,该方法现已被广泛应用于不同葡萄酒酚类物质含量的分析研究中[3-6]。本文以宁夏贺兰山东麓干红葡萄酒为样品,主要在色谱柱、流动相和洗脱程序上对HPLC测定葡萄酒中酚类物质的方法进行了对比选择,并用最佳方法对供试葡萄酒中酚类物质的含量进行了定量测定,探讨不同品种干红葡萄酒中酚类物质的构成特点及含量差异性,为后期研究与利用HPLC法测定葡萄酒中的酚类物质提供理论参考。
1 试验材料与方法
1.1 材料与试剂
葡萄酒样品:供试5个红葡萄酒样(赤霞珠,美乐,蛇龙珠,黑比诺和西拉),均以2013年宁夏银川产区葡萄为原料,采用传统工艺酿制后瓶储、陈酿,由宁夏西夏王有限公司酿制。
单体酚标准品:水杨酸(salicylic acid)、安息香酸(benzoic acid)、咖啡酸(caffeic acid)、没食子酸(gallic acid),购于美国Sigma公司。
花色苷标准品:二甲花翠素单葡萄糖苷,购于美国Sigma公司。
试剂:甲酸、乙酸、乙酸乙酯均为分析纯,甲醇、乙腈均为色谱纯,购于银川为民生物科技有限公司。
1.2 主要仪器与设备
SHZ-Ⅲ型循环水真空泵,郑州长城科工贸有限公司;旋转蒸发仪RE52AA,上海亚荣生化仪器厂;高效液相色谱检测仪器为Agilent 1100;色谱柱:Ultra Ⅱ-C18色谱柱(250 mm×4.6 mm×5 μm,美国瑞斯泰克公司)、TSKgel ODS-100V(250 mm×4.6 mm×5 μm,美国安捷伦公司)。
1.3 试验方法
1.3.1 单体酚的测定方法筛选[7]
酒样前处理:用20 mL乙酸乙酯分别萃取20 mL葡萄酒样3次,合并有机相后减压蒸馏浓缩至干(<37 ℃),以4 mL色谱甲醇溶解残渣,于-30 ℃左右下避光储存,待液相检测分析,在分析测定前需使用0.45 μm有机微孔滤膜过滤处理后的样品。
标准溶液的制备:分别称取10 mg没食子酸、安息香酸、咖啡酸、水杨酸,溶解于色谱甲醇中并定容至10 mL,作为母液备用。将此溶液稀释成7个不同浓度梯度(7.8~500 mg/L)的标准溶液,在-30 ℃下保存备用。
HPLC分析方法:流速:1.0 mL/min;柱温:30 ℃;检测波长:280 nm;进样体积:10 μL,具体方法见表1。
1.3.2 花色苷的测定方法筛选
酒样前处理:0.45 μm水系滤膜过滤酒样后,待测。
标准溶液的制备:称取1 mg二甲花翠素单葡萄糖苷标品,溶解于1%盐酸甲醇溶液并定容至10 mL,将此溶液稀释成不同浓度梯度的标液,进样分析。
HPLC分析方法:流速:1.0 mL/min;柱温:35 ℃;检测波长:535 nm;进样体积:10 μL,具体方法见表2。根据α及吸收光谱与标准品对照定性,以峰面积外标法定量。
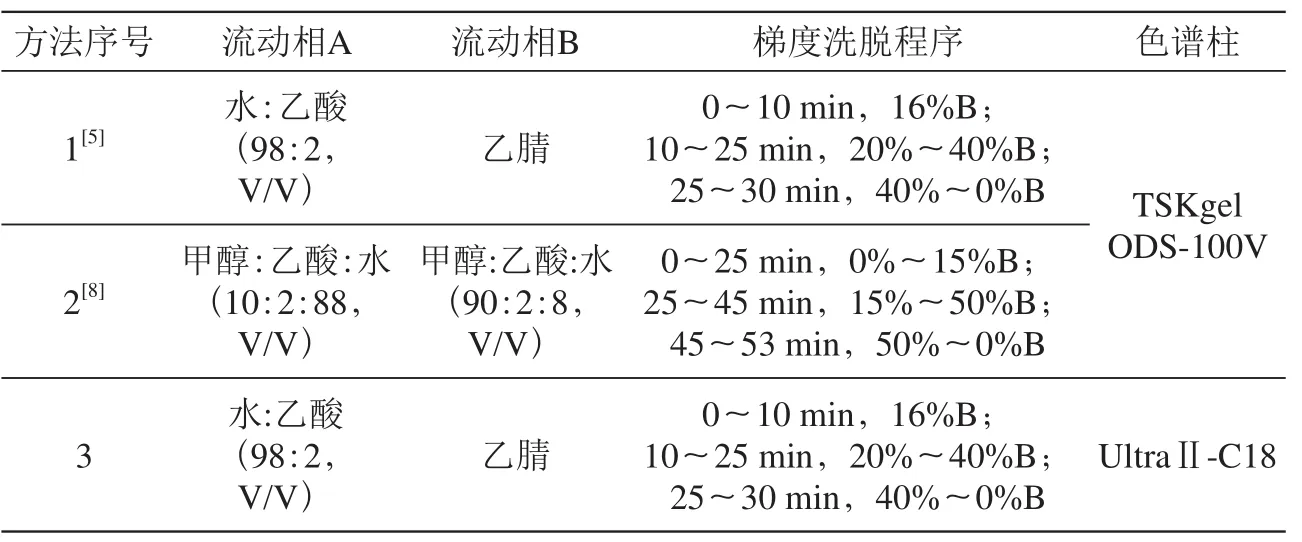
表1 单体酚的三种不同HPLC分析条件

表2 花色苷的三种不同HPLC分析条件
2 结果与分析
2.1 单体酚的测定2.1.1 单体酚HPLC分析方法的选择
每种分析方法的分离结果如表3和图1所示。
由表3可以看出,方法3中4种单体酚在标准品中的保留时间最短,方法1次之,方法2最长;此外,对比图1中的方法1与方法2色谱图可以发现,方法2中安息香酸没有得到较好地分离,且出现的杂峰较多,出峰时间漂移,不稳定,分离效果较方法1差;再对比方法1与方法3色谱图可以看出,方法1中出现的杂峰比方法3的多,且出峰时间没有方法3的稳定,分离效果较方法3差。综上所述,方法3分离出4种单体酚所用时间最短,且分离酒样的效果也是最好的,所以可以确定为测定葡萄酒中单体酚的最佳HPLC分析方法。
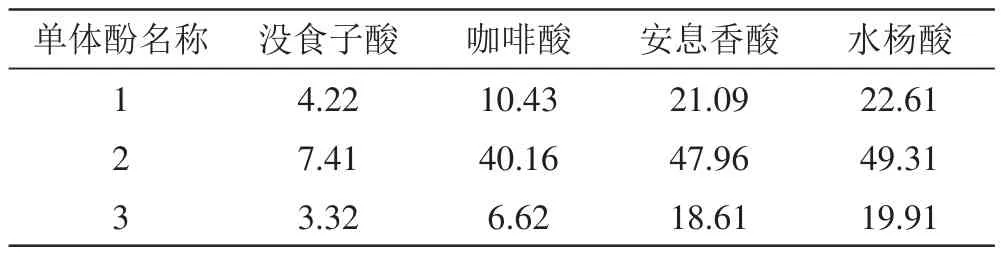
表3 不同方法1000 mg/L混标溶液中四种单体酚保留时间 (min)
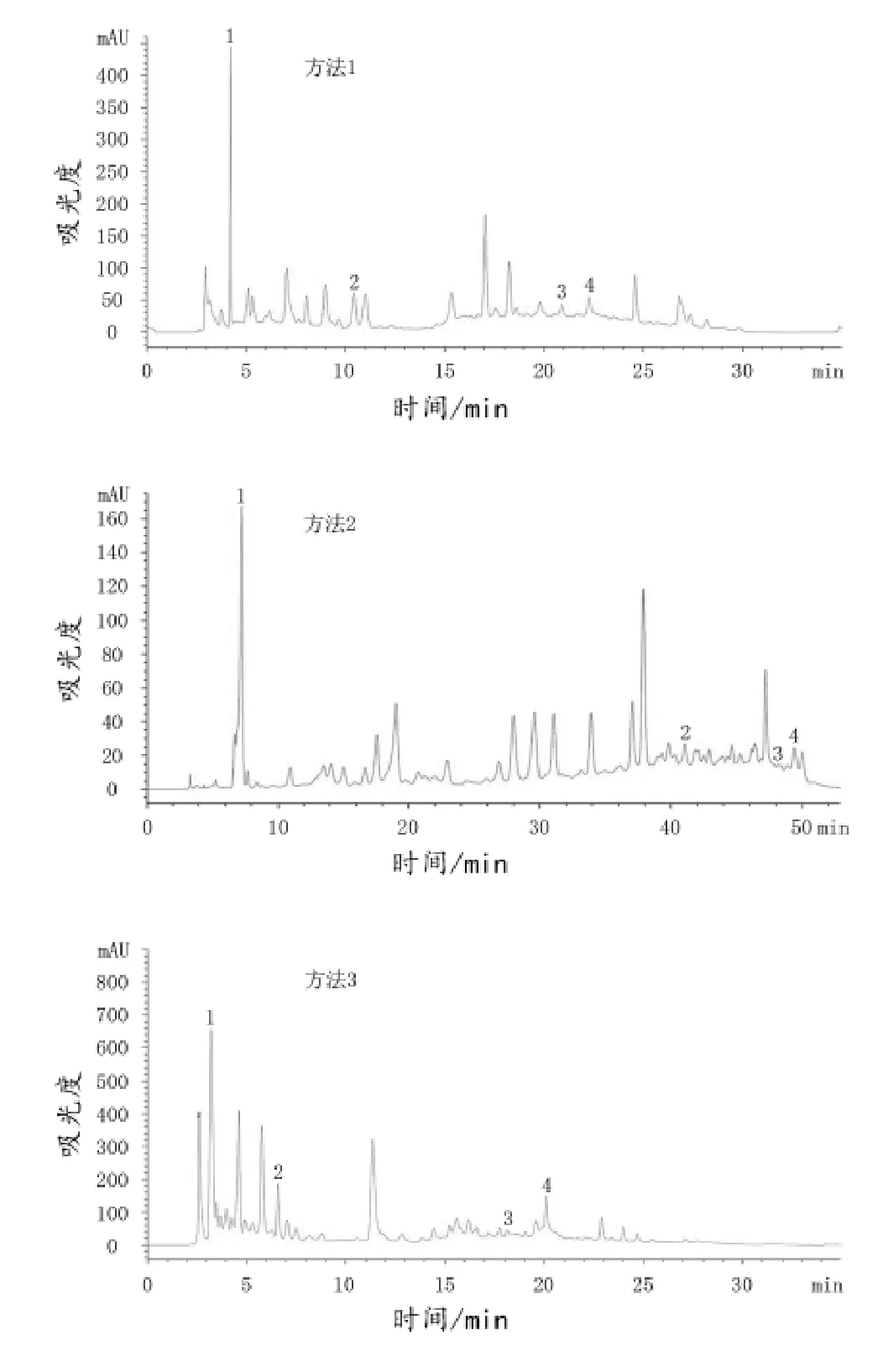
图1 3种方法赤霞珠葡萄酒样HPLC色谱图
2.1.2 标准工作曲线的制备
利用最佳HPLC方法对不同浓度梯度的单体酚混合标准溶液进行液相分析,以质量浓度Y为纵坐标,峰面积X为横坐标,计算得出4条标准曲线,结果见表4。每种无色多酚标样的R2都在0.999以上,可知这4种单体酚标品溶液的含量和检测响应值间呈现良好的线性关系。
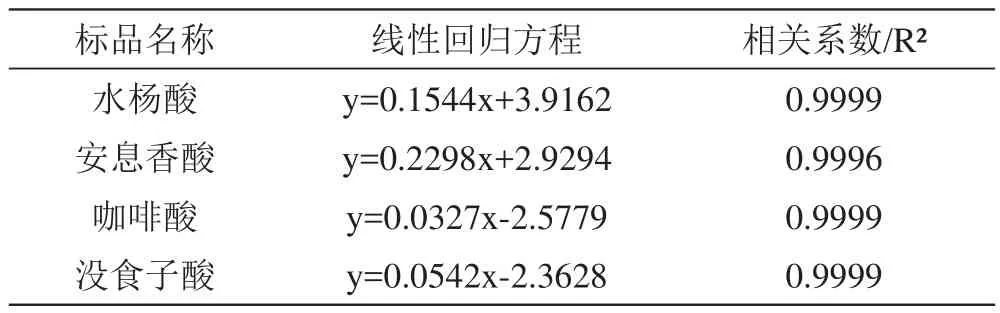
表4 4种单体酚的回归方程
2.1.3 葡萄酒样中单体酚的定性定量分析
利用最佳HPLC分析方法对宁夏贺兰山东麓产区5种不同葡萄酒进行测定后得到以赤霞珠为例的HPLC色谱图,由标品的保留时间和峰值特征得出4种单体酚在酒样中的相应色谱峰,如图1中方法3所示。
已知4种单体酚的线性回归方程,将5种葡萄酒样品所对应的各个单体酚的峰面积分别代入方程后得出宁夏贺兰山东麓产区不同品种葡萄酒的单体酚含量,如表5所示。
由表5可以看出,该产区5个不同品种红酒中,4种单体酚在葡萄酒中的含量相差较大。黑比诺葡萄酒中单体酚含量由大到小为:没食子酸>咖啡酸>水杨酸>安息香酸;其他葡萄酒样均为:没食子酸>水杨酸>咖啡酸>安息香酸,其中没食子酸的含量是最高的,在美乐中高达572.10 mg/L,黑比诺中最低,为150.64 mg/L,不到美乐的1/3。黑比诺与赤霞珠中的水杨酸含量相近,蛇龙珠的水杨酸含量最高,为141.95 mg/L,约为黑比诺的3倍;安息香酸在每种酒样间的含量差距不大;咖啡酸在赤霞珠中的含量最低为42.06 mg/L,西拉和蛇龙珠的咖啡酸含量相差不大,含量最高的是黑比诺,为122.79 mg/L,约为赤霞珠的3倍。单体酚总含量由大到小依次为:美乐>蛇龙珠>赤霞珠>西拉>黑比诺,其中,西拉和赤霞珠总量较接近,相差不大,其他酒样间总量相差较大。
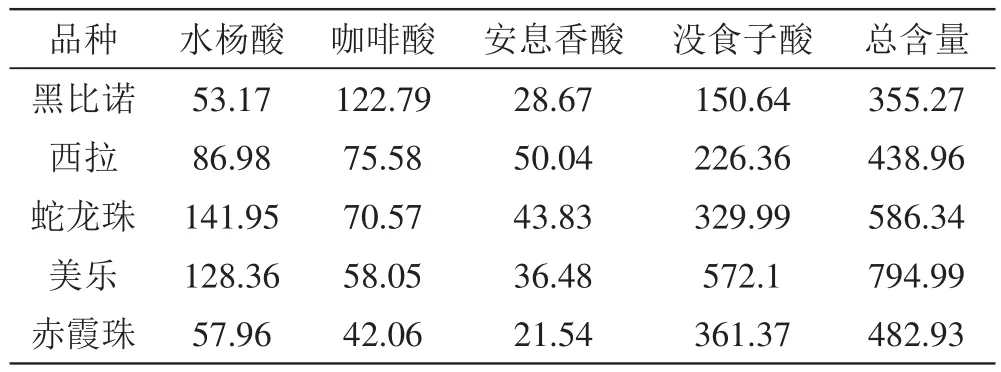
表5 宁夏贺兰山东麓产区红葡萄酒单体酚含量 (mg/L)
2.2 花色苷的测定
2.2.1 花色苷HPLC分析方法的对比选择
每种分析方法的分离结果分别如图2所示。
对比图2中的方法1与方法2色谱图可以看出,方法2中出现的杂峰比方法1多,且出峰时间漂移,不稳定,图中花翠素单葡萄糖苷与花青素单葡萄糖苷没有得到较好的分离,再对比方法1与方法3色谱图,发现方法3的出峰时间较稳定,整体的分离效果较好。所以,方法3的出峰时间最稳定,整体分离效果最好,可以确定为测定葡萄酒中花色苷酚的最佳HPLC分析方法。
2.2.2 标准曲线的制作
利用最佳HPLC方法对不同浓度梯度的二甲花翠素单葡萄糖苷标准溶液进行液相分析,以质量浓度Y为纵坐标,峰面积X为横坐标,计算得到二甲花翠素单葡萄糖苷的标准工作曲线为y=0.0510x-0.6148,R2为0.9995,相关性良好。
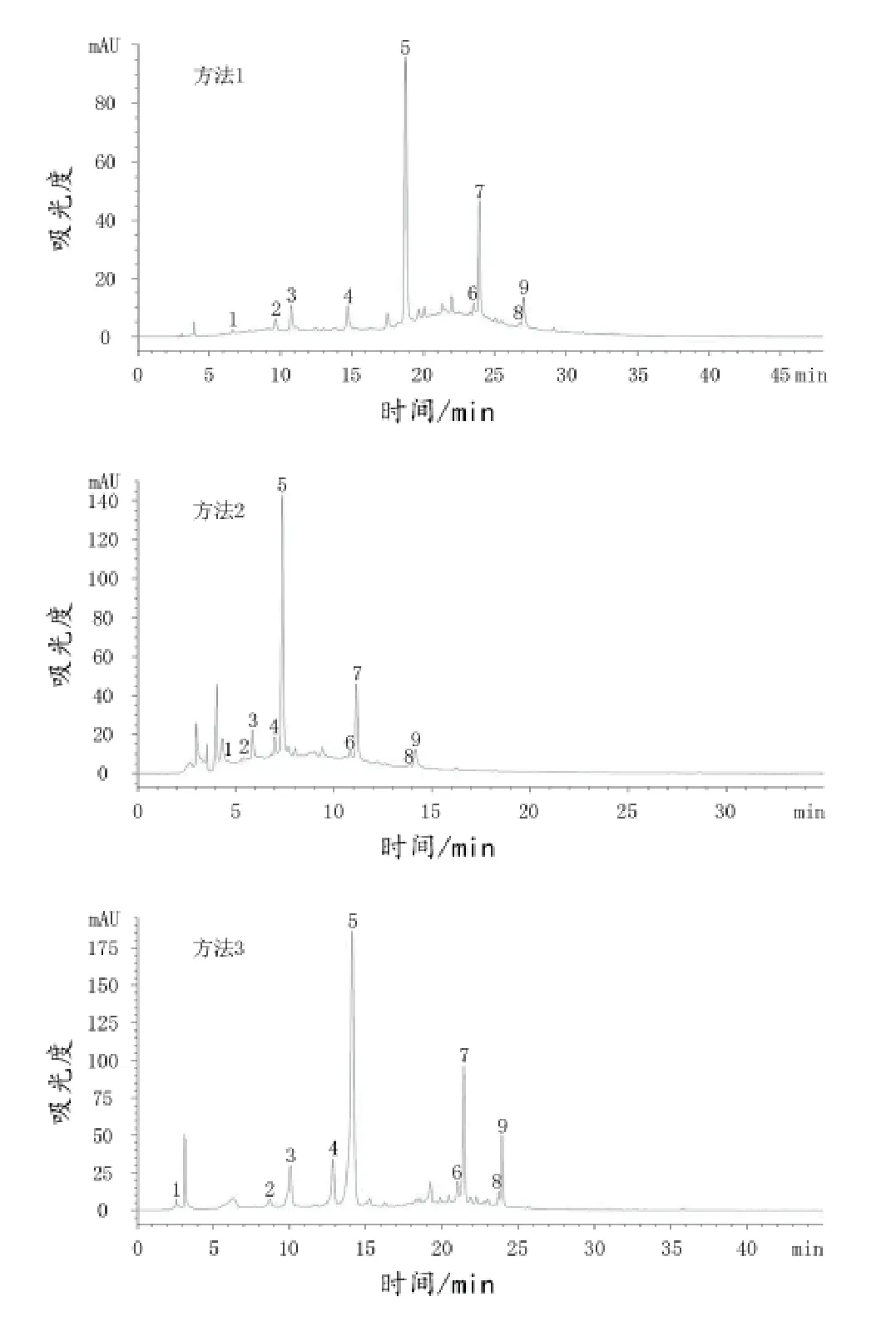
图2 3种方法美乐葡萄酒样HPLC色谱图
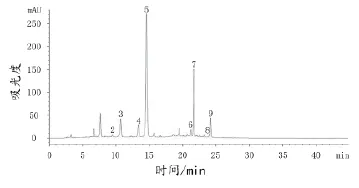
图3 赤霞珠葡萄酒花色苷HPLC色谱图
2.2.3 葡萄酒样花色苷的定性分析
依据文献[10-11]的方法计算花色苷的相对保留时间,公式为:α=tn/trs,式中tn:待测峰绝对保留时间,trs:参考峰的绝对保留时间,且参考峰选择面积较大、保留时间居中的峰。本试验选择(14.41±0.15)min保留时间的二甲花翠素单葡萄糖苷标品作为参考峰,根据文献[12-16]确定葡萄酒样品中花色苷的名称及出峰顺序,结果如图3(以赤霞珠为图例)和表6所示。
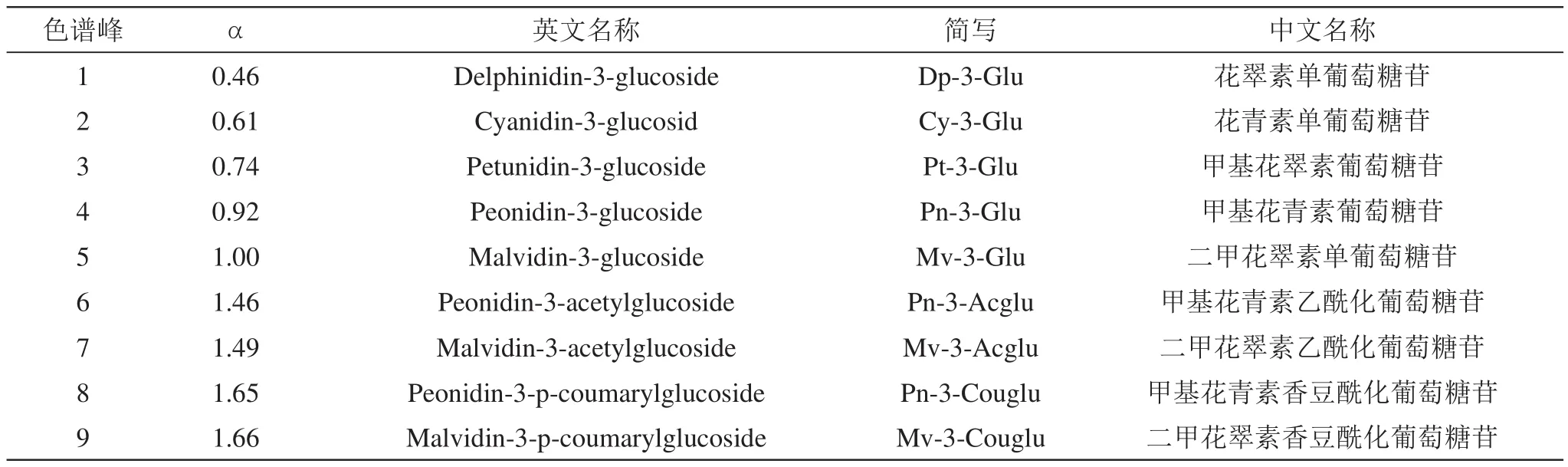
表6 花色苷色谱峰鉴定表
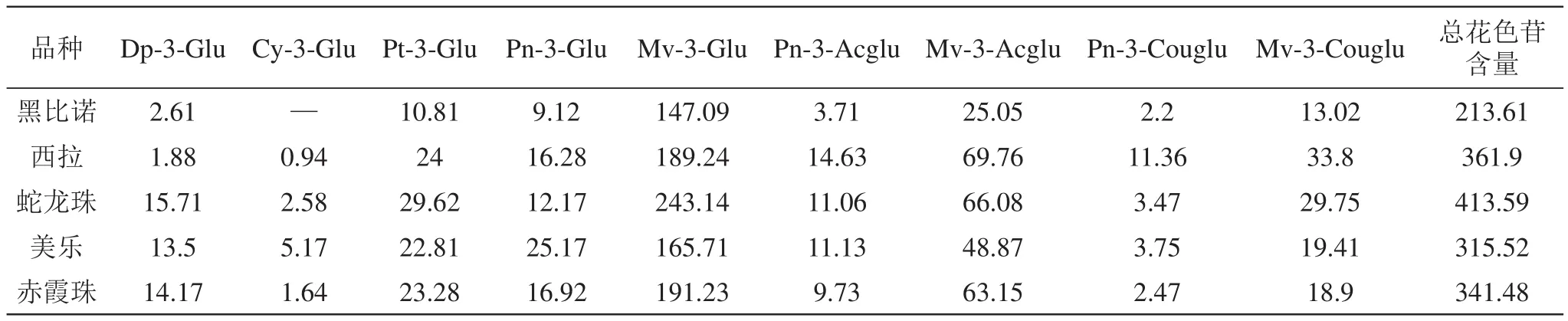
表7 贺兰山东麓红葡萄酒花色苷含量 (mg/L)
运用本试验最终确定的HPLC分析方法对供试样品花色苷进行分析测定后,通过相对保留时间及相关文献鉴定出葡萄酒中含量最大的9种花色苷,结果如表6所示。
2.2.4 葡萄酒样花色苷的含量分析
对5种不同葡萄酒花色苷的检测结果进行计算,得到供试酒样的花色苷含量(以二甲花翠素单葡萄糖苷计),结果如表7所示。
从表7可以看出,供试的5个不同酒样中黑比诺葡萄酒的9种花色苷总量均低于其他酒样,为213.61 mg/L,而蛇龙珠葡萄酒总含量最高为413.59 mg/L;9种花色苷中Mv-3-Glu是所有酒样含量最大的花色苷,在147.09~243.14 mg/L之间,可占花色苷总量的56.89%左右,不同葡萄酒中Mv-3-Glu的含量由小到大依次为:黑比诺<美乐<西拉<赤霞珠<蛇龙珠;Mv-3-Acglu在葡萄酒中的含量排第二,在25.05~69.76 mg/L之间;Cy-3-Glu和Pn-3-Couglu在所有葡萄酒中的含量最少,除西拉葡萄酒的Pn-3-Couglu含量超过了10 mg/L外,其他葡萄酒Cy-3-Glu和Pn-3-Couglu含量均没有超过10 mg/L,但是,在黑比诺葡萄酒中未检测到花青素单葡萄糖苷(Cy-3-Glu)。
3 结论与讨论
通过色谱柱、流动相和洗脱程序的筛选,得出HPLC分析的最佳试验条件,并在该条件下对宁夏贺兰山东麓产区5种不同品种葡萄酒中的酚类物质进行了测定,得出不同品种葡萄酒中单体酚总含量最高的是美乐(794.99 mg/L),最少的是黑比诺(355.27 mg/L);花色苷总含量最高的是蛇龙珠(413.59 mg/L),最少的是也黑比诺(213.61 mg/L),且在黑比诺葡萄酒中花青素单葡萄糖苷并未被检测到,利用这一特征可以区别黑比诺与其他葡萄酒。此结果说明,同一产区不同品种葡萄酒的酚类物质含量不同,且每种酚类物质含量也大不相同,都存在较大的差异,说明酚类物质含量与葡萄的品种特点、产区环境条件、栽培管理方式、酿造工艺等因素有关;Jennifer[12]曾指出,赤霞珠葡萄酒中Mv-3-Acglu和Mv-3-Couglu比率大于3,以此可以判断赤霞珠葡萄品种的典型特征,在本试验中这一特征也得到了验证,即赤霞珠酒样中的这两种花色苷比率大于3。
本试验只研究了产区内部分品种及种类葡萄酒的酚类物质,拟在今后的试验中,对多种葡萄酒的多种酚类物质作更多的测定研究,以期全面了解分析宁夏贺兰山东麓产区葡萄酒酚类物质的构成特点和含量差异,为后期研究提供更多的理论参考。
[1] 史明科, 郭金英, 任国艳, 等. 葡萄酒酚类物质研究进展[J]. 酿酒科技, 2012(4):17-20.
[2] 翁鸿珍, 岳泰新, 成宇峰. 固相萃取-高效液相色谱法测定葡萄酒多酚物质[J]. 中国酿造, 2009, 28(3):164-166.
[3] 成宇峰, 张振文, 岳泰新. HPLC测定葡萄酒中单体酚样品预处理方法的优化[J]. 酿酒科技, 2008(2): 116-118.
[4] 王贞强, 韩富亮, 赵仁邦, 等. HPLC法测定梅鹿辄和黑比诺葡萄中的花色素苷[J]. 酿酒科技, 2007(5): 99-101.
[5] 成宇峰, 张振文, 岳泰新, 等. HPLC同时检测葡萄酒中10种单体酚的方法[J]. 食品科学, 2008, 29(4): 287-290.
[6] 韩国民, 陈锋, 侯敏, 等. 葡萄酒中14 种单体酚的高效液相色谱测定[J]. 食品科学, 2011, 32(2): 180-183.
[7] 王宏, 张军翔, 陈晓艺, 等. 宁夏不同品种干红葡萄酒中辅色素的构成及定量分析[J]. 酿酒科技, 2015(3): 115-119.
[8] 王秀芹, 张庆华, 战吉成, 等. 产地与品种对葡萄酒中酚类物质含量的影响[J]. 食品科学, 2009, 30(21): 113-118.
[9] 侯小歌, 于庆泉, 严斌, 等. 发酵容器对赤霞珠干红葡萄酒中花色苷的影响[J], 食品科学, 2006, 27(8): 154-158.
[10] 张军翔, 冯长根, 李华. 蛇龙珠葡萄酒酒龄花青素高效液相色谱(HPLC)指纹图谱研究[J]. 中国农业科学, 2006, 39(7): 1451-1456.
[11] 曾志, 杨东晖, 宋力飞, 等. 高效液相色谱指纹图谱应用于板蓝根的鉴定[J]. 分析化学, 2002, 30(7): 849-852.
[12] JENNIFER B, WILLIAM M, NICHOLAS L, et al. Variations in the Profile and Content of Anthocyanins in Wines Made from Cabernet Sauvignon and Hybrid Grapes [J]. Journal of Agriculture Food Chemistry, 2002, 50(14): 4096-4102.
[13] MAZZA G, FUKUMOTO L, DELAQUIS P, et al. Anthocyanins, Phenolics, and Color of Cabernet Franc, Merlot, and Pinot Noir Wines form British Columbia[J]. Journal of Agriculture Food Chemistry, 1999, 47(10): 4009-4017.
[14] GARCIA-BENEYTEZ E, REVILLA E, CABELLO F. Anthocyanin Pattern of Several Red Grape Cultivars and Wines Made from Them[J]. European Food Research and Technology, 2002, 215(1): 32-37.
[15] RYAN J M, REVILLA E. Anthocyanin Composition of Cabernet Sauvignon and Tempranillo Grapes at Different Stages of Ripening[J]. Journal of Agriculture Food Chemistry, 2003, 51(11): 3372-3378.
[16] 王华, 韩富亮. 用HPLC分析赤霞珠干红葡萄酒中花色素苷成分[J]. 酿酒科技, 2005(4): 81-84.
Determination and analyse of phenols in dry red wine from the eastern foot of Helan mountain by HPLC
SUN Jiaying1, LIU Juan2, WANG Hong3, ZHANG Junxiang4*
(1. School of Agriculture, Ningxia University, Yinchuan, Ningxia 750021, China; 2. Yinchuan Weather Bureau, Yinchuan, Ningxia 750002, China; 3. MiQin Winery of Ningxia, Yinchuan, Ningxia 750021, China; 4. Ningxia Institute of Grape and Wine, Wine Scool of Ningxia University, Yinchuan, Ningxia 750021, China)
The phenols in dry red wine from the eastern foot of Helan mountain were determined by high performance liquid chromatography(HPLC). In order to ensure the best detection conditions, the chromatographic detection conditions, including chromatographic column, mobile phase, elution program were compared and optimized, the best HPLC conditions were choosed to determine the content of phenols in 5 kinds of different wine such as Pinot Noir, Shirz, Cabernet Gernischt, Merlot, Cabernet Sauvignon, they all were from the eastern foot of Helan mountain. The results showed that the largest content of mono-phenols was in Merlot wine for 794.99 mg/L, the lowest content of mono-phenols was in Pinot Noir wine for 355.27 mg/L; and the largest content of anthocyanins was in Cabernet Gernischt wine for 413.59 mg/L, the lowest content of anthocyanins was in Pinot Noir also. So there were a great difference in phenolics content and kinds between different varieties.
HPLC; dry red wine; phenols; the eastern foot of Helan mountain
S663.1
A
10.13414/j.cnki.zwpp.2017.02.006
2017-01-20
2013年度国家自然科学地区科学基金项目(编号:31260392);银川市西夏区研究开发项目
孙佳莹(1991-),女,在读硕士研究生,研究方向为葡萄与葡萄酒。E-mail: 972461157@qq.com
*通讯作者:张军翔(1971-),男,博士,教授,研究方向为葡萄与葡萄酒。E-mail: zhangjunxiang@126.com

