γ—分泌酶抑制剂对体外培养的糖尿病大鼠血管平滑肌细胞Notch信号通路相关蛋白表达的影响
冯东凡+范东旭+金松+韩梅++杨婷+刘彦东++王凯峰++孙瑶

[摘要] 目的 探讨γ-分泌酶抑制剂(DAPT)对体外培养糖尿病(DM)大鼠血管平滑肌细胞(VSMCs)Notch信号通路相关蛋白表达的影响。 方法 体外培养DM大鼠VSMCs,随机分为两组:正常培养基组(con组)、加入不同浓度(0.15、2.50、7.50 μmol/L)DAPT的培养基组(实验组),72 h后收集细胞,分别用双向电泳方法和Western blot法检测Notch1、Notch3、Notch4、Jagged-1、Jagged-2、DLL4蛋白的表达。 结果 ①双向电泳图谱证实提取的蛋白中含有目的蛋白。②Western blot检测结果显示:随DAPT浓度的增加,Nocth1、Nocth3、Nocth4、Jagged-1、Jagged-2、DLL4各蛋白的表达均递减;7.50 μmol/L组与对con组比较,差异有高度统计学意义(P < 0.01);0.15、1.25 μmol/L组与con组比较,差异有统计学意义(P < 0.05);0.15、1.25 μmol/L组与7.50 μmol/L组比较,差异有统计学意义(P < 0.05);0.15 μmol/L组与1.25 μmol/L组比较,差异无统计学意义(P > 0.05)。 结论 DAPT作用于体外培养的DM大鼠VSMCs后,使其Notch信号通路相关蛋白表达减少,在一定浓度范围内(1.25~7.50 μmol/L)呈浓度依赖性。
[关键词] Notch信号通路;γ-分泌酶抑制剂;血管平滑肌细胞;双向电泳
[中图分类号] R587.1 [文献标识码] A [文章编号] 1673-7210(2017)02(c)-0024-04
糖尿病足(DF)是糖尿病(DM)的慢性并发症之一,是高血糖、周围血管病变、周围神经病变等多种因素共同所致,病因复杂,致残、致死率高,治疗费用高。目前针对DF及微血管病变的治疗效果难以令人满意。Notch信号通路具有促进非DM动物缺血区血管新生、动静脉分化等作用。本课题通过γ-分泌酶抑制剂(DAPT)干预体外培养的DM大鼠血管平滑肌细胞(VSMCs),研究对Notch信号通路中Notch1、Notch3、Notch4、Jagged-1、Jagged-2、DLL4蛋白表达的影响。
1 材料与方法
1.1 实验材料
冻存的DM大鼠VSMCs(SPF级SD大鼠购自大连医科大学动物实验中心,质量合格证号:0003546,经DM大鼠模型建立、取材后冻存)[1]。
1.2 主要试剂和仪器
DAPT(美国Sellect公司);全自动凝胶电泳图像分析系统(日本Olympus公司);Mini-Protean 3电泳系统、Mini Trans-Blot转移系统(北航图像中心);蛋白浓度测定试剂、β-actin(美国Sigma公司);兔抗Notch1单克隆抗体、兔抗Notch3单克隆抗体、兔抗Notch4单克隆抗体、仓鼠抗大鼠Jagged-1蛋白(JAG1)單克隆抗体、仓鼠抗大鼠Jagged-2蛋白(JAG2)单克隆抗体、仓鼠抗大鼠DLL4蛋白单克隆抗体(美国Santa Cruz公司);Bio-Lyte载体两性电解质、IEF电泳槽、IPG预制胶条(美国BioRad公司)。
1.3 细胞培养
取冻存的DM大鼠VSMCs进行细胞复苏,将其接种于96孔板,D-Hank′s液冲洗2遍,加入0.25%TRYPSIN+0.02% EDTA·4Na约3 mL进行消化,制成单细胞悬液。按1∶2传代培养,传至3代后,随机分为两组:正常培养基(con)组和加入DAPT的培养基(实验)组(浓度梯度分别为0.15、1.25、7.50 μmol/L),继续培养传至6代。
1.4 方法
1.4.1 蛋白提取 取配置好的单细胞悬液,加入预冷的细胞裂解液400 mL,冰浴静置40 min,提取蛋白。
1.4.2 双向电泳检测目标蛋白 在198 mm×256 mm×1 mm SDS凝胶上,标记纵横坐标,将目的蛋白加入坐标原点,进行第一向等电聚焦电泳,聚焦结束后的胶条经平衡处理后立即进行第二向SDS-聚丙烯酰胺凝胶电泳,电泳结束后,取出凝胶,拍照,应用计算机软件分析处理。取提取的蛋白,BCA试剂盒测定蛋白浓度,计算上样量。煮沸,变性,标记,上样检测或于-80℃保存。
1.4.3 Western blot 检测蛋白表达情况 取30 μg蛋白,进行SDS-聚丙烯酰胺凝胶电泳,转膜,封闭,加入抗Notch1、Notch3、Notch4、Jagged-1、Jagged-2、DLL4单克隆抗体(1∶200),4℃孵育过夜,加入二抗IgG(1∶5000稀释),室温孵育1 h,ECL试剂盒显影,以β-actin为内参进行数据标准化,以对照组为参照样本,计算Notch1、Notch3、Notch4、Jagged-1、Jagged-2、DLL4蛋白的相对表达水平。实验重复3次。
1.5 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 双向电泳检测结果
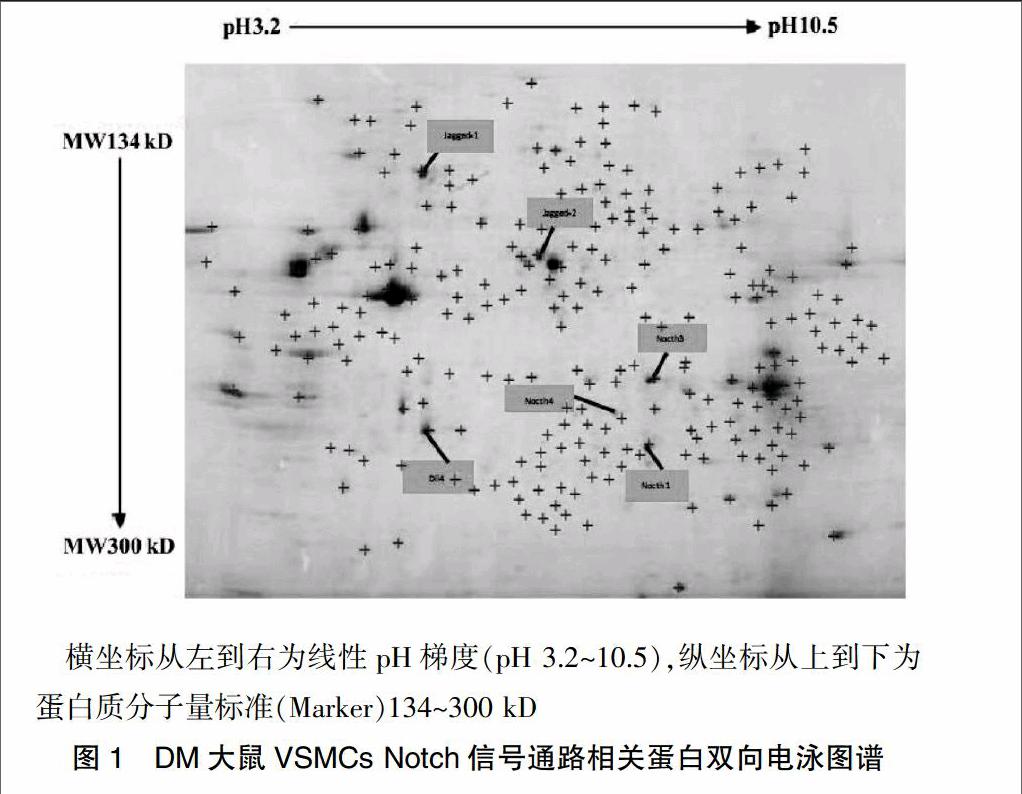
DM大鼠VSMCs蛋白双向电泳检测结果显示,在凝胶上可以看到800多个蛋白点,其中大多数蛋白位于pH 5.0~8.5,分子量为134~300 kD。应用计算机软件Image-Master 2D Platinum software分析,其中“十字”表示计算机探测到的凝胶分离出的蛋白质点,“标签”表示经过计算机软件自动编号后的目标蛋白点,说明提取的蛋白质中含有实验所需目的蛋白。见图1。
2.2 Western blot检测结果
Western blot检测结果显示:随DAPT浓度的增加,Nocth1、Nocth3、Nocth4、Jagged-1、Jagged-2、DLL4各蛋白表达水平递减;7.50 μmol/L组与con组相比,差异有高度统计学意义(P < 0.01),0.15、1.25 μmol/L组与con组相比,差异有统计学意义(P < 0.05);0.15、1.25 μmol/L组与7.50 μmol/L组相比,差异有统计学意义(P < 0.05);0.15 μmol/L组和1.25 μmol/L组比较,差异无统计学意义(P > 0.05)。见图2~3。
3 讨论
DM已成为世界性疾病[2],根据国际糖尿病联盟(IDF)发布的2015全球DM版图[3],目前世界成年DM患者约4.15亿人,中国目前为1.096亿人,且处于不断增加中。据统计,15%~25%的DM患者一生中会发生DF[4],而DM患者的截肢率与非DM患者相比要高40倍[5],且截肢预后较差。据统计[6]截肢后5年死亡率达40%。
在DM血管病变过程中,VSMCs从中膜移行到内膜,增殖、分泌生长因子,参与纤维膜的形成,VSMCs还分泌合成许多基质分子参与血管病变的发生[7-8]。因此可见,VSMCs在DM血管病变的进展过程中发挥着重要作用。
目前针对DM血管病变的治疗主要以内科药物保守治疗、腔内介入手术[9]、旁路移植手术[10]为主,但效果均欠佳,近年来开展的细胞因子治疗[11]用于诱导和促进DM血管缺血区血管再生的探索取得一定效果,但也存在一定不足。因此,寻求新的方式以促进更多血管生成是非常有必要的。
有研究证实,Notch信号通路能促进非DM动脉缺血区的血管新生[12-14],在血管发育的过程中发挥重要的作用。在Notch信号通路的受体和配体中,Notch1、Notch3、Notch4、Jagged-1、Jagged-2、DLL4在血管平滑肌细胞表达[15]。Notch1、Notch3、Notch4受体分别主要由Jagged-1、Jagged-2、DLL4配体启动[16-17]。Qiao等[18]、Zela等[19]证实Notch信号通路对体外培养正常大鼠血管VSMCs的增殖、分化、凋亡等具有重要的调控作用,进而促进血管新生。但是Notch信号通路是否对DM动脉缺血区具有相同的作用尚未清楚。DAPT是Notch信号通路的抑制剂,可特异性抑制γ-分泌酶活性,进而抑制Notch受体在S3位点的酶切,有效抑制Notch信号通路的激活[20]。
本课题组既往实验经流式细胞学检测证实,体外培养的DM大鼠VSMCs经DAPT作用72 h,对其细胞的抑制率较其余各时间段明显,且当DAPT浓度在0.25、1.25、7.50 μmol/L时,其半抑制率最为明显[1],所以本实验选用以上3个浓度的DAPT作用72 h后行相关检查。实验结果显示:各实验组与con组提取Notch1、Notch3、Notch4、Jagged-1、Jagged-2、DLL4蛋白后行双向电泳及Western blot检测证实DAPT可以抑制Notch信号通路的活动,抑制Notch相关蛋白的表达。双向电泳图谱经计算机软件分析表明提取蛋白中含有目的蛋白。Western blot检查结果显示:随DAPT浓度的增加,各蛋白的表达均递减,说明DAPT干预Notch信号通路能抑制DM大鼠Notch信号通路相关蛋白的表达;其中,当DAPT浓度在7.50 μmol/L时,对Notch信号通路各蛋白表达的抑制作用最明显;当DAPT浓度在0.15~1.25 μmol/L之间时,干预Notch信号通路后对相关蛋白的抑制作用无明显差异;当DAPT浓度在1.25~7.50 μmol/L之间时,随着浓度的升高,DAPT对Notch信号通路的抑制作用逐渐增强,呈剂量依赖型。从结果中可看出,Nocth1、Nocth3、Nocth4蛋白分别与Jagged-1、Jagged-2、DLL4蛋白降低的幅度相似,证实了Notch1、Notch3、Notch4受体分别主要由Jagged-1、 Jagged-2、DLL4配体启动这一理论。本实验结果提示:Nocth1、Nocth3、Nocth4、Jagged-1、Jagged-2、DLL4各蛋白在体外正常条件下培养的DM大鼠VSMCs中均有所表达;且DAPT能不同程度阻断DM大鼠VSMCs Notch信号通路的活性,抑制Notch信号通路相关蛋白的表达,且该抑制作用在一定浓度范围内(1.25~7.50 μmol/L)呈正相关。结合本课题前期实验证实DAPT干预Notch信号通路后可抑制DM大鼠VSMCs的增殖、促进凋亡等,提示Notch信号通路与DM大鼠VSMCs的增殖、凋亡等有关。此项研究提示,促进Notch信号通路的表达或许可以促进DM患者缺血区VSMCs的增殖,促进更多新生血管的再生,但目前对Notch信号通路在DM患者中的具体机制还存在许多亟需解决的问题。
总之,DAPT干预DM大鼠VSMCs后能抑制Notch信号通路相关蛋白的表达,抑制Notch信号通路的活性,证明Notch信号通路在DM大鼠血管再生中起着重要作用,而进一步研究Notch信号通路在DM大鼠中的作用機制或许为治疗DM患者缺血区血管新生提供一种新的可能。
[参考文献]
[1] 汪宝林,金松,范东旭,等.糖尿病大鼠血管平滑肌细胞体外培养及Notch信号通路对其细胞增殖及凋亡的研究[J].黑龙江医药科学,2016,39(4):105-106.
[2] Santos PFLD,Santos PRD,Ferrari GSL,et al. Knowledge of diabetes mellitus: Does gender make a difference?[J]. Osong Public Health & Research Perspectives,2014,5(4):199-203.
[3] International Diabetes Federation. IDF Diabetes Atlas Seventh Edtion 2015 [EB/OL]. [2015-12-01]. http://www.diabetesatlas.org/.
[4] Singh N,Armstrong DG,Lipsky BA. Preventing foot ulcers in patients with diabetes [J]. JAMA,2005,293(2):217-228.
[5] Apelquist J,Larsson J. What is the most effective way to reduce incident of amputation in the diabetic foot?[J]. Diabetes Metab Rev,2000,16(suppl 1):375-383.
[6] Guo F,Lv S,Lou Y,et al. Bone marrow stromal cells enhance the angiogenesis in ischaemic cortex after stroke:involvement of notch signaling [J]. Cell Biol Int,2012,36(11):997-1004.
[7] Tabas I,Williams KJ,Boren J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications [J]. Circulation,2007, 116(16):1832-1844.
[8] 谷涌泉.糖尿病足下肢动脉闭塞性病变的外科治疗进展[J].临床外科杂志,2012,20(5):318-320.
[9] 杨婷,刘彦东,金松.人工血管移植术治疗下肢慢性动脉闭塞症的临床分析[J].中国医药指南,2013,11(10):640-641.
[10] 杨婷,王凯峰,孙瑶,等.血管内皮生长因子联合碱性成纤维细胞生长因子对大鼠后肢动脉硬化闭塞血管再生机制的研究[J].中国普外基础与临床杂志,2015,22(8):917-921.
[11] Chung AS,Lee J,Ferrara N. Targeting the tumour vascu?鄄lature:insights from physiological angiogenesis [J]. Nat Rev Cancer,2010,10(7):405-514.
[12] Hofmann JJ,Iruela-Arispe ML. Notch signaling in blood vessels:who is talking to whom about what [J]. Circ Res,2007,100(11):1556-1568.
[13] Phng L,Gerhardt H. Angiogenesis:a team effort coordi?鄄nated by notch [J]. Developmental Cell,2009,16(2):196-208.
[14] Bahman R,Sarah M,Caloln P,et al. Notch signal inte?鄄gration in the vasculature during remodeling [J]. Vasc Phar,2014,63(2):97-104.
[15] Kune T. Novel insights into the differential functions of Notch ligands in vascular formation [J]. Journal of Angiogenesis Research,2009,1(1):8.
[16] Bahman R,Sarah M,Caloln P,et al. Notch signal inte?鄄gration in the vasculature during remodeling [J]. Vasc Phar,2014,63(2):97-104.
[17] Dontu G, Jackson KW,Mcnicholas E,et al. Role of Notch signaling in cell-fate determination of human mammary stem/progenitor cells [J]. Breast Cancer Reasearch,2004, 6(6):1-11.
[18] Qiao L,Xie L,Shi K,et al. Notch Signaling Change in Pulmonary Vascular Remodeling in Rats with Pulmonary Hypertension and Its Implication for Therapeutic Inter?鄄vention [J]. Plos One,2012,7(12):5682-5700.
[19] Zela K,Baaij JHFD,Martine G,et al. The Notch pathway attenuates interleukin 1β(IL1β)-mediated induction of adenylyl cyclase 8(AC8) expression during vascular smooth muscle cell(VSMC) Trans-differentiation [J]. Journal of Biological Chemsitry,2012,287(30):24978-24989.
[20] Mori M,Miyamoto T,Yakushiji H,et al. Effects of N-[N-(3,5-difluorophenacetyl-L:-alanyl)]-S-phenyl?鄄glycinet-butyl ester(DAPT)on cell proliferation and api?鄄ptosis in Ishikawa endometrial cancer cells [J]. Hum Cell,2012,25(2):9-15.
(收稿日期:2016-11-15 本文編辑:程 铭)

