不同细胞破碎方法对肉牛、牦牛背最长肌
左惠心 韩玲 牛克兰 王琳琳 张佳莹 余群力

摘 要:采用液氮研磨、液氮研磨辅助超声波破碎和液氮研磨辅助玻璃珠破碎3种细胞破碎方法对肉牛、牦牛背最长肌蛋白质提取和双向电泳图谱效果的最佳方法进行研究。在相同裂解液组成、等电聚焦程序、十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)操作、银染法染色等双向电泳条件的处理下,通过Bradford法分别测定不同方法提取的肉牛和牦牛肉背最长肌中蛋白质的含量,并采用PDQuest 8.0.1软件对双向电泳图谱的效果进行分析。结果表明:3种细胞破碎方法提取的肉牛和牦牛背最长肌蛋白质含量差异显著,其中液氮研磨辅助超声波破碎法((2.59±0.15)、(2.84±0.29)μg/μL)显著高于其他2种方法,液氮研磨辅助玻璃珠破碎法((2.01±0.04)、(2.21±0.02)μg/μL)显著高于液氮研磨法((1.77±0.11)、(1.95±0.19)μg/μL)。3种方法所得肉牛背最长肌双向电泳图谱的蛋白点个数分别为(279±19)、(581±15)、(363±21)个;所得牦牛肉双向电泳图谱的蛋白点个数分别为(292±15)、(596±12)、(385±17)个。3种方法中液氮研磨辅助超声波破碎法提取的肉牛、牦牛背最长肌蛋白质含量最高,数量最多,蛋白点分离程度最好,并且3种细胞破碎方法在牦牛背最长肌中提取的蛋白质含量与肉牛背最长肌中提取的蛋白质含量差异不显著。
关键词:细胞破碎;肉牛;牦牛;背最长肌;蛋白质提取;双向电泳
Comparison of Different Cell Disruption Methods for Two-Dimensional Electrophoresis Analysis of Beef and Yak Muscle
ZUO Huixin, HAN Ling*, NIU Kelan, WANG Linlin, ZHANG Jiaying, YU Qunli
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Abstract: Three cell disruption methods, i.e., liquid nitrogen grounding, liquid nitrogen grounding aided ultrasonication and liquid nitrogen grounding with glass beads were investigated to find the most appropriate one for the extraction and two-dimensional electrophoresis analysis of proteins in longissimus dorsi muscles of beef cattle and yak. The same lysis buffer was used in the different cell disruption methods and the two-dimensional electrophoresis analysis was performed using isoelectric focusing and sodium dodecyl sulfate polyacrylamide gel electropheresis (SDS-PAGE) by silver staining. The protein contents of longissimus dorsi muscles were determined by the Bradford method. Analysis of the two-dimensional electrophoresis images was conducted using using PDQuest 8.0.1 software. Results showed that the protein contents of beef and yak longissimus dorsi muscles with the three cell disruption methods were significantly different, (2.59 ± 0.15) and (2.84 ± 0.29) μg/μL, (2.01 ± 0.04) and (2.21 ± 0.02) μg/μL, and (1.77 ± 0.11) and (1.95 ± 0.19) μg/μL for liquid nitrogen grounding aided ultrasonication, liquid nitrogen grounding with glass beads and liquid nitrogen grounding, respectively. The numbers of protein spots in the electrophoresis images of beef longissimus dorsi obtained using these three cell disruption methods were (279 ± 19), (581 ± 15) and (363 ± 21), respectively, whereas those of yak longissimus dorsi were (292±15), (596 ± 12) and (385 ± 17), respectively. Among these three methods, liquid nitrogen grounding aided ultrasonication yielded the highest protein contents, the greatest number of proteins and the best separation of protein spots from beef and yak longissimus dorsi. No significant differences in the protein contents of beef and yak longissimus dorsi were observed among the three cell disruption methods.
Key words: cell disruption; beef muscle; yak muscle; longissimus dorsi muscles; protein extraction; two-dimensional electrophoresis
中图分类号:TS252.1 文献标志码:A 文章编号:1001-8123(2015)07-0011-05
doi: 10.7506/rlyj1001-8123-201507003
双向凝胶电泳(two-dimensional electrophoresis,2-DE)是一种从蛋白质混合物中分离蛋白质的重要方法,其原理是根据蛋白质等电点的不同在pH梯度胶内进行第一向等电聚焦分离,然后根据蛋白质的相对分子质量大小,利用聚丙烯酰胺凝胶进行第二向分离,经染色后得到二维的蛋白质分布图谱,能够对一个细胞、组织表达的所有蛋白质即蛋白质组进行分析[1-2]。蛋白样品的溶解是整个2-DE的第一步,因而直接影响2-DE的结果,样品的溶解和制备应该尽可能减少步骤,防止人为修饰并促进样品中全部蛋白质的变性和还原[3]。为了能够充分溶解样品并研究细胞内的全部蛋白质,必须有效地进行细胞破碎[4]。
组织细胞的破碎方法取决于样品的特性[5-8](如样品的组成、坚韧程度、实验目的等),对于易于破裂的细胞可以选择温和的裂解方法,而对坚硬的组织细胞和具有细胞壁的植物或微生物材料应选择剧烈的裂解方法,同时确保蛋白质组分不被降解和丟失。本研究采用液氮研磨、液氮研磨辅助超声波破碎和液氮研磨辅助玻璃珠破碎3种细胞破碎方法,对肉牛和牦牛背最长肌进行蛋白质提取及2-DE分离,旨在检测不同细胞破碎方法对肉牛和牦牛背最长肌蛋白提取量及2-DE的蛋白点分离程度和分辨率的影响,以期建立最佳的肉牛、牦牛肉肌肉组织2-DE分离条件,为进一步研究肉牛、牦牛肉肌肉蛋白质组学提供技术支持。
1 材料与方法
1.1 材料与试剂
肉牛和牦牛均取自甘肃省武威市天祝藏族自治县,各采集12头36~48月龄放牧牛的背最长肌,从屠宰场取得刚宰杀的样品,立即用磷酸盐缓冲液清洗表面血迹后转到液氮中,带回实验室于-80℃条件下保存备用。
尿素(carbamide)、硫脲(thiourea)、固相pH梯度胶条(pH 3~10,非线性凝胶,17 cm)、3-[(3-胆酰胺丙基)二乙胺]-1-丙磺酸 (3-[(3-cholamidopropyl) dimethylammonio]- 1-propanesulfonate,CHAPS)、二硫苏糖醇(dethilthreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)、牛血清白蛋白(bovine albumin,BSA)、三羟甲基氨基甲烷(tris-base) 美国
Sigma公司;丙酮、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三氯乙酸(trichloroacetic acid,TCA)均为分析纯。
1.2 仪器与设备
PROTEAN i12 IEF型双向电泳仪、mini-protein II型电泳槽 美国Bio-Rad公司;UV-250型紫外分光光度计 日本岛津公司;TGL-24MC型台式高速冷冻离心机 长沙英泰仪器有限公司;JY92-IIDN型液氮研磨辅助超声波细胞破碎仪 宁波新芝生物科技股份公司;CP214型电子天平 奥豪斯仪器有限公司;M205444型摇床
北京中西远大科技有限公司;DHG9070A型电热鼓风干燥箱 上海越众仪器设备有限公司。
1.3 方法
1.3.1 细胞破碎方法
液氮研磨法[9]:将洗净的研钵、杵、药匙用锡箔纸包好,在250 ℃条件下高温鼓风干燥2 h。将研钵、杵、药匙事先液氮预冷,研磨时注入液氮,待组织颗粒冻硬后研磨至粉末状,期间需经常补充液氮以保证研磨过程始终在液氮中进行。
液氮研磨辅助超声波破碎法:在充分进行液氮研磨后,将细胞悬浮于等体积预冷的裂解液中,在超声功率200 W、超声0.5 s、停1 s,超声时间20 min的条件下,用液氮研磨辅助超声波短时间内多次冲击细胞悬液,注意不要产生泡沫。
液氮研磨辅助玻璃珠破碎法:在充分进行液氮研磨后,将细胞悬浮于等体积预冷的裂解液中,每克细胞加入2 g预冷的玻璃珠置于锥形瓶中,170×g摇床振荡2 min,冰浴2 min,累计处理20 min。
1.3.2 Bradford法蛋白质含量测定[10]
以牛血清白蛋白(BSA)为标准蛋白,磷酸盐缓冲液为空白,用Bradford法测定蛋白质含量。在595 nm,分别测定光密度(optical density,OD),根据OD值与蛋白含量之间的线性关系,绘制出蛋白含量的标准曲线,然后测定待测蛋白溶液显色后的OD595 nm值,参照BSA标准曲线计算待测蛋白的含量。所有操作步骤均在室温状态完成。
1.3.3 双向电泳条件
在肉牛和牦牛背最长肌中分别加入0.11倍体积的100% TCA至样品中[11],置于冰上10 min,再添加500 μL冰预冷的100% TCA至样品中,置于冰上20 min。10 000×g离心30 min,小心取上清液,添加500 μL丙酮,10 000×g离心10 min,小心吸去上清。加入组织细胞裂解液(8 mol/L尿素、2 mol/L硫脲、2 g/100 mL CHAPS(40 mmol/L Tris-base),离心取上清后分装并保存在-80℃冰箱备用。在以下程序进行等电聚焦:30 V×l2 h、200 V×1 h、500 V×1 h、1 000 V×1 h、2 000 V×1 h,5 000 V×1 h、8 000 V Gradient l h、8 000 V step-n-hold 6 h;表面温度:20 ℃;胶条:80 μA。聚焦结束后,分别用含2g/100 mL DTT和2.5g/100 mL IAA的胶条平衡缓冲液(6 mol/L尿素、2 g/100 mL SDS、体积分数20%甘油)平衡胶条各15 min。将平衡好的固定化pH梯度(immobilized pH gradient,IPG)胶条转移到体积分数12.5%的二向凝胶上端,将电泳缓冲液倒入电泳槽中。设置电泳仪参数:100 W电泳2 h,然后150 W下电泳约10 h,直到溴酚蓝到达胶底部后关闭电泳,拨胶,用快速银染法进行胶的染色[12]。
1.3.4 图像扫描分析
将凝胶放于图像扫描器上,选择透射模式,以300 dpi分辨率扫描16位灰度图像,以tif格式存储。设置优化灵敏度、算符大小和背景噪音等参数,初步识别凝胶图像中的点[13]。创建参考胶[14],参考胶是用于胶图之间匹配的基础,同一组实验中的其他胶图都与其进行匹配。手工匹配部分蛋白点,然后由软件自动匹配,再进行手工校正,所得结果进一步在参考胶中验证。
1.4 数据分析
使用Microsoft Excel 2010进行数据整理,不同平均值之间采用SAS 9.0软件GLM程序中的S-N-K多重比较法进行差异显著性检验。
2 结果与分析
2.1 BSA蛋白含量标准曲线方程
采用Bradford方法对不同方法提取的肉牛、牦牛背最长肌蛋白质含量进行测定,1 mg/mL BSA溶液作标准液制作标准曲线,以蛋白质含量(μg/μL)为横坐标,以OD595 nm值为纵坐标得到标准曲线方程为y=0.005 8x+0.038 7(R2=0.987 7),由标准曲线方程可知,标准曲线相关系数为0.987 7,线性关系良好,可以用于肉牛、牦牛背最长肌蛋白含量的测定。
2.2 不同细胞破碎方法对肉牛和牦牛背最长肌蛋白含量的影响
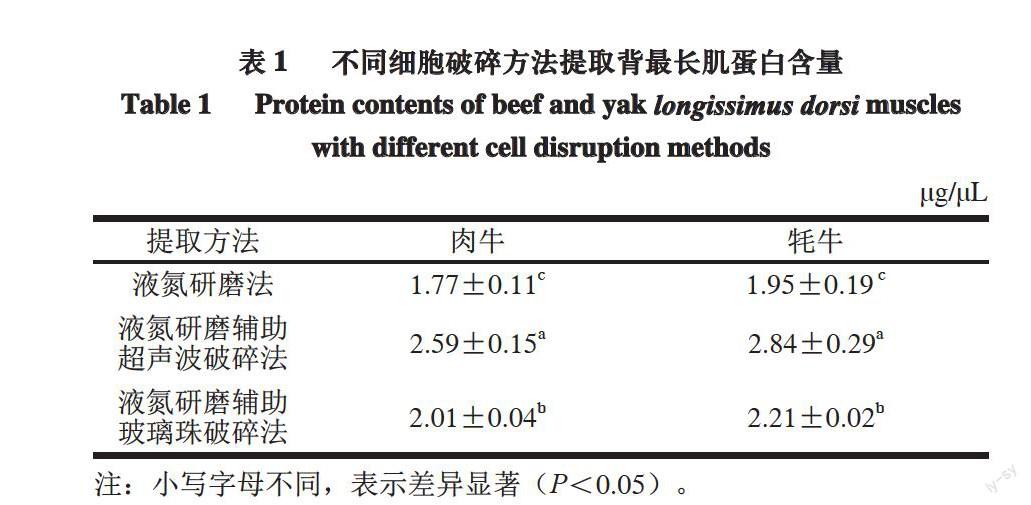
表 1 不同细胞破碎方法提取背最长肌蛋白含量
Table 1 Protein contents of beef and yak longissimus dorsi muscles with different cell disruption methods
?g/?L
提取方法 肉牛 牦牛
液氮研磨法 1.77±0.11c 1.95±0.19 c
液氮研磨辅助
超声波破碎法 2.59±0.15a 2.84±0.29a
液氮研磨辅助
玻璃珠破碎法 2.01±0.04b 2.21±0.02b
注:小写字母不同,表示差异显著(P<0.05)。
由表1可知,不同细胞破碎方法提取肉牛、牦牛背最长肌蛋白质含量之间差异显著(P<0.05),3 种细胞破碎方法在牦牛背最长肌中提取的蛋白质含量均高于肉牛,且差异不显著(P>0.05)。液氮研磨法、液氮研磨辅助超声波破碎法和液氮研磨辅助玻璃珠破碎法提取的肉牛背最长肌蛋白质含量分别为(1.77±0.11)、(2.59±0.15)、(2.01±0.04)μg/μL;3 种细胞破碎方法提取的牦牛背最长肌蛋白质含量分别为(1.95±0.19)、(2.84±0.29)、(2.21±0.02)μg/μL。
3种细胞提取方法中,液氮研磨辅助超声波破碎法得到的蛋白质含量均显著高于液氮研磨法和液氮研磨辅助玻璃珠破碎法(P<0.05),液氮研磨法所得蛋白质含量最低,液氮研磨辅助玻璃珠破碎法得到的蛋白质含量居中。
分析原因,只进行液氮研磨时,由于不易破坏研磨物组织成分,仍有肉眼不易分辨的组织未将蛋白质释放完全,以至破碎效果不如液氮研磨辅助玻璃珠破碎法和液氮研磨辅助超声波破碎法。玻璃珠破碎的原理是通过细胞悬浮液和珠子相互搅动,从而通过剪切力层之间的碰撞和滚动而使细胞破裂[15-17],由于玻璃珠破碎法在振荡时有可能出现温度升高以至蛋白质降解的情况,所以肉牛、牦牛背最长肌所提取的蛋白质含量低于液氮研磨辅助超声波破碎法。液氮研磨辅助超声波破碎法效果最好,可能是因为细胞在超声波频率大于20 kHz/s时有强烈的生物学效应,进行超声波处理时,超声波的高频振动与微生物细胞的振动不协调,造成细胞周围环境局部真空,使细胞膜产生空穴作用[18-20],从而使之破碎。超声波破碎的效率取决于声频、声能、处理时间、细胞浓度及细胞类型等[21],使用超声波必须注意的是控制强度在一定限度,即刚好低于溶液产生泡沫的水平,因为产生泡沫会导致蛋白质的变性,过低的强度将降低破碎效率。实验证明在功率大于240 W时会产生泡沫,所以实验使用时功率选择200 W,最大不超过220 W,在这附近做微小调整。此外,牦牛背最长肌所提取的蛋白质含量略高于肉牛,说明牦牛肉背最长肌具有高蛋白的特点[22],可能是牦牛为适应高寒草地生态环境条件,为在空气稀薄、牧草生长期短、气候寒冷的恶劣环境条件下自如生活而特有的肉质特征。
2.3 不同细胞破碎方法对肉牛和牦牛背最长肌双向电泳图谱的影响
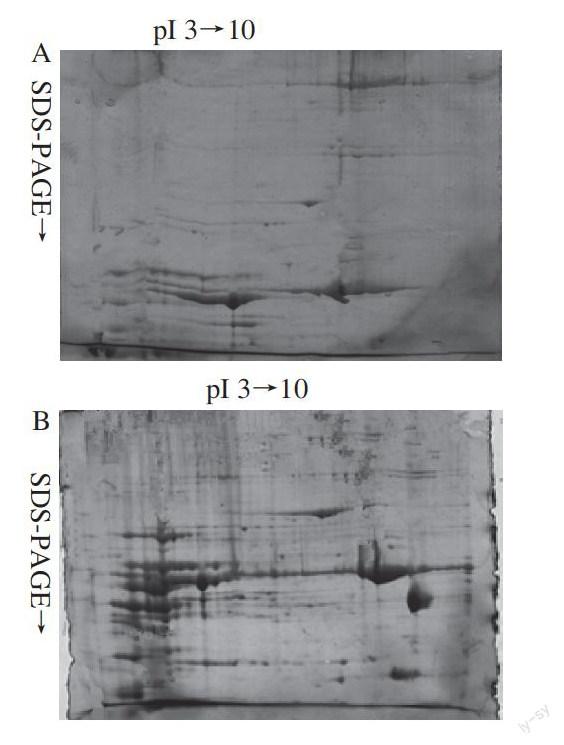
A. 液氮研磨法;B. 液氮研磨辅助超声波破碎法;C. 液氮研磨辅助玻璃珠破碎法。
图 1 肉牛背最长肌不同细胞破碎方法的双向电泳图谱比较
Fig.1 2-DE images of proteins in beef longissimus dorsi muscle with different cell disruption methods
A. 液氮研磨法;B. 液氮研磨辅助超声波破碎法;C. 液氮研磨辅助玻璃珠破碎法。
图 2 牦牛背最长肌不同细胞破碎方法的双向电泳图谱比较
Fig.2 2-DE images of proteins in in yak longissimus dorsi muscle with different cell disruption methods
使用PDQuest 8.0.1图像分析软件进行分析表明:液氮研磨法、液氮研磨辅助超声波破碎法和液氮研磨辅助玻璃珠破碎法所得肉牛背最长肌双向电泳图谱的蛋白点个数分别为(279±19)、(581±15)、(363±21)个;3 种细胞破碎方法提取所得牦牛背最长肌双向电泳图谱的蛋白点个数分别为(292±15)、(596±12)、(385±17)个。由图1~2可知,3 种方法中,液氮研磨辅助超声波破碎法得到的电泳图谱较清晰,蛋白点个数最多、分离较好,有利于下一步分析;液氮研磨辅助玻璃珠破碎法的电泳图谱背景较干净,蛋白斑点呈现得比较清晰,但蛋白点较少。猜测超声处理可以更好地破碎细胞,同时超声可能促进一些脂类或其他无法去除的物质的溶解,而玻璃珠破碎是纯机械力,不会造成类似的结果,超声样品的背景略高于玻璃珠破碎法所得样品,但总体差别不大。液氮研磨法的电泳图谱清晰度较差,蛋白点少、不利于分析。因此,液氮研磨辅助超声波破碎法是3 种方法中最为理想的牛肉、牦牛肉双向电泳细胞破碎方法,该法使得样品充分裂解,得到的蛋白质含量较高。
3 结 论
采用液氮研磨、液氮研磨辅助超声波破碎和液氮研磨辅助玻璃珠破碎3 种细胞破碎方法对肉牛、牦牛背最长肌蛋白质提取和双向电泳图谱效果的最佳方法进行研究,通过Bradford法分别测定不同方法提取的肉牛和牦牛背最长肌中蛋白质的含量。就肉牛背最长肌中蛋白质而言,液氮研磨辅助超声波破碎法((2.59±0.15)μg/μL)
显著高于液氮研磨辅助玻璃珠破碎法和液氮研磨法,液氮研磨辅助玻璃珠破碎法((2.01±0.04)μg/μL)显著高于液氮研磨法((1.77±0.11)μg/μL);3种细胞破碎方法提取的牦牛背最长肌蛋白质含量得到相同结论,其含量分别为(2.84±0.29)、(2.21±0.02)、(1.95±0.19)μg/μL。
采用PDQuest 8.0.1软件对双向电泳图谱的效果进行分析,液氮研磨法、液氮研磨辅助超声波破碎法和液氮研磨辅助玻璃珠破碎法所得肉牛背最长肌双向电泳图谱的蛋白点个数分别为(279±19)、(581±15)、(363±21)个;3种细胞破碎方法提取的牦牛背最长肌双向电泳图谱的蛋白点个数分别为(292±15)、(596±12)、(385±17)个。3种方法中,液氮研磨辅助超声波破碎法提取的肉牛、牦牛背最长肌蛋白质含量最高,数量最多,蛋白点分离程度最好。确定了液氮研磨辅助超声波破碎法是3种方法中最为理想的肉牛、牦牛双向电泳细胞破碎方法。
3种细胞破碎方法在牦牛背最长肌中所提取的蛋白质含量与肉牛背最长肌所提取的蛋白质含量差异不显著,但牦牛背最长肌蛋白质含量均高于肉牛背最长肌蛋白质含量,说明牦牛背最长肌具有高蛋白的特点,可能是牦牛为适应高寒草地生态环境而特有的肉质特征。
参考文献:
[1] GOBERT M, SAYD T, GATELLIER P, et al. Application to proteomics to understand and modify meat quality[J]. Meat Science, 2014, 98(3): 539-543.
[2] XU Y J, JIN M L, WANG L J, et al. Differential proteome analysis of porcine skeletal muscles between Meishan and Large White[J]. Journal of Animal Science, 2009, 87(8): 2519-2527.
[3] Aminian M, Nabatchian F, Vaisi-Raygani A, et al.
Mechanism of coomassie brilliant blue G-250 binding to cetyltrimethylammonium bromide: an interference with the Bradford assay[J]. Analytical Biochemistry, 2013, 434(2): 287-291.
[4] Suman S P, Nair M N, Chatli M K, et al. Differential abundance of sarcoplasmic proteome in beef inside and outside semimem branosus muscle[J]. Meat Science, 2014, 96(1): 490-491.
[5] Liu X D, Jayasena D D, Jung Y, et al. Differential proteome analysis of breast and thigh muscles between Korean native chickens and commercial broilers[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(6): 895-902.
[6] 王雪, 权春善, 王建华, 等. 不同细胞破碎方法对无细胞蛋白表达系统细胞抽提物活性的影响[J]. 中国生物工程杂志, 2011, 31(1): 46-50.
[7] Marcos B, Mullen A M. High pressure induced changes in beef muscle proteome: correlation with quality parameters[J]. Meat Science, 2014, 97(1): 11-20.
[8] Guglielmetti C, Mazza M, Pagano M, et al. Identification by a proteomic approach of a plasma protein as a possible biomarker of illicit dexamethasone treatment in veal calves[J]. Food Additives & Contaminants: Part A, 2014, 31(5): 833-838.
[9] Huang H, Larsen M R, Karlsson A H, et al. Gel-based phosphoproteomics analysis of sarcoplasmic proteins in postmortem porcine muscle with pH decline rate and time differences[J]. Proteomics, 2011, 11(20): 4063-4076.
[10] Fritz K S, Galligan J J, Hirschey M D, et al. Mitochondrial acetylome analysis in a mouse model of alcohol-induced liver injury utilizing SIRT3 knockout mice[J]. Journal of Proteome Research, 2012, 11(3): 1633-1643.
[11] LINK A J, LABAER J. 冷泉港蛋白质组学试验手册[M]. 北京: 化学工业出版社, 2012: 15-22.
[12] Wu W, Fu Y, Therkildsen M, et al. Molecular understanding of meat quality through application of proteomics[J]. Food Reviews International, 2015, 31(1): 13-28.
[13] Huang H, Larsen M R, Lametsch R. Changes in phosphorylation of myofibrillar proteins during postmortem development of porcine muscle[J]. Food Chemistry, 2012, 134(4): 1999-2006.
[14] 陆健, 郑建洲, 刘海军, 等. 河豚鱼骨骼肌蛋白组分析[J]. 食品科学, 2009, 30(21): 140-143.
[15] Carapito C, Burel A, Guterl P, et al. MSDA, a proteomics software suite for in-depth mass spectrometry data analysis using grid computing[J]. Proteomics, 2014, 14(9): 1014-1019.
[16] 赵瑞香, 王大红, 牛生洋, 等. 超声波细胞破碎法检测嗜酸乳杆菌
β-半乳糖苷酶活力的研究[J]. 食品科学, 2006, 27(1): 47-50.
[17] Hollung K, Veiseth E, Jia X, et al. Application of proteomics to understand the molecular mechanisms behind meat quality[J]. Meat Science, 2007, 77(1): 97-104.
[18] Deng G, Liu L, Wang H, et al. Establishment and optimization of two-dimensional electrophoresis (2-DE) technology for proteomic analysis of ramie[J]. International Journal of Agriculture and Biology, 2013, 15: 570-574.
[19] Lametsch R, Roepstorff P, M?ller H S, et al. Identification of myofibrillar substrates for μ-calpain[J]. Meat Science, 2004, 68(4): 515-521.
[20] TURANTA? F, KILI? G B, KILI? B. Ultrasound in the meat industry: general applications and decontamination efficiency[J]. International Journal of Food Microbiology, 2015, 198: 59-69.
[21] Chiu K Y, Sung J M. Use of ultrasonication to enhance pea seed germination and microbial quality of pea sprouts[J]. International Journal of Food Science and Technology, 2014, 49(7): 1699-1706.
[22] Li Q, Ma Y, He S, et al. Effect of pH on heat stability of yak milk protein[J]. International Dairy Journal, 2014, 35(1): 102-105.

