二化螟水稻、茭白种群幼虫口器和触角及其感器扫描电镜观察
钟海英 张珏锋 李芳 陈建明
二化螟水稻、茭白种群幼虫口器和触角及其感器扫描电镜观察
钟海英 张珏锋 李芳 陈建明*
(浙江省植物有害生物防控重点实验室省部共建国家重点实验室培育基地,浙江省农业科学院 植物保护与微生物研究所,杭州310021;*通讯联系人,E-mail: chenjm63@163.com)
【目的】为明确二化螟不同寄主种群幼虫口器和触角及其感器,对上述结构的超微形态进行了观察。【方法】选择二化螟水稻、茭白种群幼虫口器和触角及其感器为研究材料,利用扫描电子显微镜进行观察。【结果】表明,二化螟两种群梗节具2个刺形感器、3个锥形感器;上唇具6对刺形感器;上颚切齿叶具7个端齿,基外侧具2个刺形感器;轴节和茎节各具1个刺形感器;外颚叶具3个锥形感器、2个刺形感器和2个栓锥感器;下颚须侧缘具1个指形感器;下唇须端部有1个刺形感器。两种群间鞭节和下颚须感器数目存在差异:茭白种群鞭节具1个栓锥感器和2个锥形感器,水稻种群则具1个栓锥感器和1个锥形感器;茭白种群下颚须具5个锥形感器和3个柱形感器,而水稻种群具4个锥形感器和4个柱形感器。在感器长度上,茭白种群部分龄期幼虫的部分刺形感器(分布于梗节、轴节、茎节)、锥形感器(分布于梗节、下颚须、外颚叶)、栓锥感器(分布于鞭节、外颚叶)显著长于水稻种群的相应感器。茭白种群(1~5龄)的部分柱形感器(分布于下颚须)、3~5龄幼虫部分刺形感器(分布于外颚叶)显著短于水稻种群的相应感器。
二化螟;口器;触角;感器;超微形态
昆虫的触角主要司嗅觉、触角和听觉功能,在昆虫的化学通讯、声音通讯及触觉通讯中有着重要作用。口器是昆虫的摄食器官。触角和口器上集中分布的各类感器是昆虫对各种外界刺激产生反应的构造,与神经系统一起调控昆虫的行为[1]。根据感器形态特征及在触角表皮的着生部位,分为刺形、锥形、栓锥形、板形等;根据生理功能分为化学感器和机械感器,其中,前者又分为嗅觉感器、触觉感器、温度感器和湿度感器等[2]。不同种类昆虫的感器类型、数目、分布和功能不尽相同。感器与昆虫生理行为紧密相关,在判别食物、寄主选择、求偶等行为中发挥着非常重要的作用。各类感器感知并传导信息分子时具有高度的专一性和灵敏性,可从众多的气味物质中识别微量的特异性化合物,从而引起相应的行为反应[3]。昆虫找到食物后能否成功取食,往往取决于口器和触角上的感器对食物的感知。因此,感器的类型、功能和机制一直是化学生态学家研究的热点。研究幼虫触角和口器上的感器,是探索昆虫重要行为的前提,有助于了解幼虫的食性机理,为昆虫系统发育和进化研究提供重要依据;同时,对探索昆虫取食行为活动本质及防治害虫具有重要意义。
二化螟(Chilo suppressalis)Walker 俗称钻心虫,隶属鳞翅目(Lepidoptera)草螟科(Crambidae)。幼虫是一种重要的钻蛀性、寡食性害虫,主要取食禾本科水稻、茭白等作物。二化螟属兼性滞育种类,以4至6龄幼虫在稻蔸滞育越冬,平均每年发生1~5代,江淮稻区常年发生2代[4]。二化螟幼虫在水稻苗期为害造成枯鞘、枯心,孕穗期和穗期为害造成枯孕穗、白穗和虫伤株等症状,严重影响水稻的产量和质量[5]。近年来,由于寄主植物的大面积种植、品种更替、耕作制度变更及气候变化等因素的影响,二化螟种群数量近年来呈回升趋势,危害逐年加重,素有“南螟北蝗”之称。
水稻和茭白是二化螟的重要寄主。茭白和水稻同属禾本科作物,所需生态环境十分接近,且在生物学和形态学上也有不少相似地方。近年来,茭白种植面积逐年扩大,许多稻区出现水稻、茭白插花种植,茭白田已成为与水稻田最密切相关的非稻田生境,与稻田生境共处于同一生态系统中,成为稻田生境多样性的“天敌库”和“害虫库”。这种生态系统导致了二化螟的发生为害更加复杂化,给害虫防治工作带来了许多新问题,严重影响我国水稻、茭白等产业的可持续发展。因此,了解二化螟与其寄主植物的相互作用及影响因素是防治二化螟的重要前提。
经过长期的适应进化,二化螟已逐渐分化为两个不同的同域寄主种群,即茭白种群和水稻种群。截至目前,二化螟水稻种群和茭白种群的比较研究主要集中在生物学[6]、生态学特性[7-15]等方面。对于口器和触角及感器的超微形态,仅见于鳞翅目其他种类幼虫[16-23]。然而,作为重要的水稻钻蛀性害虫,二化螟各龄幼虫口器和触角及感器迄今未见报道。由于二化螟幼虫专食禾本科植物,对寄主植物挥发物的感知与头部感器(尤其是触觉和口器上分布的感器)密切相关。因此,本研究采用扫描电子显微镜技术对二化螟水稻种群和茭白种群幼虫触角和口器构造、感器的形态特征、种类和分布进行了观察,以期为进一步探讨这些感器的功能和感应机制提供理论依据,为利用化学生态学方法持续控制该虫提供科学依据。
1 材料与方法
1.1试虫来源
2015年5月从浙江省水稻主产区(浙江余姚市三七镇)、茭白主产区(浙江省缙云县新建镇)分别采集二化螟越冬幼虫,带回实验室饲养。室内用空调控制温度为(28±1)℃,光周期为16 h 光照/8 h黑暗(用定时器控制),相对湿度90%左右。选取1至6龄健康幼虫为试验材料。
1.2标本处理与观察
在Nikon SMZ 1500型光学解剖镜下用镊子和刀片切下二化螟幼虫头部,并放入2.5%戊二醛(0.1 mol/L酸缓冲液,pH 7.2)固定,用0.1 mol/L磷酸缓冲液(pH 7.2)漂洗数次,用不同浓度的乙醇(30%,50%,70%,80%,90%,100%)进行逐级脱水。然后用无水乙醇和叔丁醇分别以一定比例混合置换酒精15 min。用纯叔丁醇置换30~40 min,将样品放入滴有纯叔丁醇的样品仓中冷冻干燥约3 h。干燥后的样品利用双面导电胶粘到样品台上,置入真空喷涂仪内进行喷金,在S-3400N型电子显微镜(加速电压5~15 kV)下观察并拍照。各类感器均观察15个重复。

图1 二化螟水稻种群幼虫的形态和头壳扫描电镜分析Fig. 1. External morphology and the SEM micrographs of head capsule of rice population of Chilo suppressalis.
1.3数据统计与分析
感器拍照后,用Sigma Scan Pro Measurement System 5.0软件测量。用DPS软件进行数据分析。
2 结果与分析
2.1水稻二化螟幼虫口器和触角
二化螟同一种群各龄幼虫间口器和触角及其感器的形态、分布和数目极为相似,仅感器的长度存在差异。因此,本文仅提供4龄幼虫的电镜图片,同时提供各龄幼虫口器和触角上的感器长度。
二化螟各龄幼虫的头壳近球形,背面有一条呈倒“Y”形的蜕裂线(图1-A),额唇基沟十分显著。头部侧下方有侧单眼6个,呈弧形排列(图1- B和C)。幼虫头式属于下口式,为咀嚼式口器。触角1对,位于口器两侧,每个触角包括3节。每种感器在头部不同部位的分布和数目均不相同。
通过观察发现,二化螟各龄幼虫头部感器共有5种类型,即刺形感器、锥形感器、栓锥感器、柱形感器和指形感器。其中,刺形感器细长,刚毛状,末端极尖,倾斜或直立于臼状窝内;该类感器在二化螟幼虫头部分布较广,散布于头壳表面,长短不一。锥形感器形似刺状,但较短粗且端部较钝,着生于臼状窝内。栓锥形感器较为粗大,基部隆起,隆起部分的顶端有小腔,腔内有1个锥状突起;隆起部分与锥形突起长度不同。柱形感器呈柱形,较粗长,顶端钝圆,着生于表皮凹陷形成的臼状窝内。这类感器在其他鳞翅目幼虫研究中未提及。指形感器较为宽大,形似拇指。
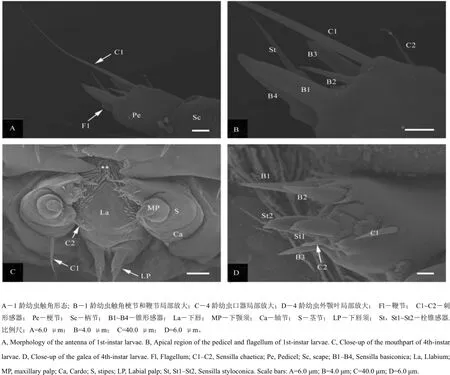
图2 二化螟水稻种群幼虫的口器和触角及其感器扫描电镜分析Fig. 2. SEM micrographs of antenna and mouthparts of rice population of Chilo suppressalis.
2.1.1 触角
二化螟幼虫触角由柄节、梗节和鞭节组成(图1-B~C; 图2-A~B)。柄节位于最基部,粗短,未见感器分布。梗节虽较柄节细,但长度近似。梗节顶端分布3个锥形感器(B1~B3)和2个刺形感器(C1~C2)(图2-B)。其中,锥形感器B1最长,B2最短,B3长度介于前两者之间。刺形感器C1远长于C2。鞭节位于梗节的端部,较柄节和梗节明显缩短,长度约为梗节的1/3。鞭节上分布2种感器,分别是1个栓锥感器(St)和1个锥形感器(B4)。栓锥感器锥体粗短,感觉锥细长,长度约为锥体长度的2倍。
2.1.2 口器
二化螟幼虫口器由上唇、1对上颚、1对下颚和下唇组成,这些组成部分具有如下特征。
2.1.2.1 上唇
上唇近梯形,前缘中央具倒“V”字形凹刻(图1-B)。表面分布有6对刺形感器。这些感器长短近似,左右两外侧缘、内侧缘各对称分布3个。
2.1.2.2 上颚
上颚是位于上唇之后的锥状坚硬构造,其发达且高度骨化。上颚由前端的切齿叶和后部的臼齿叶组成。切齿叶端部有7个发达的齿,用以切断和撕裂食物;臼齿叶表面光滑,用来磨碎食物(图1-B; 3-C~D)。上颚基部外侧具2个刺形感器(C1和C2),其中C2远长于C1。
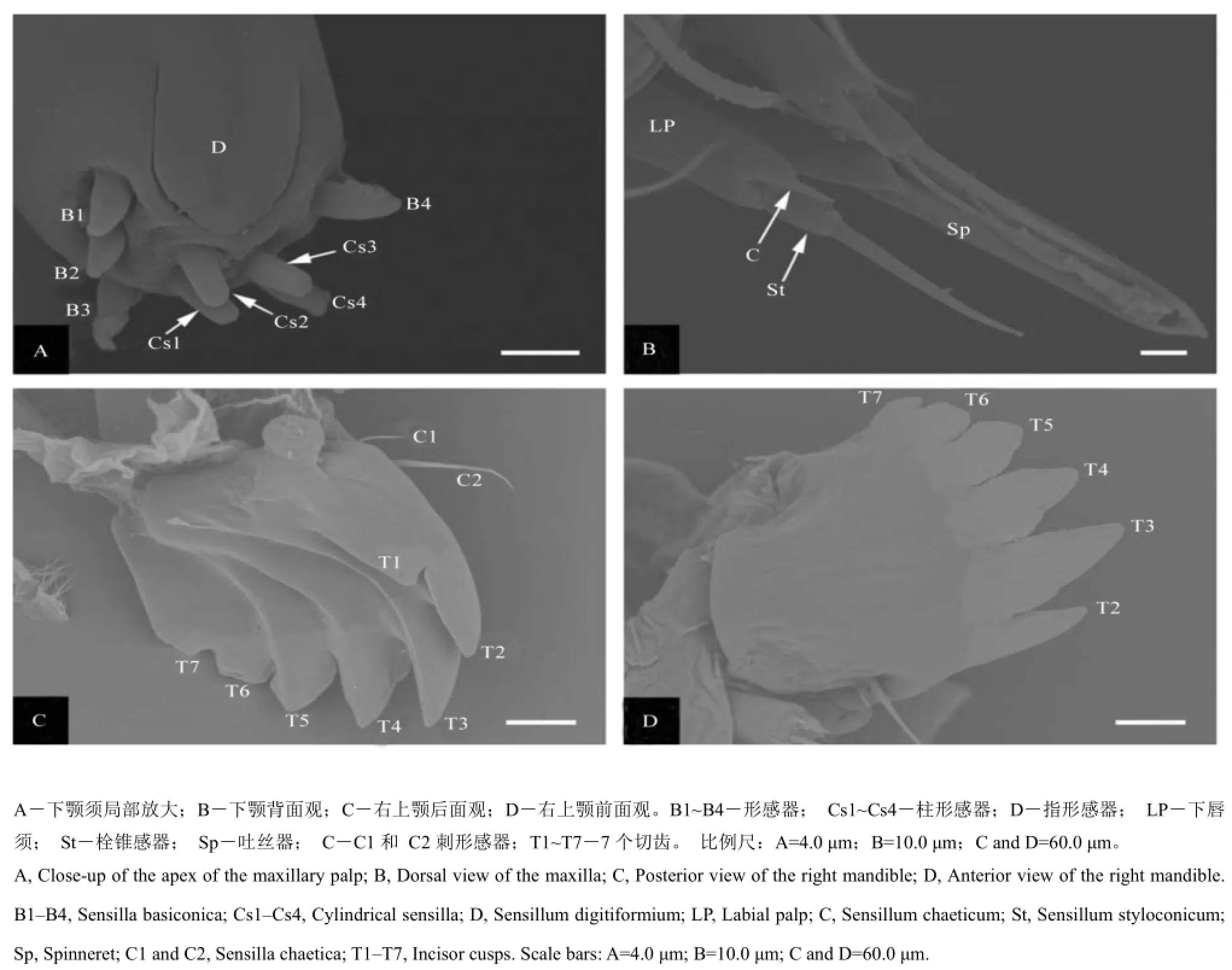
图3 二化螟水稻种群5龄幼虫的口器及其感器扫描电镜分析Fig. 3. SEM micrographs of antenna and mouthparts of rice population of 5th-instar Chilo suppressalis.
2.1.2.3 下颚
下颚是位于上颚之后、下唇之前辅助幼虫刮切和握持食物的构造,由轴节、茎节、外颚叶、内颚叶和下颚须5部分构成(图1-B; 图2-C)。外颚叶和下颚须的端部分布成丛的感器(图2-D; 图3-A)。轴节后外缘和茎节前内缘各分布1个刺形感器(C1, C2),其中轴节感器较茎节感器长(图2-C)。外颚叶顶端分布3种类型的感器:锥形感器(B1~B3)、刺形感器(C1~C2)和栓锥感器(St1~St2)(图2-D)。栓锥感器位于2个锥形感器之间,锥体粗壮光滑,感觉锥细短,端部钝圆,基部膨大。下颚须包括基节和端节,其中端节显著长于基节。端节侧缘有一个宽大的指形感器(D),顶端分布4个锥形感器(B1~B4)和4个柱形感器(Cs1~Cs4)(图3-A)。
2.1.2.4 下唇
下唇包括1对下唇须和1个延长的吐丝器。下唇须端部近栓锥感器(St)处有1个短刺形感器(C)。吐丝器呈管状,末端斜切;端部中央有一圆形开口(图1-B; 图3-B)。下唇须主要司协助下颚须感触食物和辅助取食的功能。
2.2茭白二化螟幼虫口器和触角
除了二化螟茭白种群触角和口器上的感器长度、鞭节和下颚须感器的数目与水稻种群的感器存在差异外,其余感器的类型、数目及分布极类似于水稻种群。在茭白二化螟幼虫中,鞭节上分布3种感器,分别是1个栓锥感器(St)和2个锥形感器(B4~B5)(图4-A);下颚须顶端分布5个锥形感器(B1~B5)和3个柱形感器(Cs1~Cs3)(图4-B)。
2.3茭白二化螟和水稻二化螟各龄幼虫感器长度
茭白二化螟和水稻二化螟一龄幼虫触角梗节的锥形感器(B2)和刺形感器(C1),鞭节的栓锥感器(St)、下颚须的柱形感器(Cs2)和锥形感器B1~B4、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1~B3)、栓锥感器(St1~St2)及刺形感器(C1)的长度差异(极)显著,而其他感器的长度差异不显著。茭白二化螟梗节的锥形感器(B2)、鞭节的栓锥感器(St)和锥形感器(B1~B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1~B3)、栓锥感器(St1~St2)及刺形感器(C1)显著长于水稻二化螟的相应感器。梗节的刺形感器(C1)、下颚须的柱形感器(Cs2)则显著短于水稻二化螟(表1)。
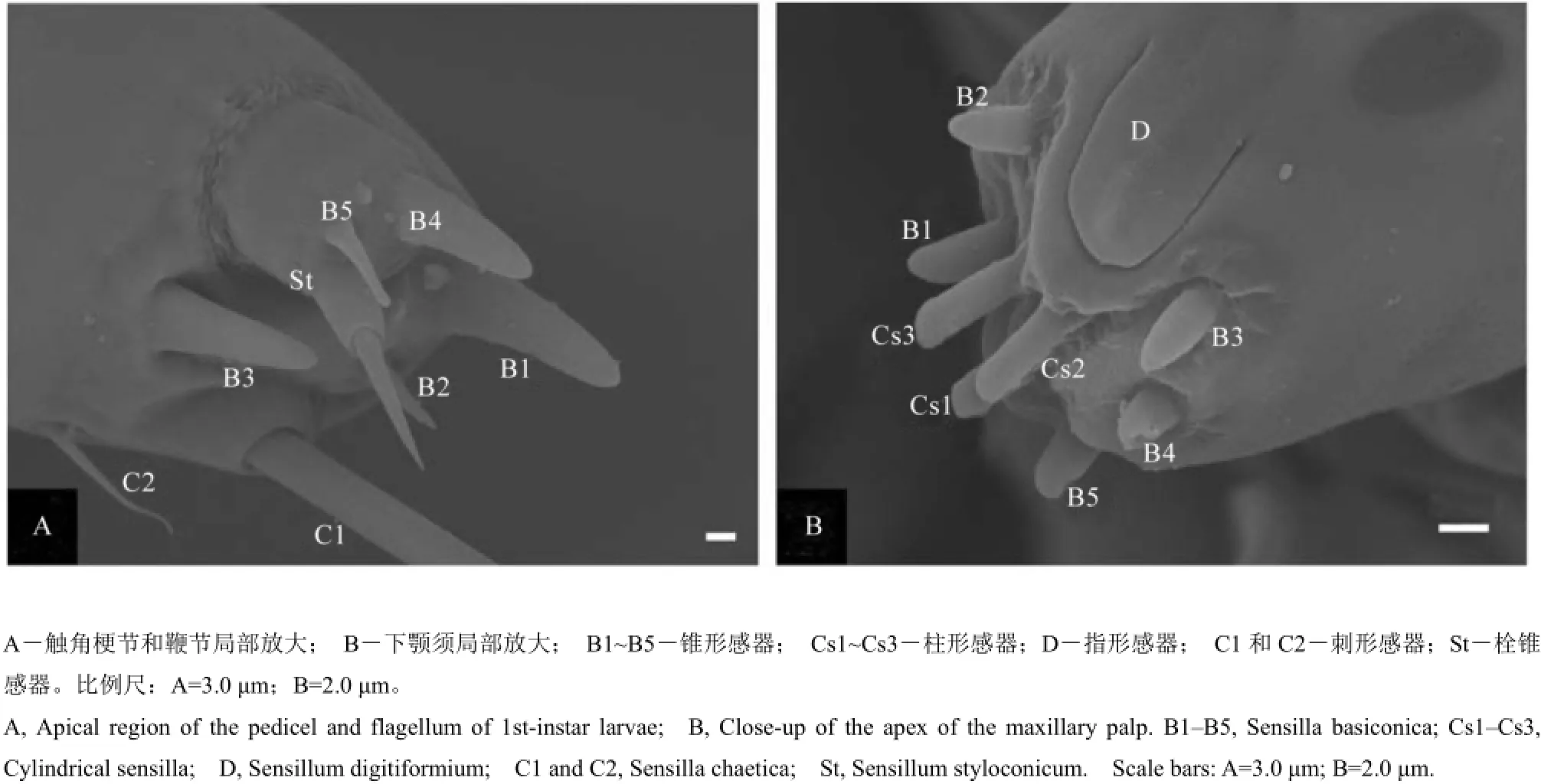
图4 二化螟茭白种群5龄幼虫的口器及其感器扫描电镜分析Fig. 4. SEM micrographs of mouthparts of 5th-instar larvae of water-oat population of Chilo suppressalis.
二化螟茭白、水稻种群二龄幼虫触角鞭节的栓锥感器(St)、下颚须的柱形感器(Cs2)和锥形感器(B1~B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1~B3)、栓锥感器(St1~St2)及刺形感器(C1、C2)的长度差异(极)显著,而其他的感器长度差异不显著。茭白二化螟鞭节的栓锥感器(St)和锥形感器(B1-B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1-B3)、栓锥感器(St1- St2)及刺形感器(C1~C2)显著长于水稻二化螟。下颚须的柱形感器(Cs2)则显著短于水稻二化螟(表1)。
在茭白二化螟和水稻二化螟中,三龄幼虫下颚须的柱形感器(Cs1~Cs2)和锥形感器(B1~B4)、轴节的刺形感器(C1)、外颚叶的锥形感器(B1~B3)、栓锥感器(St1~St2)及刺形感器(C1~C2)的长度存在(极)显著差异,而其他的感器长度无显著差异。茭白二化螟下颚须的柱形感器(Cs1~Cs2)、外颚叶的刺形感器(C2)显著短于水稻二化螟。茭白种群的下颚须的锥形感器(B1~B4)、轴节的刺形感器(C1)、外颚叶的锥形感器(B1~B3)、栓锥感器(St1~St2)及刺形感器(C1)则显著长于水稻二化螟(表1)。
二化螟两种群四龄幼虫触角梗节的锥形感器(B3)和刺形感器(C1)、下颚须的柱形感器(Cs2)和锥形感器(B1~B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1~B3)、栓锥感器(St2)及刺形感器(C2)的长度在茭白种群和水稻种群间存在(极)显著差异。茭白种群梗节的锥形感器(B3)和刺形感器(C1)、下颚须的锥形感器(B1~B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B3)和栓锥感器(St2)均(极)显著长于水稻种群的相应感器。水稻种群下颚须的柱形感器(Cs2)、外颚叶的锥形感器(B1~B2)和刺形感器(C2)(极)显著长于茭白种群的相应感器(表2)。
二化螟茭白、水稻种群五龄幼虫触角梗节的锥形感器(B3)和刺形感器(C1)、鞭节的栓锥感器(St)、下颚须的柱形感器(Cs1~Cs2)与锥形感器(B1~B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1~B2)、栓锥感器(St2)及刺形感器(C1~C2)的长度在两种群间存有(极)显著差异。茭白种群鞭节的栓锥感器(St)、下颚须的柱形感器(Cs1)和锥形感器(B1-B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B1-B2)、栓锥感器(St2)及刺形感器(C1)(极)显著长于水稻种群的相应感器。而茭白种群梗节上分布的的锥形感器(B3)和刺形感器(C1)、下颚须的柱形感器(Cs2)、外颚叶的刺形感器(C2)(极)显著短于水稻种群的相应感器(表2)。
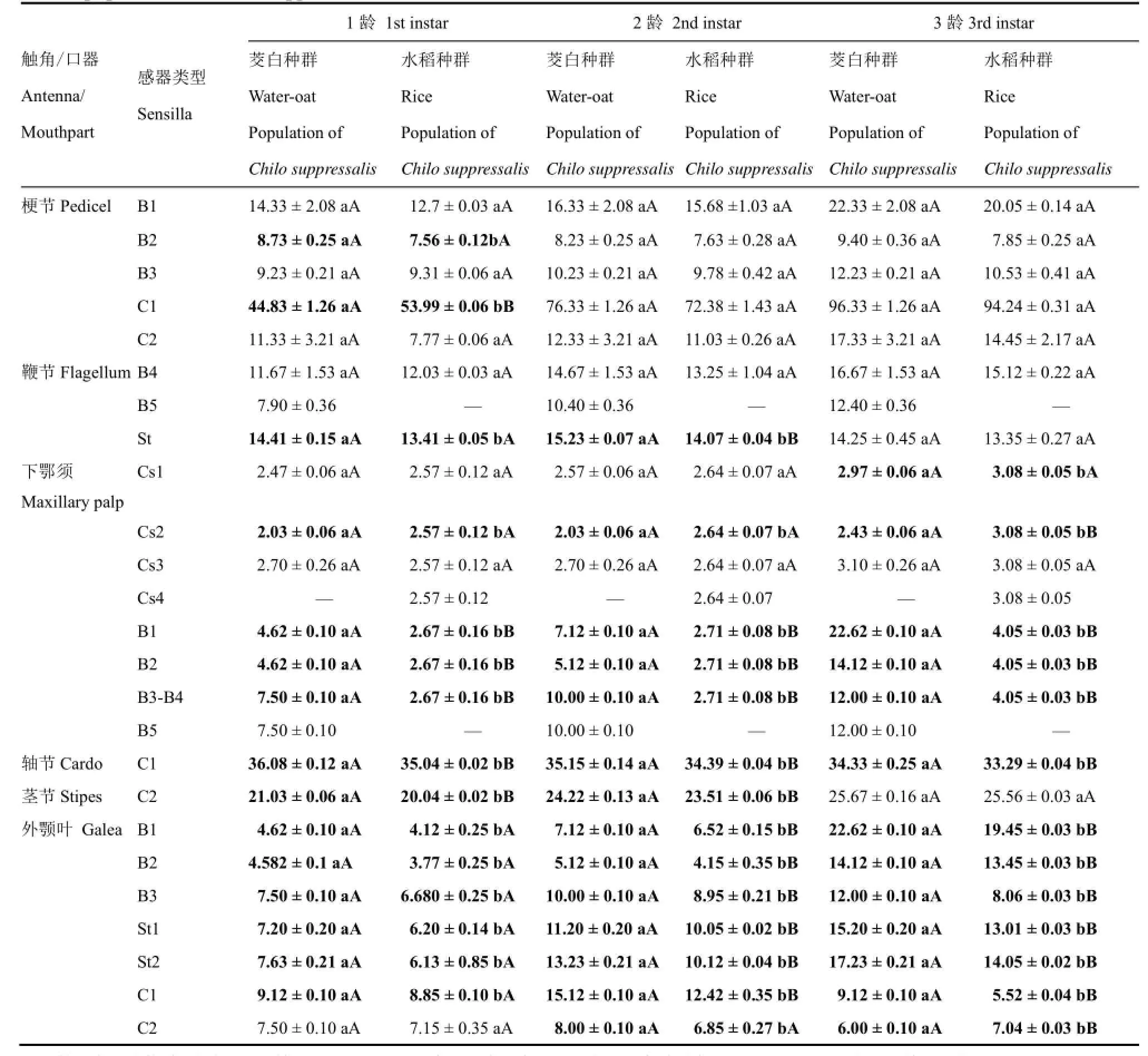
表 1 二化螟茭白、水稻种群1龄幼虫触角和口器感器比较Table 1. Comparison of the antenna and mouthparts sensilla of the 1st to 3rd instars larvae between water-oat and rice populations of Chilo suppressalis
二化螟六龄幼虫触角梗节的锥形感器(B1~B3)和刺形感器(C1)、鞭节的栓锥感器(St)、下颚须的锥形感器(B1~B4)、轴节的刺形感器(C1)、茎节的刺形感器(C2)、外颚叶的锥形感器(B2~B3)、栓锥感器(St1~St2)及刺形感器(C1~C2)的长度在茭白、水稻种群间存在(极)显著差异。茭白二化螟的上述感器均(极)显著长于水稻种群的相应感器(表2)。

表2 二化螟茭白、水稻种群5龄幼虫触角和口器及其感器比较Table 2. Comparison of the antenna, mouthparts sensilla of the 4th to 6th instar larvae between water-oat and rice populations of Chilo suppressalis.
比较形态学研究结果表明,二化螟水稻种群和茭白种群口器和触角及其感器的整体构造相似,除了两种群间各龄幼虫触角和口器上的感器长度存有差异外,触角鞭节和口器下颚须上的感器数目也存在不同。茭白二化螟幼虫鞭节上分布3种感器,即1个栓锥感器(St)和2个锥形感器(B4~B5);下颚须顶端分布5个锥形感器(B1~B5)和3个柱形感器(Cs1~Cs3)。水稻二化螟鞭节上分布2种感器,即1个栓锥感器(St)和1个锥形感器(B4);下颚须顶端分布4个锥形感器(B1~B4)和4个柱形感器(Cs1~Cs4)。两种群口器和触角及感器的模式结构特点见图5。
3 讨论
本研究采用扫描电子显微镜比较了水稻重要害虫——二化螟幼虫头部口器、触角及其感器。结果表明,二化螟同一种群不同龄期幼虫的口器和触角构造、感器形态、分布及数目均相似,这与Chapman[1]的报道一致。然而,随着幼虫龄期的逐渐增加,其感器长度发生变化,这与幼虫随着蜕皮进行的体型增大有关。但6龄幼虫的一些感器长度则变小,这可能与幼虫即将进入蛹期有关。
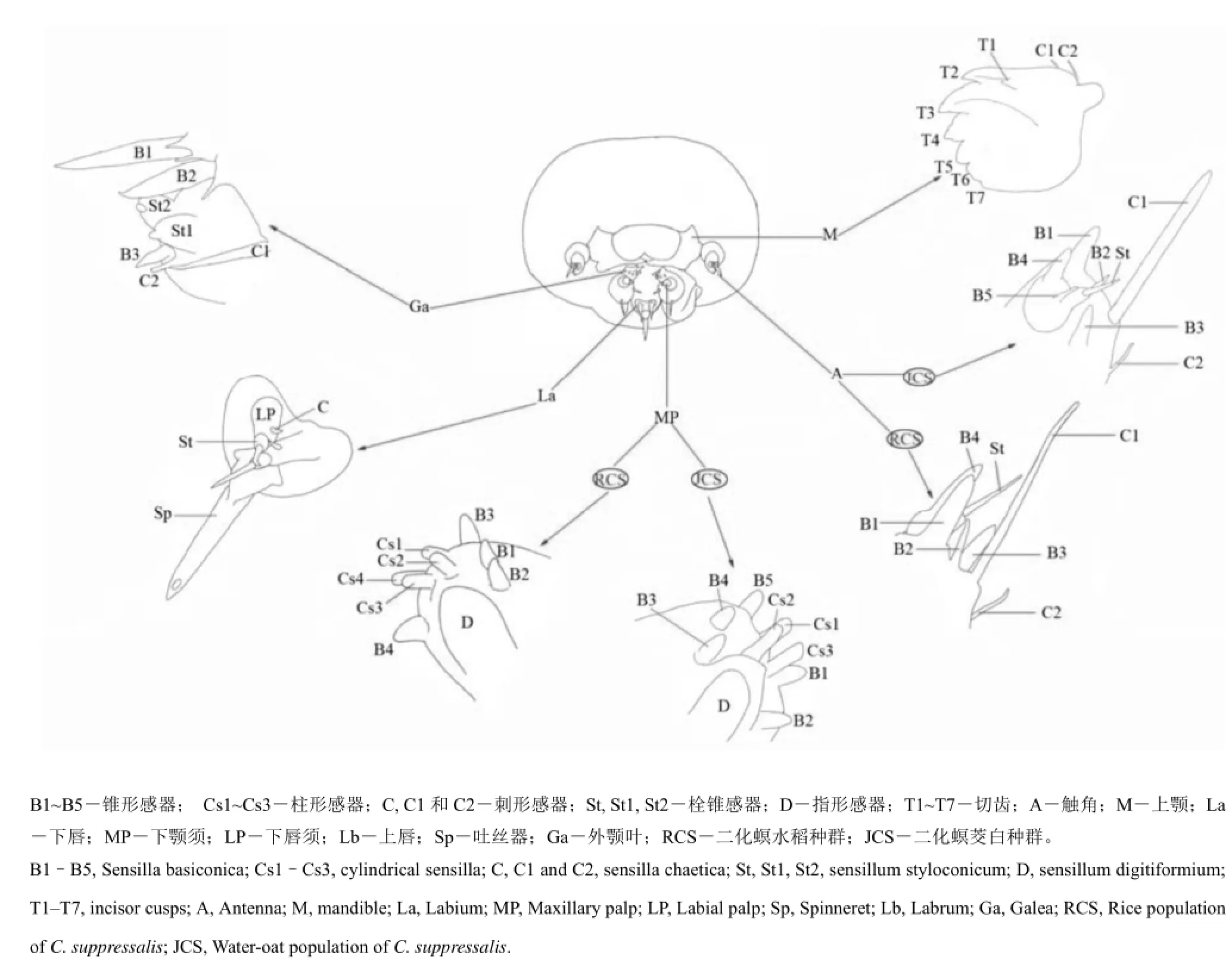
图5 二化螟头部触角和口器上感器的分布模式Fig. 5. Schema diagram of sensilla distributed on the antenna and mouthparts of larval Chilo suppressalis.
其他昆虫不同种群感器的差异已有相关报道,相关研究表明,不同种群感器差异归因于昆虫对其生境的适应[24,25]。种群间感器的差异也可能与表型的可塑性有关,因为基因相似的物种因生境差异可能拥有不同的表型[26,27]。在二化螟不同种群中,茭白种群鞭节的锥形感器数目较水稻种群的多1个,而下颚须的锥形感器和柱形感器数目较水稻种群的各少1个。在感器长度上,茭白种群部分龄期幼虫的鞭节、外颚叶上的部分栓锥感器、锥形感器(分布于梗节、下颚须、外颚叶)和刺形感器(分布于梗节、轴节、茎节)显著长于水稻种群。茭白种群1~5龄幼虫下颚须上的部分柱形感器、3~5龄幼虫外颚叶上的部分刺形感器显著短于水稻种群。二化螟两种群感器数目和长度方面的差异表明二化螟两种群在适应各自寄主的过程中,感器逐渐出现了分化;这些差异可能是该种昆虫不同种群对不同寄主和生境条件适应的最终结果。
二化螟两种群口器和触角构造与其他鳞翅目幼虫的相应器官也相似。然而,上颚切齿叶的齿数在不同种类间存有差异。例如,二化螟(草螟科Crambidae)幼虫切齿叶有7个齿,云杉卷叶蛾[Choristoneura fumiferana (卷蛾科Tortricidae)]仅有6个齿[28],桃蛀果蛾[Carposina sasakii (蛀果蛾科Carposinidae)]、山茱萸蛀果蛾[Carposina coreana (蛀果蛾科Carposinidae)]和梨小食心虫 [Grapholita molesta (卷蛾科Tortricidae)]仅有5个齿[20,29,30]。这些鳞翅目昆虫虽隶属不同科,但幼虫上颚齿数的分化似乎仅与取食的寄主植物部位有关:云杉卷叶蛾幼虫取食新生长的针叶末梢或芽根部;桃蛀果蛾、山茱萸蛀果蛾和梨小食心虫均蛀入果实进行取食[29,30];二化螟幼虫蛀入水稻茎秆取食。寄主植物的组织结构差异可能导致幼虫上颚齿在长期进化过程中发生相应的特化。
昆虫的感器是其与外界进行信息交流的重要物质基础,不同类型感器执行不同功能,同一类感器也可能同时行使不同功能。刺形感器是典型的机械性感受器,可感触气流或物体震动等[31]。锥形感器和栓锥感器是一类重要的化学感器,在区分寄主植物中发挥重要作用,具有味觉和嗅觉功能,兼具机械作用[28,18,19]。二化螟两种群幼虫口器和触角上感器分布的5 种感器(即锥形、刺形、栓锥形、柱形和指形感器)在二化螟感知寄主植物的组织硬度及挥发物、寄主植物表面气流等方面发挥重要作用。
触角是接受外界化学信号物质的主要器官,依赖触角感器寻找生境和寄主。二化螟两种群幼虫口器和触角的感器分布、类型和数目与其他鳞翅目幼虫的感器存在异同。桃蛀果蛾和梨小食心虫的触角鞭节分布3个锥形感器,梗节分布2个刺形感器[20,30]。但二化螟两种群和山茱萸蛀果蛾幼虫触角梗节分布3个锥形感器和2个刺形感器[29];山核桃透翅蛾[Sphecodoptera sheni (透翅蛾科Sesiidae)]触角的梗节顶端分布3个刺形感器和2个锥形感器[22]。与山核桃透翅蛾触角鞭节感器类型和数目相似[22],二化螟水稻种群幼虫鞭节也分布1个栓锥感器和1个锥形感器,而茭白种群幼虫鞭节分布1个栓锥感器和2个锥形感器,山茱萸蛀果蛾鞭节分布1个栓锥感器和3个锥形感器[29]。该差异需进一步通过研究更多种类进行确定。下颚须、外颚叶端部的感器在鳞翅目不同种类幼虫间存在很大差异。云杉卷叶蛾下颚须端部的感器为8个小突起[28],向日葵螟[Homoeosoma electellum (螟蛾科Pyralidae)]幼虫的则为8个锥形感器[49],桃蛀果蛾和梨小食心虫的下颚须端部有7个锥形感器和1个栓锥感器[20,30];二化螟水稻种群幼虫下颚须端节端部则分布4个锥形感器和4个柱形感器,茭白种群相应构造则分布5个锥形感器和3个柱形感器。二化螟两种群幼虫外颚叶顶端有 3个锥形感器(B1~B3)、2个刺形感器和2个栓锥感器,类似于桃蛀果蛾幼虫[20],仅比梨小食心虫少1个刺形感器[30]。昆虫触角和口器上的化学感器能特定地感受寄主植物的化合物[1]。二化螟两种群幼虫口器和触角上独特分布的感器形态及数目可能与其特有的寄主植物密切相关;特化的各类感器感受来自寄主植物的气味完成识别功能。
二化螟两种群幼虫下颚须端节侧缘有1个宽大的指形感器,类似的感器发现于桃蛀果蛾和山茱萸蛀果蛾幼虫口器下颚须端部[20,29]。这类感器在大多鳞翅目幼虫中较短,未伸达下颚须端部,而在山茱萸蛀果蛾幼虫中则较长,伸达下颚须端部的锥形感器[29]。这类感器不仅能感知CO2浓度[32],而且对振动刺激和温度较为敏感[28]。
二化螟雌成虫一般将卵产于水稻叶片主脉两侧,幼虫孵化后主要依靠嗅觉感器感受水稻茎杆的位置。外颚叶上的栓锥感器主要司味觉功能,感受不同化合物的刺激,对于区分寄主植物和非寄主植物起着至关重要的作用[28,33]。然而,本研究仅对二化螟两种群幼虫触角和口器的感器形态进行了观察和描述,作为寡食性害虫,二化螟只取食禾本科的少数植物茎秆,其幼虫头部感器的感觉细胞、感觉谱以及感受器在寄主选择与取食为害过程中的作用等,有待通过透射电子显微镜技术、电生理技术和分子生物学技术加以研究并考证,以揭示二化螟不同寄主种群感知各自寄主植物的分子机理。
[1] Chapman R F. The insects: Structure and Function. Cambridge: Cambridge University Press, 1998: 1-770.
[2] Zacharuk R Y. Ultrastructure and function of insect chem osensilla. Annu Rev Entomol, 1980, 25(1): 27- 47.
[3] Städler E, Renwick J A A, Radke C D. Tarsal contact chemoreceptor response to glucosinolates and cardenolides mediating oviposition in Pieris rape. Physiol Entomol, 1995, 20(2): 175-187.
[4] 汪信庚, 程家安. 二化螟滞育的研究. 浙江农业大学学报, 1993, 19(2): 170-174.
Wang X G, Chen J A. Study on diapause of the striped rice borer (Chilo suppressalis Walker). J Zhejiang Agric Univ, 1993, 19(2): 170-174.
[5] Muralidharan K, Pasalu I C. Assessments of crop losses in rice ecosystems due to stem borer damage (Lepidoptera: Pyralidae). Crop Prot, 2006, 25(5):409-417.
[6] 孙丽娟, 戴华国, 衣维贤, 陆永钦. 二化螟水稻类群与茭白类群成虫羽化节律和交配节律研究. 昆虫知识, 2002, 39(6): 421-423.
Sun L J, Dai H G, Yi W X, Lu Y Q. The adult emergencerhythm and mating rhythm of rice host population and water-oats host population of the rice stem borer, Chilo suppressalis. Entomol Knowl, 2002, 39(6): 421-423.
[7] Matsukura K, Hoshizaki S, Ishikawa Y, et al. Differences in timing of the emergence of the overwintering generation between rice and water-oats populations of the striped stem borer moth, Chilo suppressalis (Lepidoptera:Crambidae). Appl Entomol Zool, 2009, 44(3): 485-489.
[8] 徐红星, 俞晓平, 吕仲贤, 陈建明, 郑许松, 陶林勇,卜卫良. 水稻田和茭白田越冬代二化螟成虫习性研究.浙江农业学报, 2001, 13(3): 157-160.
Xu H X, Yu X P, Lu Z X, Chen JM, Zheng X S, Tao LY, Bu W L. Study on the biology of over-wintered striped stem borer, Chilo suppressalis (Walker). Acta Agric Zhejiangensis, 2001, 13(3): 157-160.
[9] 俞晓平, 徐红星, 吕仲贤, 陈建明, 郑许松, 陶林勇.水稻田和茭白田二化螟的比较研究. 生态学报, 2002, 22(3): 341-345.
Yu X P, Xu H X, Lu Z X, Chen J M, Zheng X S, Tao L Y. Differentiation of striped stem borer (SSB), Chilo suppressalis Walker from rice and Zizania caduciflora habitats. Acta Ecolo Sin, 2002, 22(3): 341-345.
[10] 陈建明, 俞晓平, 郑许松, 徐红星, 吕仲贤, 张珏锋. 二化螟取食茭白和水稻后生物学特征表现的比较. 浙江农业学报, 2003, 15(3): 139-143.
Chen J M, Yu X P, Zheng X S, Xu H X, Lu Z X, Zhang J F. Biological performances of the striped stem borer, Chilo suppressalis Walker fed on Jiaobai, Zizania caduciflora, and rice plants. Acta Agric Zhejiangensis, 2003, 15(3):139-143.
[11] 韩永强, 郝丽霞, 侯茂林. 北方稻田和茭白田二化螟越冬幼虫生物学特性的比较. 中国生态农业学报, 2009, 17(3): 541-544.
Han Y Q, Hao L X, Hou M L. Comparison of overwintered bionomics of Chilo suppressalis larvae from paddy-rice field with those from water-oat field in North China. Chinese J Eco-Agric, 2009, 17(3): 541-544.
[12] Ueno H, Furukawa S, Tsuchida K. Difference in the time of mating activity between host-associated populations of the rice stem borer, Chilo suppressalis(Walker). Entomol Sci, 2006, 9(3): 255-259.
[13] Hou M L, Lin W, Han Y Q. Seasonal changes in supercooling points and glycerol content in overwintering larvae of the asiatic rice borer from rice and water-oat plants. Environ Entomol, 2009, 38(4): 1182-1188.
[14] Ding N, Dakub P, Zhu Q, Ma W, Zhu F, Wang X. A comparison of the larval overwintering biology of the striped stem borer, Chilo suppressalis(Lepidoptera:Crambidae), in rice and water-oat fields. Appl Entomol Zool, 2013, 48(2): 147-153.
[15] 全为礼, 丁楠, 周睿琦, 马伟华,王小平. 二化螟寄主种群及种群间生殖隔离形成机制研究. 环境昆虫学报, 2014, 36(4): 597-604.
Quan W L, Ding N, Zhou R Q, Ma W, Wang X. Host-plant races and the reproductive isolation mechanisms involved in race formation in Chilo suppressalis. J Environ Entomol, 2014, 36(4): 597-604.
[16] 魏辉, 杨广, 王前梁, 侯有明 , 尤民生. 小菜蛾幼虫头部化学感觉器电镜扫描观察. 福建农业大学学报, 2003, 32(4): 434-437.
Wei H, Yang G, Wang Q L, Hou Y M, You M S. Electron microscope scanning of diamondback moth, Plutella xylostella L., J Fujian Agric Fores Univ(Nal Sci Ed), 2003, 32(4): 434-437.
[17] 谢建军, 钟国华, 陈新芳, 陈文团, 徐齐云, 胡美英.亚洲玉米螟(Ostrinia furnacalis Guenéue)幼虫化学感受器种类与分布的形态学研究. 电子显微学报, 2006, 25(1): 71-75.
Xie J J, Zhong G H, Chen X F, Chen W T, Xu Q Y, Hu M Y. Morphological studies on the location and classifying of chemoreceptors on the larva of Ostrinia furnacalis Guenée. J Chin Elect Micros Soc, 2006, 25(1):71-75.
[18] Li J X, Wang J J, Deng W, Yang B, Li J, Liu H. Description of sensilla on the larval antennae and mouthparts of Spodoptera exigua(Hübner)(Lepidoptera, Noctuidae). Acta Zootaxonomica Sinica, 2008, 33(3):443-448.
[19] Wazalwar S M, Khurad A M. The mouth parts sensillae in the larvae of tasar silkworm, Antheraea mylitta(D)(Lepidoptera: Saturniidae). Sercologia, 2009, 49(1): 47-57.
[20] Liu Z, Hua B, Liu L. Ultrastructure of the sensilla on larval antennae and mouthparts in the peach fruit moth, Carposin sasakii Matsumura (Lepidoptera: Carposinidae). Micron, 2011, 42(5):478-483.
[21] Barsagade D D, Khurad A M, Chamat M V. Microscopic structure of mouth parts sensillae in the fifth instar larvae of eri silkworm, Philosamia ricini(Lepidoptera:Saturniidae). Jpn J Appl Entomol Zool, 2013, 1(3): 15-21.
[22] 周平, 赵盼盼, 曹霞, 高 瑾, 巨云为. 山核桃透翅蛾幼虫头部感器扫描电镜观察. 植物保护, 2015, 41(4):63-67.
Zhou P, Zhao P P, Cao X, Gao J, Ju Y W. Observation of sensilla on the larval head of Sphecodoptera sheni by using scanning electron microscopy. Plant Protection, 2015, 41(4): 63-67.
[23] 向玉勇, 徐莉, 杨茂发, 李子忠. 金银花尺蠖幼虫头部化学感受器扫描电镜观察. 植物保护学报, 2016, 43(2):288-292.
Xiang Y Y, Xu L, Yang M F, Li Z Z. Observation on the larval head chemoreceptors of honeysuckle geometrid Heterolocha jinyinhuaphaga Chu with scanning electron microscope. J Plant Protec, 2016, 43(2): 288-292.
[24] Euzébio D E, Martins G F, Fernandes-Salomão T M. Morphological and morphometric studies of the antennal sensilla from two populations of Atta robusta(Borgmeier 1939)(Hymenoptera: Formicidae). Braz J Biol, 2013, 73(3): 663-668.
[25] Catalá S S, Maida D M, Caro-Riaño H, Jaramillo N, Moreno J. Changes associated with laboratory rearing in antennal sensilla patterns of Triatoma infestans, Rhodnius prolixus, and Rhodnius pallescens(Hemiptera, Reduviidae, Triatominae). Memórias do Instituto Oswaldo Cruz, 2004, 99(1): 25-30.
[26] Carreira VP, Soto I M, Hasson E, Fanara J J. Patterns of variation in wing morphology in the cactophilic Drosophila buzzatii and its sibling D. koepferae. J Evolution Biol, 2006, 19(4): 1275-1282.
[27] Marteleto P B, Lomônaco C, Kerr W. Respostas fisiológicas, morfológicas e comportamentais de Zabrotes subfasciatus(Boheman)(Coleoptera:Bruchidae)associadas ao consumo de diferentes variedades de feijão(Phaseolus vulgaris). Neot Entomol, 2009, 38(2): 178-185.
[28] Albert P J. Morphology and innervation of mouthpart sensilla in larvae of the spruce budworm, Choristoneura fumiferana(Clem.)(Lepidoptera: Tortricidae). Can J Zool, 1980, 58(5): 842-851.
[29] 陈静, 花保祯. 山茱萸蛀果蛾幼虫触角和口器感器的超微形态. 昆虫学报, 2014, 57(1): 133-140. Chen J, Hua B Z. Ultramorphology of sensilla on the larval antennae and mouthparts of Carposina coreana Kim(Lepidoptera: Carposinidae). Acta Entomologica Sinica, 2014, 57(1): 133-140.
[30] Song Y, Sun H, Wu J. Morphology of the sensilla of larval antennae and mouthparts of the oriental fruit moth, Grapholita molesta. B Insectol, 2014, 67(2): 193-198.
[31] Faucheux M J. Sensilla on the antennae, mouthparts, tarsi and ovipositor of the sunflower moth, Homoeosoma electellum(Hulster)(Lepidoptera, Pyralidae): A scanning electron microscopic study. Ann Sci Nat Zool, 1995, 16(4): 121-136.
[32] Keil T A. Sensilla on the maxillary palps of Helicoverpa armigera caterpillars: in search of the CO2-receptor. Tissue Cell, 1996, 28(6): 703-717.
[33] Kent K S, Hildebrand J G. Cephalic sensory pathways in the centralnervous system of larval Manduca sexta(Lepidoptera: Sphingidae). Philos T R Soc B, 1987, 315(1168): l-36.
Mouthparts and Antenna and Their Associated Sensilla of Rice and Water-oat Populations of the Striped Rice Borer(Chilo suppressalis)
ZHONG Haiying, ZHANG Juefeng, LI Fang, CHEN Jianming*
(State Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control, Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;*Corresponding author,E-mail: chenjm63@163.com)
【Objective】In order to explore the ultramorphology in antennae and mouthparts and associated sensilla (especially the types, number and distribution) in different populations of Chilo suppressalis Walker, the two organs and their sensilla at different developmental stages were investigated.【Method】The antennae and mouthparts and associated sensilla of rice and water-oat populations of C. suppressalis were used as materials. We observed the organs with a scanning electron microscopy.【Result】The antennae, mouthparts and their associated sensilla varied with larval stage within populations. The two populations of C. suppressalis possessed the following characters: the pedicel was typically equipped with three sensilla basiconica and two sensilla chaetica; six pairs of sensilla chaetica were found on the labrum; the mandible bore seven incisor cusps distally, and carried two sensilla chaetica basally on its outer face; the cardo and stipes each possessed a sensillum chaeticum distally; three sensilla basiconica, two sensilla chaetica and two sensilla styloconica were observed on the galea; a sensillum digitiformium laterally was found on each maxillary palpus; and sensillum chaeticum were observed on the distal of each labial palpus. Difference in sensillum number of flagellum and maxillary palpus between the two populations were as follows: flagellum of the water-oat population was equipped with a sensillum styloconicum and two sensilla basiconica, while the rice population possessed a sensillum styloconicum and a sensilla basiconica; maxillary palpus of the former was equipped with rive sensilla basiconica and three cylindrical sensilla, whereas four sensilla basiconica and four cylindrical sensilla were carried in the latter. Some sensilla chaetica (located at the pedicel, cardo, stipes), sensilla basiconica (distributed at the pedicel, maxillary palpus and galea), sensilla styloconica (distributed at the flagellum and galea) of water-oat population were significantly longer than those of the rice population; whereas some cylindrical sensilla (located at the maxillary palpus) of 1st- to 5th-instar larvae, and sensilla chaetica (distributed at the galea) of 3rd- to 5th-instar larvae were significantly shorter than those of the rice population.
Chilo suppressalis; mouthpart; antenna; sensillum; ultramorphology
S435.112+.1
A
1001-7216(2017)02-0195-12
2016-8-22;修改稿收到日期:2016-12-06。
浙江省自然科学基金资助项目(LY16C140006); 浙江省博后基金资助项目(BSH1502055); 浙江省公益性技术应用研究项目(2016C32G4010117)。

