黄色金针菇菌株提纯复壮技术研究
刘昆昂 张根伟 马 宏 李书生 刘振国 付艳菊
(河北省科学院生物研究所,石家庄050081)
金针菇(Flammulina velutipes)又名构菌、冬菇、毛柄金钱菌等[1],按子实体颜色的深浅可将金针菇分为黄色品系、白色品系、淡黄色品系[2]。黄色金针菇是我国传统金针菇生产品种,相对于白色金针菇,具有产量高、口感好、抗性强等特点。金针菇菌种作为金针菇栽培的基础生产资料,对产量和质量起着关键性作用。然而黄色金针菇主要是散户栽培,由于科研投入不足、管理不善,金针菇菌种在保藏及传代过程中出现生产周期延长、产量下降、容易感染等退化现象。
菌种退化分为可逆和不可逆两种类型,可逆的退化现象可通过提纯复壮恢复其优良特性[3]。生产上常用的菌种提纯复壮方法有,(1)“断桥法”和菌丝尖端分离提纯复壮,其特点是仅可筛选出生长速度快的菌株,而生长速度快往往并非高产优质食用菌菌株[4];(2)原生质体再生法:需要产生大量原生质体,并对产生的大量原生质体进行分离、筛选和出菇验证,技术难度较大[5]。
研究以黄色金针菇苏金6 号为样本,通过在含有不同浓度结晶紫的PDA 培养基培养后,采用菌丝尖端分离和原生质体再生相结合的方法进行提纯复壮。此方法较常规金针菇提纯复壮方法更简便、更高效。
1 材料与方法
1.1 供试菌株黄色金针菇品种苏金6 号,引自河北省创新食用菌研究所,生产中主要表现为污染率高、生产周期延长、产量下降、畸形菇增多等。
1.2 培养基①PDA 培养基(g/L):马铃薯200,葡萄糖20,磷酸二氢钾3,硫酸镁1.5,蛋白胨2,琼脂12;②再生培养基:PDA 培养基+ 0.6 mol/L 的甘露醇;③栽培培养料:棉籽皮83%,麸皮15%,石灰1%,石膏1%;料水质量比1∶1.3;④木质素酶显色培养基:1%梨木屑煮汁+0.02%愈创木酚+1.2%琼脂;⑤纤维素酶显色培养基:0.2%微晶纤维素+0.02%刚果红+1.2%琼脂。
1.3 提纯复壮培养取供试菌株试管种不同部位菌块,分别接入含有0~40 mg/L 结晶紫的PDA 培养基中,26℃培养,待菌丝将要长满皿,挑取菌丝尖端,转入PDA培养基中,26℃培养,比较生长情况。
1.4 锁状联合观察计数菌株接入铺有玻璃纸的PDA培养基中,26℃培养,待菌丝长到玻璃纸上,400倍显微镜下观察视野中锁状联合数量。
1.5 酶解液1%蜗牛酶(Snailase)+1%溶壁酶(Sig⁃ma),用0.6 mol/L MgSO4配制,经4000 r/min 离心20 min 后,上清液无菌条件下用0.45 μm 微孔滤膜过滤除菌后,分装于10 mL 试管中,4℃冰箱保存备用。
1.6 原生质体再生对提纯复壮处理的菌株进行原生质体再生,取金针菇斜面菌丝碎片,接入盛有30 mL 液体PDA 培养基的100 mL 三角瓶中,25℃左右静置培养7 d。过滤收集菌丝体,分别用无菌水和0.6 mol/L 的MgSO4各洗涤1 次。按菌丝重∶酶液量为150 mg∶1 mL 的比例将菌丝置于酶解管中,30℃酶解3 h,每隔1 h 振荡并镜检原生质体释放情况。酶解完毕后,用6 层擦镜纸过滤,以除去残留菌丝。滤液经1000 r/min离心后弃上清液收集沉淀,用0.6 mol/L 的MgSO4洗涤2 次,得到纯化的原生质体。取0.1 mL 原生质体悬液梯度稀释,涂布于再生培养基平板,25℃下恒温培养,4~6 d即见再生菌落[6]。

表1 不同质量浓度结晶紫培养基培养对苏金6号的提纯复壮作用
1.7 再生菌株的筛选挑取再生菌株到PDA 培养基中,26℃培养,挑选生长快、长势好、菌丝粗壮、锁状联合多而整齐;同法接入栽培料中,测定生长速度,重复3次[7]。
1.8 再生菌株的酶活测定变色圈法测定木质素和纤维素酶活性。菌块接入PDA 培养基平皿中部,满皿后用打孔器在菌落边缘取直径50 mm 的菌饼,接入显色培养基中,分别在5、10、15、20、25℃和30℃培养3 d,测定变色圈直径[8]。
1.9 栽培试验用聚丙烯塑料袋(17.5 cm×40 cm×0.005 cm)装料,每袋约装干料400 g,以套环封口。高压灭菌(121~126℃)维持2 h,待料温降至25℃以下,按无菌操作规范接种,各接30袋。置于20~28℃培养室内发菌,菌丝满袋后按再生法进行催蕾—开袋—抑制—再生菇培养等工艺进行出菇管理[9]。当子实体长至16 cm 左右,菌盖直径小于1 cm 及时采收。复壮效果。

图1 出发菌株及再生菌株的菌丝形态观察
2.2 原生质体再生菌株筛选
2.2.1 提纯复壮培养对原生质体再生的影响 对20 mg/L 结晶紫提纯复壮培养的菌株进行原生质体再生,并设出发菌株对照。挑取再生菌株各100株,初筛各得到60株长势较强、生长快的菌株,经传代3次后在PDA 培养基上进行比较。处理组筛选得到的菌丝生长速度≥7 mm/d 的菌株为45 个,达到75.0%,而对照仅14个,占13.3%;处理组400倍显微镜下,视野中平均锁状联合数量为28.6 个,而对照组平均锁状联合数量为22.4 个。可见,含有结晶紫PDA 培养基提纯复壮培养,可以显著提高金针菇原生质体再生的筛选效率。
2 结果与分析
2.1 提纯复壮培养结果一定质量浓度的结晶紫可抑制金针菇菌丝生长,尤其对细胞壁不完整的退化菌丝产生更大的杀伤作用;而抗性强的菌丝,可以观察到:菌丝生长停顿1~2周后,部分萌发点成扇形向外生长。由表1可知,在含有1~40 mg/L结晶紫的PDA 培养基中培养,随着浓度增加,满皿时间逐步延后;20~40 mg/L 处理时,提纯复壮的菌株,平均生长速度、长势和菌丝密度达到最大;如图1 所示,400 倍显微镜下观察可见菌丝生长整齐、粗壮,锁状联合数量最多,而且组间差异不显著。因此,含有20 mg/L 结晶紫的PDA 培养基即可以达到最佳提纯
2.2.2 原生质体再生菌株筛选 筛选生长快、长势强、菌丝密度大、锁状联合数量多的菌株。如表2所示,5 株菌在PDA 培养基和棉籽皮基质上菌丝长速都快于出发菌株,而且长势强、菌丝密度大、锁状联合规则而且多;但两种基质上的生长速度并不成正比,例如,在PDA 培养基以13D10 生长最快,达到9.25 mm/d,但在棉籽皮基质上菌丝生长速度排第二位,为4.90 mm/d;而棉籽皮基质上生长速度最快的13B7,达到5.01 mm/d,PDA 培养基上生长速度排第三位,为8.93 mm/d。
2.2.3 木质素、纤维素酶活性比较 对筛选的再生菌株进行木质素和纤维素酶活测定。结果如表3、表4 所示,再生菌株木质素和纤维素酶活性均高于对照。20~30℃条件下,木质素酶活性由高到低依次为:13B7>13C9>13C10>13D10>13A2>CK;纤维素酶活性由高到低依次为:13B7>13C9>13D10>13A2=13C10>CK。5~15℃条件下,木质素酶活性由高到低依次为:13D10>13B7>13C9>13A2>13C10>CK;纤维素酶活性由高到低依次为:13C9>13B7>13D10>13A2=13C10>CK。其中,13B7在中高温具有最高的酶活性,低温酶活性排在第二位;13A2 在各温度点酶活均相对低。
2.3 出菇试验结果选取13B7、13D10、13C9 和13C10四株生长速度快、酶活高的再生菌株进行出菇试验。结果如表5 所示,再生菌株可缩短满袋时间5~6 d,提高产量11.2%~15.5%,均为优于亲本的高产菌株。以13B7产量最高,达到381 g/袋,增产15.5%,生物学效率为95.3%。同时发现,生长速度慢于13D10 和13C9 的13B7 出菇最早,而且产量最高,可见菌株的长速与产量之间并不一定存在正相关性,提示我们菌株筛选要从多方面考虑,以免漏筛。

表2 在PDA培养基和栽培料(棉子壳)上原生质体再生菌株的菌丝生长情况

表3 在不同温度下再生菌株的木质素酶活(变色圈直径)/mm

表4 在不同温度下再生菌株的纤维素酶活性(变色圈直径)/mm
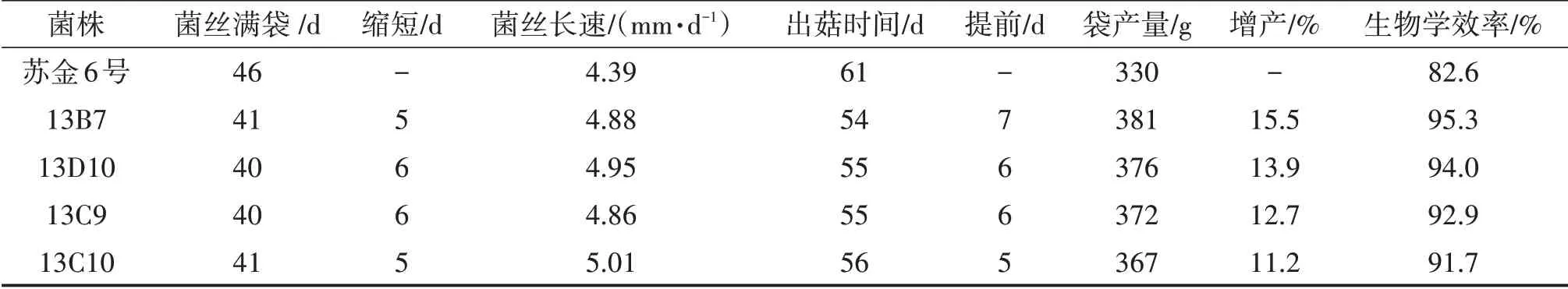
表5 复筛(再生)菌株与出发菌株的出菇试验
3 小结与讨论
在食用菌菌株的脱毒复壮中,采用的方法主要有菌丝尖端脱毒法、原基组织脱毒法、原生质体再生法等。相比原生质体再生法,菌丝尖端分离不容易得到纯的提纯复壮的菌株,但以退化的菌株直接进行原生质体再生,无疑增加了筛选的工作量,也很难达到满意的效果。研究提供的提纯复壮方法,不但使退化菌株在生长速度、木质素和纤维素酶活和产量均有提高,而且在形态上也有差异,退化的菌株细胞壁破损、穿孔,菌丝生长不整齐,而再生菌株生长快,锁状联合多而且规则。另外,当培养温度在20~30℃时,在生长速度相近的情况下,产量与木质素酶活、纤维素酶活成正相关。这可能和试验中中温发菌培养有关。试验结果表明,在优良菌株提纯复壮筛选过程中,可以从不同温度下酶活、形态特征角度进一步筛选。此外,笔者还对黄色金针菇杂19进行了提纯复壮,从菌丝形态角度判断杂19菌株退化较轻,提纯复壮菌株增产幅度低于苏金6号。初步判断,此方法更适合于退化的金针菇菌株的提纯复壮。

