猪肿瘤坏死因子α基因5'侧翼区域多态性分析
牛步月,邢桂玲,查安东,高晓雯,狄生伟,王希彪
(东北农业大学动物科学技术学院,哈尔滨 150030)
猪肿瘤坏死因子α基因5'侧翼区域多态性分析
牛步月,邢桂玲,查安东,高晓雯,狄生伟,王希彪
(东北农业大学动物科学技术学院,哈尔滨 150030)
利用直接测序法研究猪肿瘤坏死因子α(Tumor necrosis factor,TNF-α)基因5'侧翼区域多态性,并作多态位点与仔猪腹泻和生长性状关联分析。发现在TNF-α基因5'侧翼区域存在6个SNPs位点,建立针对SNP:-1048T/C和SNP:-1016A/G的Hha IPCR-RFLP和Taq IPCR-RFLP分型技术。Hha IPCR-RFLP研究发现,在民猪群体中存在TC和CC两种基因型,在长白猪群体中存在TT、TC和CC三种基因型。Taq IPCR-RFLP研究发现,在民猪和长白猪群体中仅存在AG和GG两种基因型。性状关联分析结果表明,TC比CC基因型民猪具有较高的35日龄断奶重(P<0.05)和日增重(P<0.05);TT基因型长白猪腹泻指数高于TC基因型个体(P=0.06)和CC个体(P=0.06);TT基因型长白猪出生重显著高于TC和CC基因型长白猪(P<0.05)。结果表明,猪TNF-α基因对仔猪腹泻和生长性状有一定影响,但Hha I位点能否作为新遗传标记有待进一步研究。
TNFA基因;猪;5'侧翼区域;多态性
在现代集约化饲养方式下,仔猪疾病是制约养猪业发展主因。从遗传角度提高猪群抗病力是育种技术的主要方向之一。猪抗病性状是受微效多基因控制的数量性状,寻找控制抗病性状的主基因或数量性状基因座(Quantitative trait locus, QTL),筛选相关遗传标记并应用于育种实践,是分子抗病育种主要手段。
肿瘤坏死因子α(Tumor necrosis factor,TNF-α)是由单核细胞、巨噬细胞对细菌感染或其他免疫源反应分泌的一类细胞因子,是机体炎症及免疫反应主要介导者[1]。编码TNF-α的基因位于人类主要组织相容性复合体(Major histocompatibility complex,MHC)Ⅲ区,是研究不同疾病易感性的重要候选基因。
TNF-α基因mRNA表达受启动子区域及转录后调控,如miRNA-125b可负调控TNF-α基因表达[2]。目前对TNF-α基因遗传变异研究主要集中在启动子区域。曹倩等将TNF-α作为炎症性肠炎(IBD)候选基因,分析TNF-α基因启动子区域的6个SNP与溃疡性结肠炎患者遗传易感性,发现SNP:-308G/A可能与汉族溃疡性结肠炎遗传易感性相关[3]。田国保等对TNF-α基因启动子区域5个SNP与人类乙型肝炎病毒(HBV)感染宿主易感性作荟萃(Meta)分析,发现TNF-α基因SNP:-308G/A位点多态性可能与感染HBV后的清除有关,SNP:-238G/A位点多态性与HBV持续感染有关[4]。但目前猪TNF-α基因启动子区域多态性与疫病相关性研究较少。
Szydlowsk等利用直接测序,在猪TNF-α基因ATG上游-791区域检测到一个SNP(SNP:-719C/T),建立针对该SNP的PCR-SSCP分型技术,性状关联分析发现该位点与大白猪脂肪性状相关[5]。孙丽等利用荧光定量PCR技术,在大白断奶仔猪群体中分析该位点不同基因型个体mRNA表达量,发现TNF-α基因mRNA在断奶仔猪脾脏、肺脏、胸腺和淋巴结等免疫器官中表达量均较高,而且TT基因型个体TNF-α表达量在肌肉、十二指肠和空肠组织中显著高于CC基因型仔猪(P<0.05)[6]。TNF-α基因SNP:-719C/T突变可能影响TNF-α基因mRNA表达量,但能否作为仔猪肠道病原菌抗性遗传标记有待进一步研究。
民猪是我国地方品种,繁殖力强、肉质优良且抗逆性强。近年,民猪抗病能力研究受到关注。王希彪等研究民猪及长白猪哺乳仔猪腹泻发生时间和程度,发现两品种仔猪均在14日龄出现腹泻高峰,长白仔猪较民猪仔猪腹泻高峰期提前。整个哺乳期,民猪仔猪腹泻指标低于长白仔猪,成活率高于长白仔猪[7-8]。但目前民猪高抗病力分子基础尚不清晰。
本研究选择TNF-α作为猪抗病育种候选基因,分别构建民猪和长白猪腹泻和健康DNA池,通过直接测序深入挖掘TNF-α基因5'侧翼区域遗传变异,建立针对SNP的快速、简捷分型技术,并在民猪和长白猪群体中作多态位点与仔猪腹泻等性状关联分析,以期为深入研究TNF-α基因抗病功能、民猪抗病性状的遗传机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验动物
黑龙江省兰西县种猪场,同期出生296头民猪和177头长白哺乳仔猪,常规饲养管理。仔猪35日龄断奶,每天6:00和14:00逐头检查肛门有无红肿和粪便污染以及猪圈内仔猪粪便状况,记录仔猪腹泻评分,标准如下:粪便外观呈条状或粒状,为正常腹泻,评分0;粪便外观呈软便、成形,为轻度腹泻,评分1;粪便外观呈稠状粪水无分离、稀便,为中度腹泻,评分2;粪便外观呈液体、不成形、粪水分离,粘液便或脓便,为重度腹泻,评分3。计算腹泻指数,腹泻指数为仔猪出生至35日龄粪便状况评分之和。
试验期间,称量仔猪初生重、7日龄重、14日龄重、21日龄重、28日龄重和35日龄断奶重,计算日增重,日增重=(35日龄断奶重-初生重)/35。采仔猪耳组织约0.5 g置于含70%乙醇Ep管中,-20℃保存,提取基因组DNA。
1.1.2 试验试剂
Premix TaqTM、DNA maker DL2000、pMD18-T载体、HhaⅠ和TaqⅠ内切酶均购自TaKaRa公司;DNA提取试剂盒和凝胶回收试剂盒购自生工生物工程(上海)股份有限公司。
1.1.3 主要仪器和设备
-80℃低温冰箱(购自美国Thermo Electron Corporation公司);制冰机AF100(购自意大利SCOTS-MAN公司);高压湿热全自动灭菌锅(购自日本SANYO公司);电子天平BP301S(购自德国塞多利斯公司);电子天平BL610(购自德国塞多利斯公司);微量移液器(购自德国eppendorf公司);PCR仪(购自美国PE公司);凝胶成像系统(购自美国UVP公司);电泳槽、电泳仪(购自北京市六一仪器厂);电子恒温水浴锅DK98-1(购自天津市泰特斯仪器有限公司);离心机(购自上海安亭科学仪器厂);DPH-9022培养箱(购自天津市顺诺仪器科技有限公司);生物安全柜(购自沈阳瑞丰精细化学品有限公司)。
1.2 方法
1.2.1 引物设计与合成
NCBI数据库下载猪TNFA基因序列(Genebank: NM_214022.1),利用ENSEMBL数据库(Sscrofa10)定位猪TNFA基因染色体,将查询序列向5'侧翼区步移2 000 bp后下载序列。以下载序列为模板,利用Primer 5.0软件设计两对引物T1和T2,分别作启动子区域和exon1区域扩增,其中T1和T2扩增目的片段存在部分重叠。所有引物由生工生物工程(上海)股份有限公司合成。
按照DNA提取试剂盒说明书提取基因组DNA,用1.0%琼脂糖凝胶电泳验证DNA完整性,紫外分光光度计检测浓度后,-20℃保存备用。
1.2.2 序列扩增
利用引物T1和T2,以猪基因组DNA为模板作PCR扩增。PCR反应总体系为25μL,其中模板DNA为1μL,上下游引物各0.5μL,PCRmix 12.5μL(宝生物),加去离子水至总体积25μL。PCR扩增条件:94℃4 min;94℃45 s,56或58℃45 s,72℃45 s,扩增35个循环;72℃延伸10min,4℃保存。
PCR扩增产物经1.5%琼脂糖凝胶电泳检测后,胶回收试剂盒回收目的片段(参见试剂盒说明书),回收纯化后PCR产物直接测序,或者与pMD18-T载体连接,转化E.coli DH 5α感受态细胞,经蓝白斑筛选阳性克隆,利用M13引物作菌落PCR鉴定,挑选阳性菌液测序。测序由生工生物工程(上海)股份有限公司完成。

表1 猪TNF-α基因5'侧翼区域扩增引物Tab le1 Primer pairsused in theam plicationof the5'flanking region of porcine TNF-αgene
1.2.3 序列比对分析
从民猪群体中选择高腹泻指数和健康个体,分别构建民猪腹泻DNA池和健康DNA池。长白猪腹泻DNA池和健康DNA池构建方法同上。以DNA池基因组为模板,分别用T1和T2引物作PCR扩增和测序,分析测序峰图,结合DNAMAN软件序列比对分析测序结果,寻找突变位点。
通过分析测序峰图,结合比对结果发现,测序峰图存在套峰。在此基础上,进一步利用特异引物,分别以10头民猪和长白猪个体基因组DNA为模板,PCR扩增和测序,利用DNAMAN软件序列比对分析测序结果,寻找突变位点,并用Primer5.0软件分析突变是否引起特异限制性内切酶位点变化。
1.2.4 PCR-RFLP检测
利用T2引物作PCR扩增,取PCR产物8.5μL、 HhaⅠ限制性内切酶0.5μL和10×Buffer 1μL,组成总体积为10μL的Hha IPCR-RFLP反应体系。混合液在37℃循环式水浴锅中水浴4 h。酶切产物经1.5%琼脂糖凝胶电泳后,UVP凝胶成像系统分析扩增产物酶切结果,判定基因型。利用T2引物作PCR扩增,取PCR产物8.5μL、TaqⅠ限制性内切酶0.5μL和10×Buffer 1μL,组成总体积为10μL的Taq IPCR-RFLP反应体系。混合液在65℃水浴锅中水浴4 h,酶切产物经1.5%琼脂糖凝胶电泳后,UVP凝胶成像系统分析扩增产物酶切结果,判定基因型。
1.3 数据统计
根据群体遗传学理论计算得基因型和等位基因频率。采用SAS统计软件(SAS Institute Inc,Version 8.0)GLM程序作单标记方差分析,模型为:
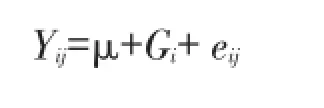
其中Yij为性状表型值,μ为平均值,Gi为基因型效应;eij为残差效应。
2 结果与分析
2.1 猪TNF-α基因5'侧翼区域序列扩增
利用引物T1和T2,以猪基因组DNA为模板作PCR扩增,PCR产物用1.5%琼脂糖凝胶电泳检测,经UVP凝胶成像系统拍照。
发现T1引物PCR扩增片段为804 bp(见图1A),T2引物PCR扩增片段为1 158 bp(见图1B),两对引物扩增片段均条带清晰、无非特异条带,可用于PCR产物测序。
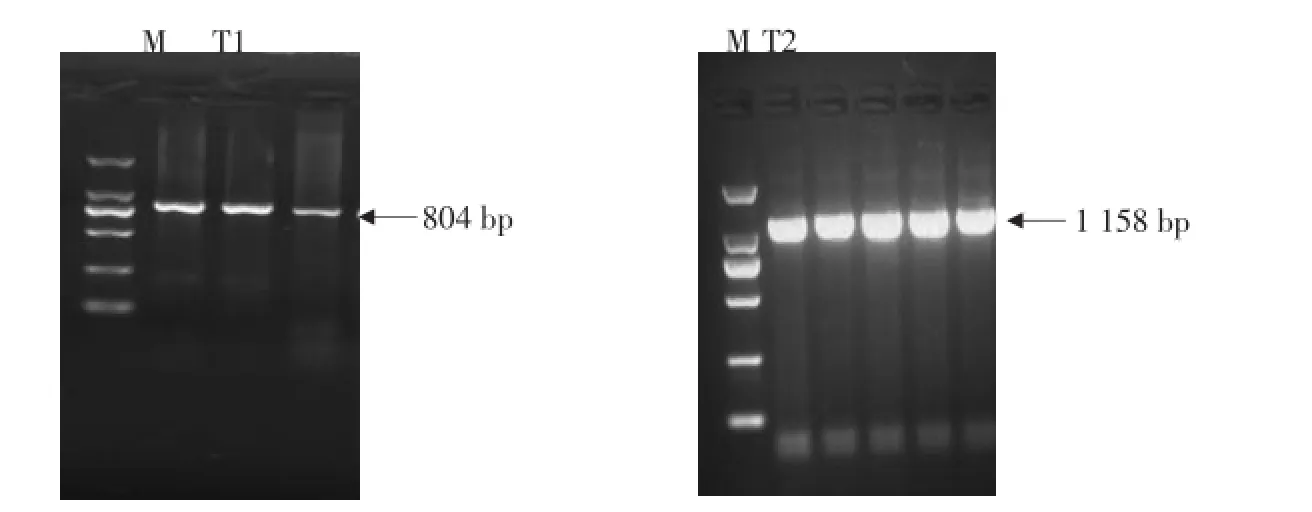
A-T1引物扩增结果;B-T2引物扩增结果;M-DNA markerDL2000A-Amplification ofprimerpair T1;B-Amplification ofprimerpair T2;M-DNAmarker DL2000
2.2 猪TNF-α基因5'侧翼区域序列比对
根据腹泻记录构建民猪和长白猪健康和腹泻DNA池,以其基因组DNA为模板作PCR扩增,回收、纯化、克隆和测序PCR产物,根据测序峰图并结合DNAMAN软件作序列比对分析,发现T1引物扩增序列无碱基突变,T2引物扩增片段存在碱基突变。
在此基础上,分别选择高腹泻指数及健康民猪、长白猪各10头,以其基因组DNA为模板作PCR扩增,将PCR产物分别回收、纯化和测序。利用DNAMAN软件作序列比对分析,发现T2引物扩增序列共存在6处SNP,分别位于ATG上游-791(T/C),-947(A/G),-1013(G/A),-1016(A/ G),-1 048(T/C)和-1 239(G/A)。其中位于ATG上游-1 048 bp处SNP:-1 048 T/C可引起HhaⅠ限制性内切酶位点(GCGC)改变(图2A)。位于-1 016 bp处SNP:-1 016A/G引起TaqⅠ限制性内切酶位点(TCGA)改变(图2B)。
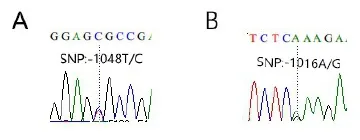
图2 TNF-α基因部分序列测序结果Fig.2 Partialsequence of the TNF-αgene
2.3 PCR-RFLP检测
利用引物T2,以猪基因组DNA为模板作PCR扩增,PCR产物经HhaⅠ酶切后产生TT、TC和CC三种基因型(图3A)。当SNP:-1 048 T/C多态位点为T时,由于该片段存在固有HhaⅠ位点,PCR产物经酶切消化后产生2个片段(682 bp+476 bp),记作等位基因T;多态位点为C时,HhaⅠ酶切后存在3个片段(352 bp+330 bp+476 bp),记为等位基因C。
T2引物PCR产物经TaqⅠ酶切后,产生AA、AG和GG三种基因型(图3B)。当SNP:-1016A/G多态位点为A时,PCR产物酶切消化后产生1个片段(1 158bp),记作等位基因A;多态位点为G时,TaqⅠ酶切后存在2个片段(505+653bp),记为等位基因G。
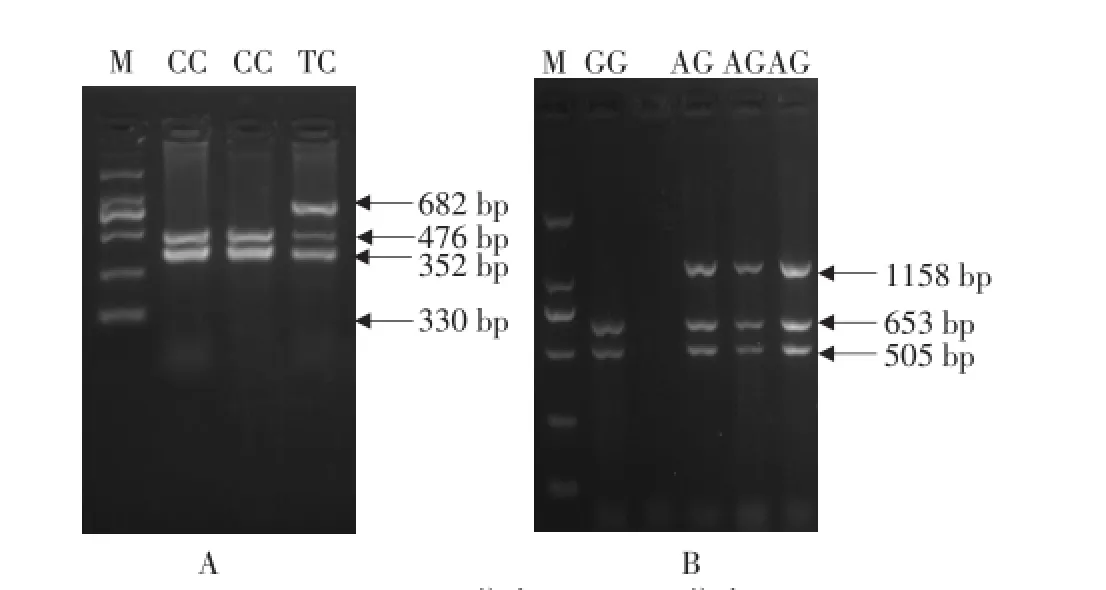
A-Hha I位点;B-Taq I位点A-Genotyping resultsby Hha IPCR-RFLP;B-Genotyping resultsby Taq IPCR-RFLP.
2.3 猪TNF-α基因型频率和基因频率分析
利用Hha I和Taq IPCR-RFLP技术分析民猪和长白猪群体中SNP:-1048T/C和SNP:-1016A/G基因频率和基因型频率。
由表2可知,民猪群体HhaⅠ位点未发现TT基因型个体,仅存在TC和CC两种基因型,基因型频率分别为0.07和0.93,C、T等位基因频率分别为0.97、0.03;长白猪群体中存在3种基因型,TT、TC和CC基因型频率分别为0.03、0.59和0.38,C、T等位基因频率为0.68、0.32。对于TaqⅠ位点,民猪群体未发现AA基因型个体,仅检测到AG和GG两种基因型,基因型频率分别为0.26、0.74,G、A等位基因频率0.89、0.11;长白群体中也未检测到AA基因型个体,且仅1个为AG基因型,其他均为GG基因型,G、A等位基因频率为1、0。
2.4 性状关联分析
根据群体遗传学分析结果,在长白猪和民猪群体中作SNP:-1048 T/C与仔猪腹泻指数和生长性状关联分析(见表3)。
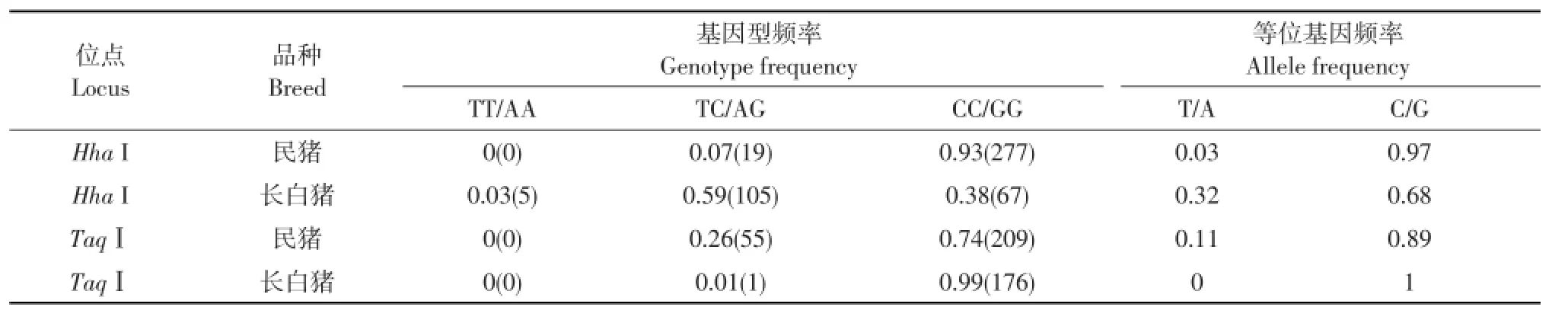
表2 猪TNF-α基因的基因型频率和等位基因频率Table2 Genotypesand allelic frequency ofporcine TNF-αgene
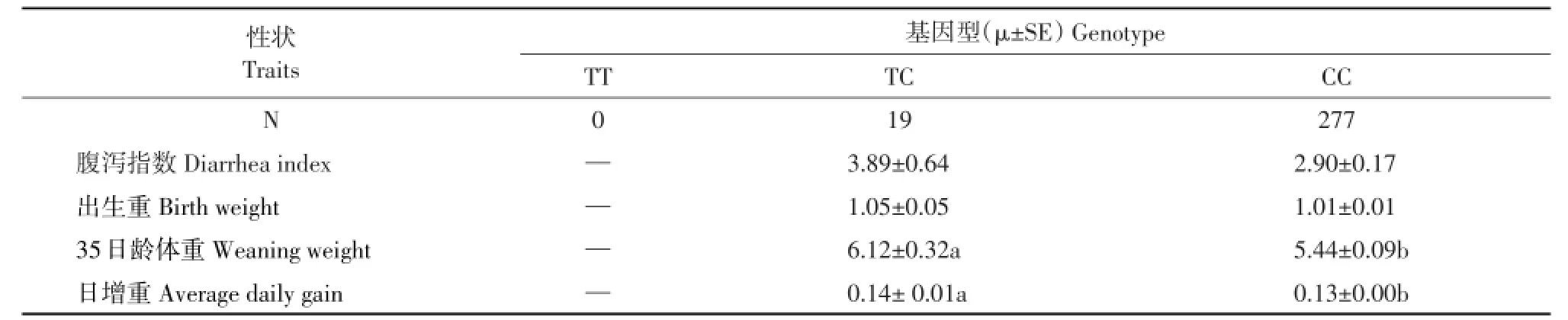
表3 Hha I位点与民猪仔猪腹泻指数和生产性状关联分析Tab le3 Association analysisof Hha I locuswith pigletdiarrhea index and per formance traitsin M in pigs
由表3可知,该位点与民猪仔猪腹泻指数不相关,与仔猪35日龄断奶重和日增重相关。Hha I基因型不同时,TC型个体35日龄断奶体重比CC型仔猪高0.68 kg(P<0.05),TC型个体日增重比CC型仔猪高0.01 kg(P<0.05)。
由表4可知,在长白猪群体中,TT基因型个体腹泻指数高于TC(P=0.06)和CC基因型个体(P=0.1)。
TT型个体出生重比TC型个体高0.34 kg(P<0.05),比CC基因型个体高0.21 kg(P<0.05)。
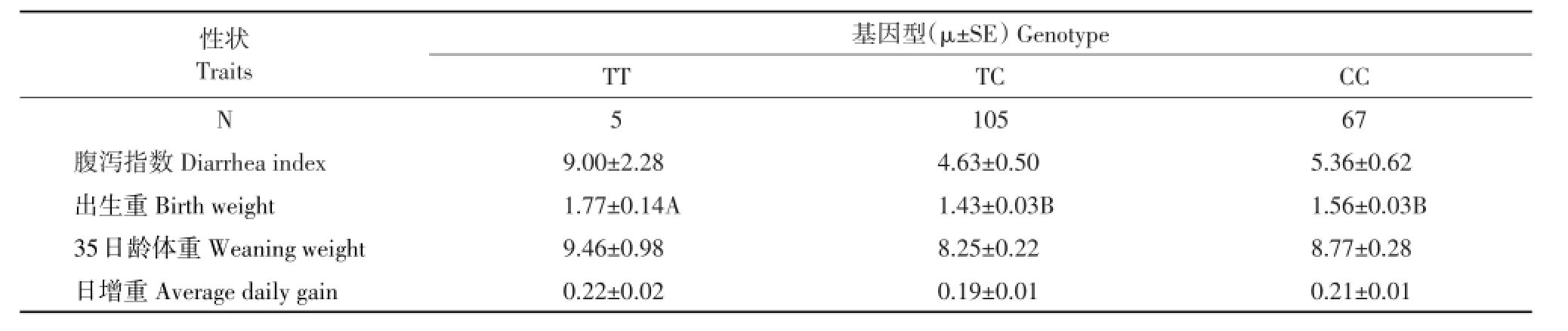
表4 Hha I位点与长白猪仔猪腹泻指数和生产性状的关联分析Table 4 Association analysisof Hha I locusw ith piglet diar rhea index and performance traits in Landrace
3 讨论与结论
现代集约化养猪生产中,腹泻是仔猪生长缓慢和高死亡率主因之一。虽然加强饲养管理、合理使用药物在一定程度上缓解,但无法从根本上解决问题。不同个体对腹泻抗性(或易感性)存在差异,主要受遗传基因控制。因此,寻找控制腹泻主效基因,培育高抗腹泻能力品系(或品种),对养猪业健康发展尤为重要。
抗病性状是由微效多基因控制数量性状,王希彪等选择pIgR基因作猪抗病育种候选基因,采用PCR-SSCP结合测序方法,在pIgR基因外显子1发现错义突变位点,与民猪仔猪腹泻指数和腹泻致死率相关(P<0.05)[9]。Yang等选择SLA-DRA作仔猪腹泻抗性(或易感性)候选基因,分析其遗传变异,构建不同单倍型,性状关联分析发现单倍型Hap9是仔猪腹泻抗性单倍型[10]。杨巧丽等在SLA-DRA基因第2外显子发现2个突变位点,性状关联分析发现该位点与仔猪腹泻显著相关[11]。
利用候选基因等方法已发现一些控制抗病候选基因和分子标记,但仍无法满足分子抗病育种需要。TNF-α是一种重要细胞因子,主要通过免疫级联反应调控其他细胞因子水平,引发炎症反应,提高机体抗病能力[12],是研究人类传染性疾病和炎症性疾病易感性重要候选基因[13]。冯丽丽等研究发现,脂多糖可诱导猪肺泡巨噬细胞分泌TNF-α,具有剂量和时间依赖性[14]。陈逢等利用Realtime PCR技术分析TNF-α基因在断奶仔猪不同组织表达模式,发现其在脾脏表达量最高,其次为淋巴结和回肠组织,在下丘脑、垂体、肾上腺、腓肠肌、肝脏和空肠等组织表达量相对较低[15]。因此,TNF-α可作为仔猪腹泻抗病育种候选基因。
目前关于猪TNF-α基因与抗病性状关联分析研究较少,本研究利用直接测序法,在猪TNF-α基因5'侧翼区域发现6个SNP,其中位于ATG上游-791bp处的SNP:-719C/T与Szydlowsk等报道一致,该SNP与大白猪脂肪性状相关[5],影响TNF-α基因mRNA表达量[6]。本研究进一步建立针对SNP:-1048T/C和SNP:-1016A/G的Hha IPCR-RFLP和Taq IPCR-RFLP分型技术。但PCR-RFLP发现,Taq I位点在民猪和长白猪群体中仅存在AG和GG两种基因型,表明Taq I位点多态信息含量不丰富,非理想标记位点。Hha I位点在民猪群体中存在TC和CC两种基因型,但在长白猪群体中存在TT、TC和CC三种基因型。性状关联分析表明,TT基因型长白仔猪腹泻指数高于TC(P=0.06)和CC基因型个体(P=0.1)。此外,TT基因型长白仔猪虽具有较高出生重,但35日龄断奶重和日增重并未显著高于其他基因型,推测可能是TT型个体抗腹泻能力差,日增重较低,影响断奶重。民猪抗腹泻能力优于长白猪,但民猪群体中未发现TT型个体,推测由于TT型个体抗腹泻能力差,长期自然选择中逐渐被淘汰。综上所述,TNF-α基因Hha I位点对长白猪仔猪腹泻存在一定影响,但能否作为新遗传标记,仍需后续大样本量群体或不同品种、世代验证。
[1]Bradley JR.TNF-mediated inflammatory disease[J].Journal of Pathology,2008,214(2):149-160.
[2]Huang H C,Yu H R,Huang L T,et al.miRNA-125b regulates TNF-αproduction in CD14+neonatalmonocytes via post-transcriptional regulation.[J].Journal of Leukocyte Biology,2012,92 (1):171-182.
[3]曹倩,高歌,周刚,等.肿瘤坏死因子基因多态性与溃疡性结肠炎相关性研究[J].中华消化杂志,2006,26(7):460-463.
[4]田国保,曾争,陆海英,等.肿瘤坏死因子a基因启动子区多态性与乙型肝炎病毒感染相关性的荟萃分析[J].世界华人消化杂志,2007,15(6):580-584.
[5]Szydlowski M,Buszka A,Mackowski M,et al.Polymorphism of genes encoding cytokines IL6 and TNF is associated with pig fatness[J].Livestock Science,2011,136(2-3):150-156.
[6]孙丽,夏日炜,刘颖,等.大白猪肿瘤坏死因子α基因启动子区多态性及其对mRNA表达水平的影响[J].中国畜牧兽医, 2015,42(6):1518-1523.
[7]王希彪,李建敏,许愿,等.哺乳仔猪腹泻发生时间和程度的品种间差异及对增重的影响[J].东北农业大学学报,2014,45(9): 79-83.
[8]王希彪,黄宣凯,崔世泉,等.民猪与长白猪哺乳仔猪腹泻程度的差异及其对生产性能的影响[J].东北农业大学学报,2014, 45(7):79-82.
[9]王希彪,童县伟,崔世泉,等.多聚免疫球蛋白受体(pIgR)基因多态性及其与仔猪腹泻关系[J].东北农业大学学报,2016,47 (4):10-15.
[10]Yang QL,Zhao SG,Wang DW,etal.Association between genetic polymorphism in the swine leukocyte Antigen-DRA gene and piglet diarrhea in three chinese pig breeds[J].Asian Australasian Journalof AnimalSciences,2014,27(9):1228-1235.
[11]杨巧丽,孔晶晶,赵生国等.猪SLA-DRA基因外显子2多态性及其与仔猪腹泻的关联分析[J].畜牧兽医学报,2012,43(7): 1020-1027.
[12]Sariban E,Imamura K,Luebbers R,et al.Transcriptional and posttranscriptional regulation of tumornecrosis factorgene expression in human monocytes[J].Journal of Clinical Investigation, 1988,81(5):1506-1510.
[13]魏茂提,韩炎炎,何丽,等.TNF-α启动子区基因多态性与SARS易感性及症状关系研究[J].武警医学院学报,2009,18 (3):169-174.
[14]冯丽丽,张丽萍,张改平,等.脂多糖对猪肺泡巨噬细胞分泌IL-1β及TNF-α的影响[J].河南农业科学,2009,38(3):106-109.
[15]陈逢,刘玉兰,李权,等.TLR4信号通路关键基因在断奶仔猪不同组织中的mRNA表达[J].中国畜牧杂志,2013,49(17):53-
Polymorphism analysis in the 5' flanking region of porcine TNF- αgene
NIU Buyue,XING Guiling,ZHA Andong,GAO Xiaowen,D I Shengwei,WANG Xibiao
(School of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China)
In this study, polymorphism in the 5' flangingregion of porcine tumor necrosis factor-α (TNF-α) gene was detected by direct sequence and association analysis between SNP locus and diarrhea orperformance traits were performed in Min pig and Landrace population. Six SNPs were found in the 5'flanking region of TNF-α gene. Then the Hha I/Taq I PCR-RFLP technique were established to detect theSNP: -1048T/C and SNP: -1016A/G, respectively. In Min pig population, there were TC and CC genotypes,and TT, TC and CC genotypes were found in Landrace breed. Both in Min pig and Landrace population, onlyAG and GG genotypes were found. Statistical analysis showed that, TC piglets had more weaning weight (P<0.05) and average daily gain (P<0.05) than CC piglets in Min pig; Diarrhea index was higher in TT pigs thanTC (P=0.06) and CC pigs (P=0.06) in Landrace breed; in addition, TT pigs had more birth weight than TCand CC piglets(P<0.05). The results showed that TNF-α gene might affect the diarrhea or performance traits.However, more researches would needed to demonstrate whether Hha I locus might be usefulmarker.
TNF-α; pig; 5' flanking region; polymorphism
S858.28
A
1005-9369(2017)03-0017-07
时间2017-3-21 13:57:00[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170321.1357.002.htm l
牛步月,邢桂玲,查安东,等.猪肿瘤坏死因子α基因5'侧翼区域多态性分析[J].东北农业大学学报,2017,48(3):17-23.
Niu Buyue, Xing Guiling, Zha Andong, et al. Polymorphism analysis in the 5' flanking region of porcine TNF-α gene[J]. Journalof Northeast Agricultural University, 2017, 48(3): 17-23. (in Chinese with English abstract)
2017-02-20
国家自然科学基金(31301935)
牛步月(1980-),女,副教授,博士,硕士生导师,主要从事猪遗传育种学研究。E-mail:niubuyue@163.com

