阿特拉津对黑土酶活及其微生物多样性影响研究
张颖,曹博,姜昭,张修远,王子懿,李瑞璇,张晋瑄
(东北农业大学资源与环境学院,哈尔滨 150030)
阿特拉津对黑土酶活及其微生物多样性影响研究
张颖,曹博,姜昭,张修远,王子懿,李瑞璇,张晋瑄
(东北农业大学资源与环境学院,哈尔滨 150030)
以黑土为研究对象,采用室内培养方法,研究阿特拉津对黑土脲酶、转化酶、多酚氧化酶影响,采用RAPD技术分析土壤微生物群落。结果表明,低浓度(25mg·kg-1)阿特拉津对黑土脲酶活性有促进作用,中、高浓度(50~125mg·kg-1)阿特拉津对黑土脲酶活性具有抑制作用且浓度越高抑制越明显;阿特拉津抑制土壤转化酶活性,培养结束时(35 d),抑制作用仍然存在;阿特拉津对多酚氧化酶活性表现为抑制-促进-恢复规律;阿特拉津输入改变土壤微生物群落结构,浓度越高变化越明显。
黑土;阿特拉津;微生物群落多样性;土壤酶;RAPD
阿特拉津(Atrazine),又名莠去津,1952年由瑞士Geigy公司研发的内吸选择性苗前、苗后封闭除草剂[1]。全球使用量大、使用面积广。阿特拉津主要通过作用于光合系统Ⅱ电子传递链,使其无法正常进行光合作用,破坏杂草细胞膜。主要应用于甘蔗、高粱、玉米及茶园除草,可防护马唐、苍耳、豚草属等多种一年生禾本科杂草和阔叶杂草[2]。土壤中阿特拉津具有稳定结构、较强水溶性、不易分解及较长半衰期等特点,易通过降雨、灌溉及淋溶等过程进入地表水和地下水,对土壤、大气及水体生态环境造成污染[3-4]。研究表明,低浓度阿特拉津作为内分泌干扰物具有毒性作用[5]。阿特拉津对环境影响已引起关注[6-7],使用除草剂影响土壤酶活,改变土壤微生物结构[8]。RAPD技术操作简单、快速、经济性强,成为研究微生物群落结构以及土壤群落响应重要技术手段[9]。
目前有关阿特拉津对黑土酶活性影响及不同浓度条件下对土壤微生物群落多样性变化影响研究相对较少。研究不同浓度阿特拉津对黑土土壤酶活性以及黑土中微生物群落结构影响,可为阿特拉津对黑土污染影响早期预测提供数据支持,为其生态安全评价奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试药剂
97%阿特拉津购买自Sigma化学试剂有限公司;采用丙酮溶解阿特拉津配置成5 g·L-1储备液;其余药品均为分析纯。
1.1.2 供试土壤
黑土样品采集自黑龙江省东北农业大学香坊实验实习基地试验田长期未施用阿特拉津表层(0~20 cm)土壤。取样后,自然风干,研磨后过2mm筛,备用。土壤基本理化性质如下:pH 6.23,有机质30.4 g·kg-1,总氮1.94 g·kg-1,总磷1.56 g·kg-1,阳离子交换量(CEC)20.2 cmol·kg-1,未检测出阿特拉津。
取若干份贮备干土,每份500 g,向土壤中加入阿特拉津储备液,使土壤中阿特拉津终浓度分别为:25、50、75、100、125mg·kg-1,并设置未添加阿特拉津处理作空白对照,每个处理设置三个平行,加入预先灭菌蒸馏水调节土壤含水率为田间最大持水量60%。分别在第3、7、14、21、28、35天测定土壤酶活性变化。
1.1.3 主要设备和仪器
万分之一天平(北京赛多利斯);气相色谱仪(日本岛津);PCR仪(北京东胜);灭菌锅(上海申安)。
1.2 方法
1.2.1 土壤酶活性测定
土壤脲酶、转化酶和多酚氧化酶均采用比色法测定。土壤脲酶活性以24 h后1 g土壤中NH3-N毫克数表示;土壤转化酶活性以24 h后1 g土壤中葡萄糖毫克数表示;土壤多酚氧化酶活性以3 h后1 g土壤中酚毫克数表示[10]。
1.2.2 土壤微生物RAPD分析
按照Omega Soil Kit试剂说明书步骤提取第35天土壤DNA样品。PCR反应体系为50μL,其中PCR反应体系如下:10×Taq buffer 5μL;d NTP(10 mmol·L-1)1μL;DNA模板1μL;RAPD引物1μL;DNA Taq聚合酶1μL;双蒸水(dd H2O)至37.5μL。10条RAPD引物序列信息如表1所示。PCR反应扩增程序为94℃预变性3min;94℃预变性1min,37℃退火1min,72℃延伸1min,设置40个循环;72℃延伸7 min。扩增产物经BIORAD凝胶成像系统拍照观察。以空白为对照,记录处理样品DNA与RAPD引物扩增情况,出现新条带及消失条带数,分别以“a”和“b”表示。参照Nei等研究方法计算DNA序列相似性[11]。

表1 试验RAPD引物序列Table1 RAPD Primers
1.2.3 数据处理
使用SPSS 19.0、Excel 2007和Origin 8.0等软件处理数据。
2 结果与分析
2.1 阿特拉津对土壤酶影响
2.1.1 阿特拉津对土壤脲酶影响
作为土壤中最主要酶类之一,脲酶可将土壤中有机物水解为作物可再次利用的二氧化碳和氨,与土壤肥力及土壤中物质循环相关[12]。阿特拉津对于土壤脲酶影响如图1所示。在整个培养周期内,土壤脲酶活性表现先升后降趋势。培养7 d,各处理土壤中脲酶活性最高,分别达到0.68、0.70、0.67、0.66、0.64、0.61mg·NH3-N·g-1·24 h-1。低浓度(25 mg·kg)处理阿特拉津对于脲酶具有刺激作用,整个培养过程中土壤脲酶活性高于空白处理。而中、高浓度处理土壤脲酶活性受抑制。随着阿特拉津浓度增加表现剂量-效应关系。培养至35 d时,除低浓度(25mg·kg-1)处理外,其余各处理组脲酶活性差异不显著。
2.1.2 阿特拉津对土壤转化酶影响
土壤转化酶是土壤中多数生物必需物质。研究表明,土壤转化酶强度是评价土壤生物活性及肥力重要指标[13]。不同浓度阿特拉津对土壤转化酶影响如图2所示。
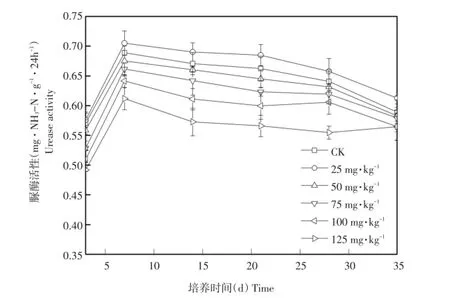
图1 阿特拉津对土壤脲酶影响Fig.1 Effectof atrazineon soilureaseactivity
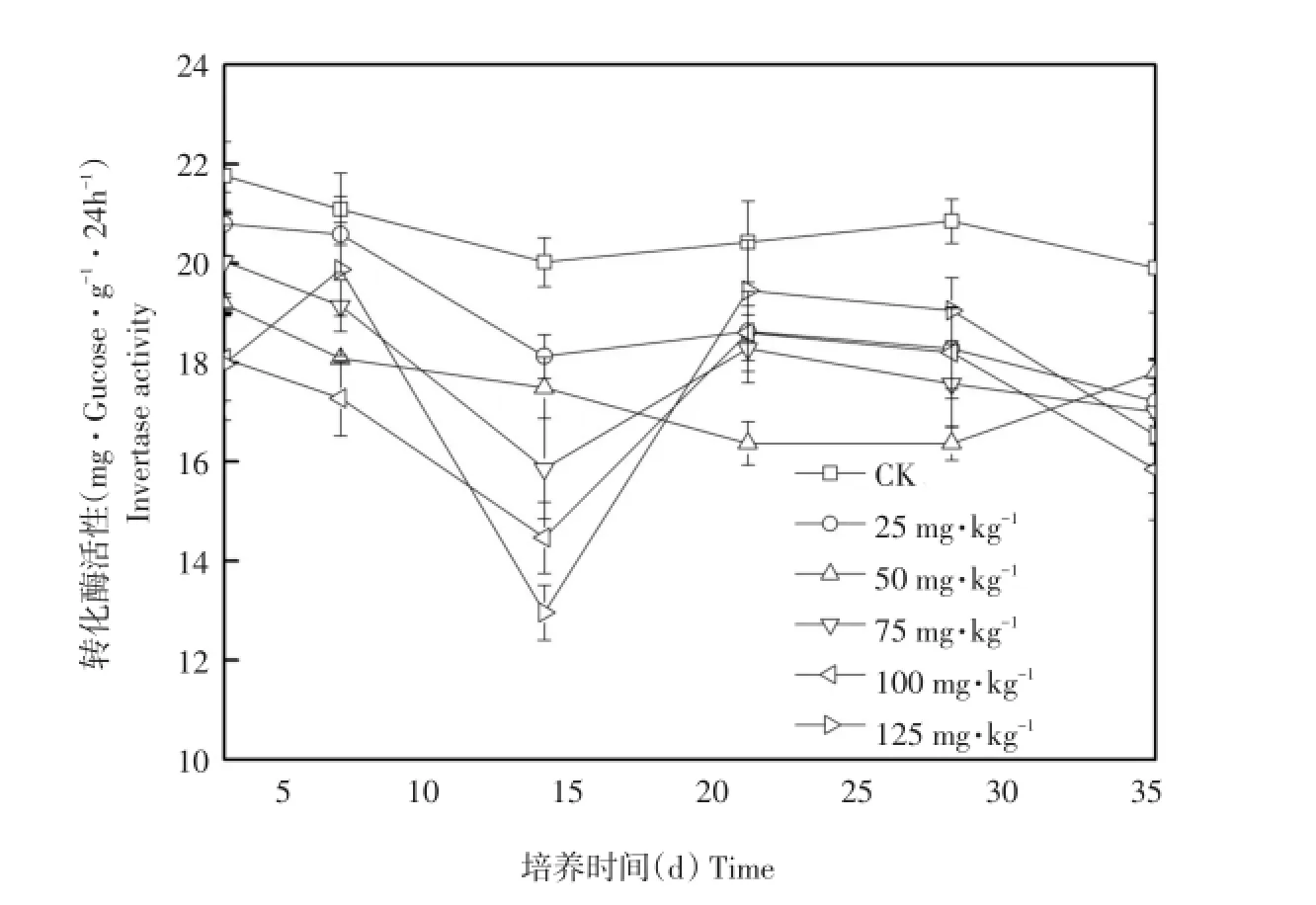
图2 阿特拉津对土壤转化酶影响Fig.2 Effect of atrazine on soil inver tase activity
由图2可知,在整个培养周期内,空白处理土壤转化酶活性上下浮动但总体变化不明显。除低浓度处理培养初期土壤转化酶表现一定刺激作用外,各浓度阿特拉津处理与对照组相比,土壤转化酶活性均为抑制作用。在培养3~14 d,土壤转化酶活性明显下降,随着阿特拉津浓度升高,抑制作用逐渐增强。
第14天时,与对照相比,不同浓度阿特拉津对土壤转化酶抑制率分别为,9.49%、12.65%、20.77%、27.14%和35.27%。随培养时间延长,21~35 d,各污染处理土壤转化酶活性整体呈缓慢下降趋势,均与对照组差异显著。
2.1.3 阿特拉津对土壤多酚氧化酶活性影响
土壤腐殖质中芳香族化合物主要通过土壤中多酚氧化酶氧化成醌,形成大小不等有机质,完成土壤物质循环过程。通过测定多酚氧化酶了解土壤腐殖化情况。阿特拉津对于土壤多酚氧化酶影响情况如图3所示。在整个培养周期内,空白处理土壤多酚氧化酶变化不大。培养第3天,阿特拉津对土壤多酚氧化酶表现抑制作用且明显剂量-效应关系,浓度越高,抑制现象越明显。阿特拉津污染处理土壤多酚氧化酶活性表现促进-恢复规律。第35天,包括空白处理,各处理多酚氧化酶活性差异不显著。

图3 阿特拉津对土壤多酚氧化酶影响Fig.3 Effect of atrazine on soil Polyphenoloxidase activity
2.2 阿特拉津对土壤微生物影响
以试剂盒提取土壤微生物基因组DNA为模板,选用10条RAPD引物PCR扩增。扩增后产物电泳检测,引物S8对不同处理土壤DNA扩增多态性电泳图谱见图4。由于RAPD采用随机引物扩增,对微生物群落DNA无选择性,因此扩增条带数可间接反映土壤微生物相对丰度,不同处理条带变化情况见表2。利用RAPD指纹图谱技术研究不同浓度阿特拉津对于土壤DNA数量及结构影响。空白处理以表1所示引物随机扩增,空白对照共扩增出94条带。随着阿特拉津浓度加大,相对于空白处理消失或增加条带数总和逐渐增加。相对照空白处理多样性数值分别为44.7%、46.85%、48.9%、48.9%以及50%。DNA相似性系数结果如表3所示,随着阿特拉津浓度增加,土壤微生物群落结构多样性改变;浓度越高对土壤微生物群落影响越大。

图4 RAPD扩增结果(S8)Fig.4 RAPD am p lification result
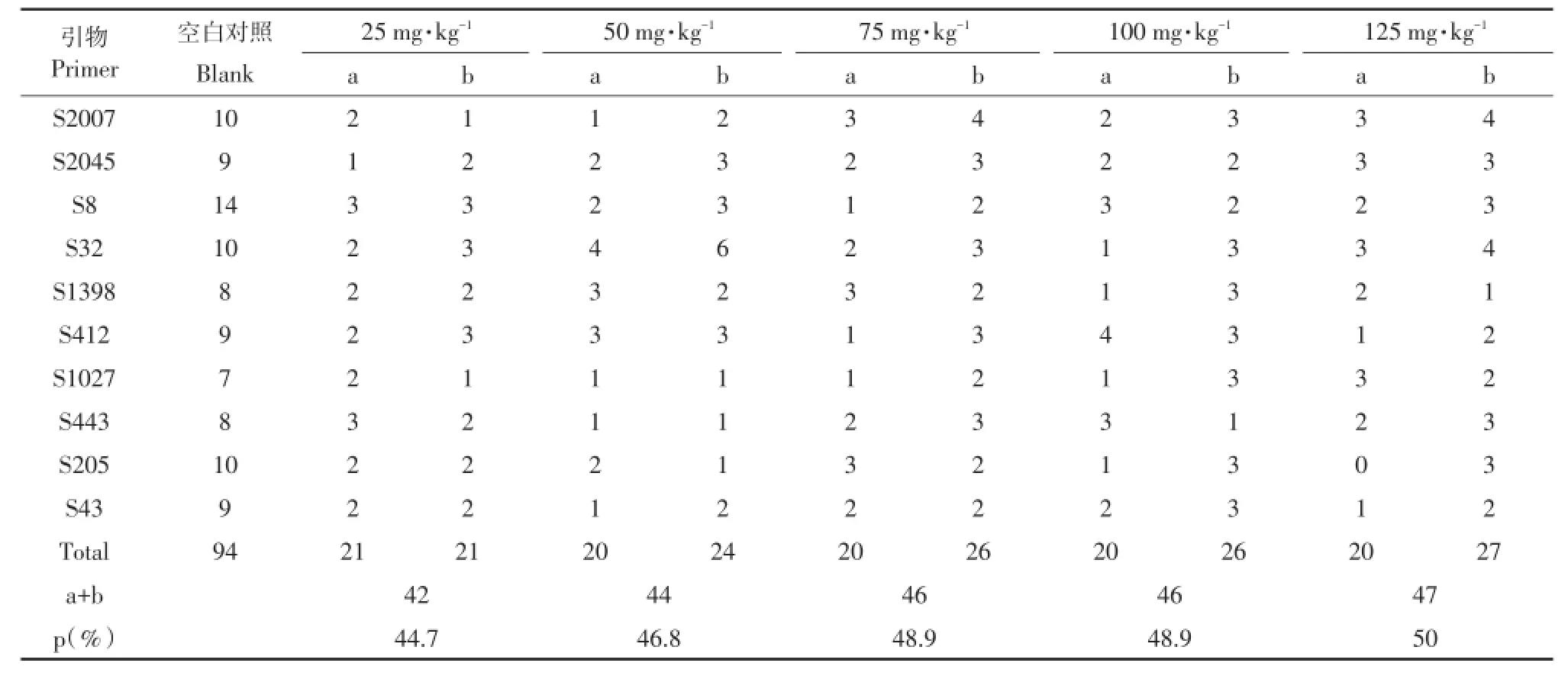
表2 阿特拉津对于土壤微生物群落多样性影响Table 2 E ffect ofatrazine on soilm icrobial diversity
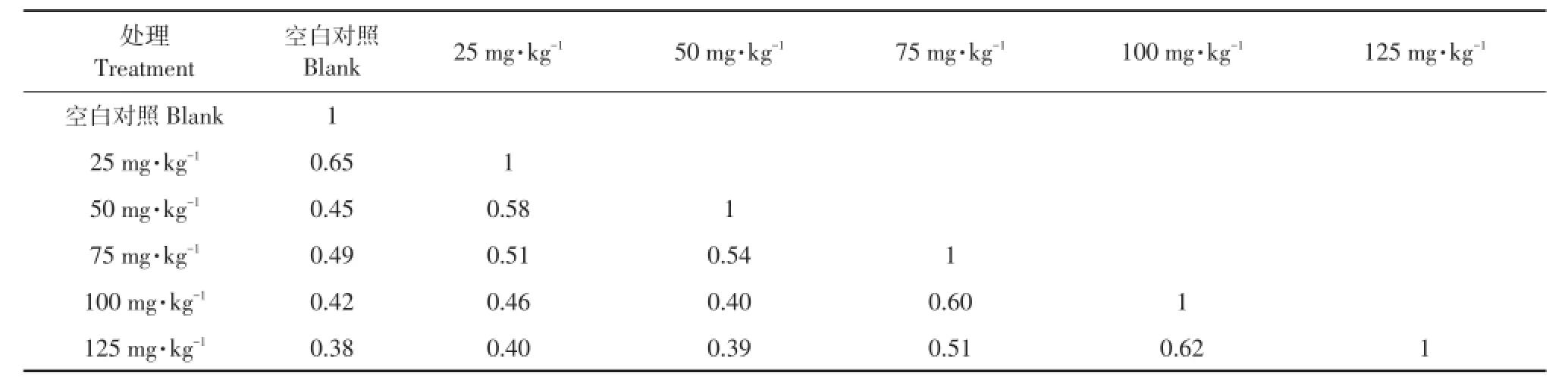
表3 不同土壤样品微生物群落DNA相似性系数Table 3 Coefficien tsofm icrobial community DNA sequence sim ilarity of different soil sam p les
3 讨论
3.1 阿特拉津对于土壤酶活性影响
土壤酶是土壤新陈代谢主要动力,可表征土壤综合肥力特征及土壤养分循环过程,反映土壤微生物活性[14-15]。Zhan等研究可溶性有机碳对土壤酶活性影响发现,土壤酶活性与培养时间相关,不同时间土壤酶活变化趋势不同[16]。范昆等发现低浓度1,3-二氯丙烯对土壤脲酶活性表现为抑制-激活作用[12]。郑景瑶等发现向黑土中添加浓度为120 g·hm-2氟磺胺草醚可明显抑制土壤脲酶活性[17]。本试验研究表明,低浓度阿特拉津对土壤脲酶有刺激作用,随浓度增加,土壤脲酶活性受抑制程度加深。这可能由于土壤中存在各类分解阿特拉津微生物,较低浓度下微生物将阿特拉津分解为结构简单有机物并被利用至完全分解。与Sabra等报道低浓度除草剂促进土壤脲酶活性,高浓度抑制土壤脲酶活性结论一致[18]。整个培养过程中,阿特拉津对土壤转化酶活性均表现抑制作用,且在第35天时,污染处理与对照组转化酶活性差异显著。与骆爱兰等50~1 000mg·kg-1氟啶胺对土壤转化酶表现为抑制作用研究结果一致[13]。此外,本研究表明阿特拉津对土壤多酚氧化酶表现为先抑制后激活后再恢复规律。与刘惠君等三嗪类除草剂对土壤酶影响研究结果一致[19]。
3.2 阿特拉津对于土壤微生物群落DNA序列及相似性影响
目前,RAPD技术已成功应用于检测污染物引起并对微生物、植物以及动物造成的DNA损伤和突变。结果表明,阿特拉津可减少土壤DNA条带数而未改变多态性,这可能是微生物群落结构改变及基因重组造成。研究表明土壤中基因稳定性受阿特拉津影响,破坏土壤中微生物DNA结构,减少或阻止PCR反应。Waisberg等研究表明,污染物可诱导DNA损伤,改变结构,显著影响PCR扩增效果[20]。本研究表明,高浓度阿特拉津影响土壤微生物群落结构多样性及遗传。结果与Yang等报道有毒污染物可改变DNA稳定性,改变RAPD图谱的结论一致[19]。
4 结论
研究结果表明,作为常见除草剂,阿特拉津对于黑土酶活性影响显著,改变土壤微生物群落组成。在整个培养过程中,25mg·kg-1阿特拉津污染处理可刺激土壤脲酶,而其他浓度表现明显抑制作用,存在剂量关系。阿特拉津对土壤转化酶活性表现为抑制作用,与对照差异显著。正常条件下土壤多酚氧化酶相对稳定,阿特拉津污染处理土壤多酚氧化酶活性表现抑制-促进-恢复规律。RAPD结果表明,阿特拉津进入黑土后可抑制土壤微生物群落多样性,抑制程度与添加量相关。
[1]高远,杨帆,秦景.阿特拉津环境危害及污染防治对策[J].水利技术监督,2014,22(2):11-13.
[2]KoliN U,Scott C,Martin-Laurent F.Evolution of atrazine-degrading capabilities in the environment[J].Applied Microbiology and Biotechnology,2012,96(5):1175-1189.
[3]聂果,吴春先,高立明,等.莠去津生态毒理学及其环境行为学研究进展[J].现代农药,2007,6(4):32-37.
[4]郑晓宁.阿特拉津降解菌ADX10分离、鉴定及其降解特性研究[D].南京:南京农业大学,2007.
[5]Hayes TB,Collins A,Lee M,etal.Hermaphroditic,demasculinixed frogs after exposure to the herbicide atrazine at low ecologyically relevant doses[J].Proceedings of the National Academy of Sciencesof theUnited StatesofAmerica,2002,99(8):5476-5480.
[6]Levy J,Chester G.Simulation of atrazine andmetabolite transport and fate in a sandy-till aquifer[J].Journalof Contaminant Hydrology,1995,20(1-2):67-88.
[7]Simpkins JW,Swenberg JA,Weiss N,etal.Atrazine and breast cancer:A framework assessmentof the toxicologicaland epidemiologicalevidence[J].ToxicologicalSciences,2011,123(2):441-459.
[8]杜伟文,欧阳中万.土壤酶研究进展[J].湖南林业科技,2005, 32(5):76-79.
[9]Yang G,Pei Z,LiangM,etal.Assessmentofeffects ofheavymetals combined pollution on soil enzyme activities and microbial community structure:Modified ecological dose-response model and PCR-RAPD[J].Environmental Earth Sciences,2010,60(3): 603-612.
[10]张颖,吴雪峰,董世佳,等.DEHP对黑土微生物数量及酶活性影响[J].东北农业大学学报,2015,46(1):47-57.
[11]NeiM,LiW H.Mathematicalmodel for studying genetic variation in terms of restriction endonucleases[J].Proceedings of the NationalAcademyof theUSA,1979,76(10):5269-5273.
[12]范昆,王开运,王东,等.1,3-二氯丙烯对土壤脲酶和蔗糖酶活性影响[J].农药学学报,2006,8(2):139-142.
[13]骆爱兰,余向阳.氟啶胺对土壤中蔗糖酶活性及呼吸作用影响[J].中国生态农业学报,2011,19(4):902-906.
[14]马春梅,庄倩倩,龚振平,等.保护性耕作对寒地土壤酶活性影响[J].东北农业大学学报,2012,43(11):40-44.
[15]孟立军,吴凤芝.土壤酶研究进展[J].东北农业大学学报, 2004,35(5):622-626.
[16]Zhan X H,Wu W Z,Zhou L X,et al.Interactive effect of dissolved organicmatter and phenanthrene on soil enzymatic activities[J].Journalof Environmental Science,2010,22(4),607-614.
[17]郑景瑶,王百慧,岳中辉,等.氟磺胺草醚对黑土微生物数量及酶活性的影响[J].植物保护学报,2013,40(5):468-472.
[18]Sarba F S,Mansee A H,Khattab M M.Residual effect of three common herbicides on certain soil enzyme activity[J].Alexandria Journalof AgriculturalResearch.1997,42(2):89-99.
[19]刘惠君,刘维屏,杨炜春,等.均三氮苯类除草剂对土壤酶活性影响[J].土壤学报,2003,40(2):287-292.
[20]Waisberg M,Joseph P,Hale B,et al.Molecular and cellular mechanisms of cadmium carcinogenesis[J].Toxicology,2003,192 (2-3):95-117.
Effect of atrazine on soil enzyme activities and microbial communitystructure in black soil
ZHANG Ying,CAO Bo,JIANG Zhao,ZHANG Xiuyuan,WANG Ziyi,LIRuixuan,ZHANG Jinxuan
(School of Resource and Environmental Science, Northeast AgriculturalUniversity, Harbin 150030, China)
The aim of this work was to evaluate the effect of atrazine on the activity of black soilurease, invertase, polyphenol oxidase by simulated experiments, while soil microbial communities wasdetected by using RAPD technology. The results showed that low concentration of atrazine (25 mg· kg-1) hadsimulative effect on the activity of soil urease. Other concentrations of atrazine (50-125 mg· kg- 1) showedinhibitory effect on the activity of soil urease and the inhibition effect was enhanced with the concentrationincreasing. Atrazine restrained the activity of soil invertase throughout the culture period. Howeverpolyphenol oxidase in black soil showed a pattern of inhibition-activation-recovery. In addition, the structureof soil microbial community was changed by atrazine and the change was enhanced with the increase inatrazine concentration.
black soil;atrazine;m icrobialcommunity diversity;soilenzymes;RAPD
X171.5
A
1005-9369(2017)03-0048-06
时间2017-3-21 14:03:00[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170321.1403.012.htm l
张颖,曹博,姜昭,等.阿特拉津对黑土酶活及其微生物多样性影响研究[J].东北农业大学学报,2017,48(3):48-53.
ZHANG Ying, CAO Bo, JIANG Zhao, et al. Effect of atrazine on soil enzyme activities and microbial community structure inblack soil[J]. Journal of Northeast Agricultural University, 2017, 48(3): 48-53. (in Chinese with English abstract)
2017-03-01
黑龙江省应用技术研究与开发计划项目(2014G0026);农业部农业科研杰出人才及其创新团队;哈尔滨市应用技术研究与开发项目(2016RAXXJ103)
张颖(1972-),女,教授,博士,博士生导师,研究方向为土壤保护与修复。E-mail:zhangying_neau@163.com

