嘧啶拼接3-烯键氧化吲哚衍生物的合成及其抗肿瘤活性
周 根, 刘欢欢, 王丹丹, 韩朔楠, 杨 超, 林 冰, 刘雄利, 赵 致, 周 英
(贵州大学 贵州省药食同源植物资源开发工程技术研究中心,贵州 贵阳 550025)
·研究论文·
嘧啶拼接3-烯键氧化吲哚衍生物的合成及其抗肿瘤活性
周 根, 刘欢欢, 王丹丹, 韩朔楠, 杨 超, 林 冰*, 刘雄利, 赵 致, 周 英*
(贵州大学 贵州省药食同源植物资源开发工程技术研究中心,贵州 贵阳 550025)
以2-吲哚酮与3,5-二氯嘧啶甲醛为原料,经Knoevenagel加成消除反应和取代反应合成了11个新型的嘧啶拼接3-烯键氧化吲哚衍生物(3a~3k),产率70%~91%,Z/E值15 ∶1~>20 ∶1, 其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。采用MTT法研究了3a~3k对人肺癌细胞(A549)和人白血病细胞(K562)的体外抗肿瘤活性。结果表明:3a, 3c, 3f, 3g和3j对K562具有较好的抑制活性(IC50分别为29.3, 27.6, 28.5, 24.0和27.0 μmol·L-1), 3a, 3h和3j对A549具有较好的抑制活性(IC50分别为28.1, 16.4和25.2 μmol·L-1)。
2-吲哚酮; 嘧啶甲醛; Knoevenagel反应; 嘧啶拼接3-烯键氧化吲哚; 抗肿瘤活性; 合成
3-烯键氧化吲哚是一类重要的杂环化合物[1-4],其在农药及医药等方面的应用引起人们的普遍关注。很多天然产物和医药中的3-烯键氧化吲哚都具有良好的生物活性。例如,Sunitinib是一种酪氨酸激酶抑制剂,在2006年被批准用于治疗肾细胞癌和胃肠道间质肿瘤;目前上市或即将上市的抗肿瘤或抗病毒感染的药物相当多都是嘧啶衍生而成[5-8],如齐多夫定(zidovudine,AZT)、ddC(双脱氧胞苷)及Lamivudine (拉米夫定)等是HIV逆转录酶抑制剂。鉴于3-烯键氧化吲哚骨架化合物和嘧啶骨架化合物具有潜在的生物活性及新药设计的拼合原理[9-10],把嘧啶骨架拼接到3-烯键氧化吲哚骨架化合物上,合成一系列新的潜在多活性官能团取代的嘧啶拼接3-烯键氧化吲哚衍生物,可以为生物活性筛选提供化合物源,对药物的筛选和制药行业具有重要的应用价值。

Scheme 1
本文以2-吲哚酮与3,5-二氯嘧啶甲醛为原料,经Knoevenagel加成消除反应和醇羟基取代氯原子反应合成了11个新型的嘧啶拼接3-烯键氧化吲哚衍生物(3a~3k, Scheme 1),产率70%~91%,Z/E值15∶1~>20∶1, 其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。采用MTT法研究了3a~3k对人肺癌细胞(A549)和人白血病细胞(K562)的体外抗肿瘤活性。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker-400 MHz型核磁共振仪(CD3Cl为溶剂,TMS为内标); MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.2 3a~3k的合成(以3a为例)
在反应瓶中先加入甲醇5 mL,再依次加入N-甲基-7-氯氧化吲哚54.3 mg(0.3 mmol), 3,5-二氯嘧啶甲醛56.8 mg(0.4 mmol)和NaOH 12.0 mg(1.0 eq.),回流反应12 h(TLC检测)。减压蒸除溶剂,经硅胶柱层析[洗脱剂A:V(石油醚) ∶V(乙酸乙酯)=10 ∶1]纯化得黄色固体(Z)-7-氯-3-[(4,6-二甲氧基嘧啶-5-基)烯甲基]-N-甲基氧化吲哚(3a) 85.4 mg。
用类似的方法合成3b~3k。
3a: 黄色固体, m.p. 227.1~228.7 ℃;1H NMRδ: 2.49(s, 3H), 3.31(s, 6H), 6.74~6.78(m, 1H), 6.91~6.96(m, 1H), 7.29~7.36(m, 1H), 7.44(s, 1H), 8.79(s, 1H);13C NMRδ: 29.4, 54.6, 55.3, 114.3, 114.9, 122.8, 122.9, 123.5, 125.4, 129.8, 132.6, 139.7, 158.0 167.0; HR-MS(ESI-TOF)m/z: Calcd for C16H14N3O3ClNa{[M+Na]+}354.062 1, found 354.062 4。
3b: 黄色固体, m.p. 175.4~176.8 ℃;1H NMRδ: 3.29(s, 3H), 4.00(s, 3H), 6.78~6.75(m, 1H), 6.85~6.81(m, 1H), 6.93~6.88(m, 1H), 7.32~7.26(m, 1H), 7.50(s, 1H), 8.64(s, 1H);13C NMRδ: 26.2, 55.0, 108.2, 115.2, 120.9, 122.1, 123.6, 124.0, 130.5, 131.7, 144.5, 157.3, 159.3, 167.6; HR-MS(ESI-TOF)m/z: Calcd for C15H12N3O3ClNa{[M+Na]+}324.051 6, found 324.051 9。
3c: 黄色固体, m.p. 198.7~201.8 ℃;1H NMRδ: 1.23(s, 3H), 3.66(s, 3H), 6.50~6.54(m, 1H), 6.79(t,J=7.9 Hz, 1H), 7.22~7.25(m, 1H), 7.53(s, 1H), 8.86(s, 1H);13C NMRδ: 29.9, 100.0, 116.4, 122.2, 122.8, 123.3, 124.8, 128.2, 131.9, 133.7, 140.7, 157.8, 160.8, 167.0; HR-MS(ESI-TOF)m/z: Calcd for C15H11N3O3Cl2Na{[M+Na]+}358.012 6, found 358.012 7。
3d: 黄色固体, m.p. 209.0~210.7 ℃;1H NMRδ: 1.23~1.28(m, 6H), 4.42~4.51(m, 4H), 6.82~6.98(m, 3H), 7.16~7.28(m, 1H), 7.60(s, 1H), 8.46(s, 1H), 9.29(br s, 1H);13C NMRδ: 14.4, 63.4, 100.1, 109.7, 121.5, 122.5, 124.8, 125.2, 129.4, 129.8, 141.5, 157.1, 167.4, 170.3; HR-MS(ESI-TOF)m/z: Calcd for C17H17N3O3Na{[M+Na]+}334.116 8; found 334.116 8。
3e: 黄色固体, m.p. 116.7~117.1 ℃;1H NMRδ: 3.25~3.34(m, 6H), 3.69(s, 3H), 4.44~4.49(m, 4H), 6.80~6.83(m, 3H), 6.89~6.91(m, 1H), 7.50(s, 1H), 8.61(s, 1H);13C NMRδ: 14.1, 26.2, 63.3, 100.3, 108.1, 109.0, 121.5, 122.0, 123.8, 124.2, 130.5, 144.5, 157.3, 159.3, 167.2; HR-MS(ESI-TOF)m/z: Calcd for C18H19N3O3Na{[M+Na]+}348.132 4, found 348.132 2。
3f: 黄色固体, m.p. 109.0~110.4 ℃;1H NMRδ: 1.26(t,J=7.1 Hz, 6H), 4.43~4.49(m, 4H), 5.00(s, 2H), 6.70(d,J=7.8 Hz, 1H), 6.84~6.94(m, 2H), 7.10~7.15(m, 1H), 7.24~7.38(m, 5H), 7.66(s, 1H), 8.46(s, 1H);13C NMRδ: 14.4, 30.0, 43.7, 63.3, 100.2, 108.6, 121.5, 124.9, 125.0, 127.3, 128.7, 136.1, 143.1, 157.1, 167.4; HR-MS(ESI-TOF)m/z: Calcd for C24H23N3O3Na{[M+Na]+}424.163 7, found 424.163 8。
3g: 黄色固体, m.p. 143.4~144.1 ℃;1H NMRδ: 1.26(t,J=7.1 Hz, 6H), 4.46~4.51(m, 4H), 5.28(s, 2H), 6.72(d,J=7.0 Hz, 1H), 6.79(t,J=7.6 Hz, 1H), 6.93~6.98(m, 1H), 7.20(d,J=7.1 Hz, 2H), 7.25~7.25(m, 1H), 7.31~7.35(m, 2H), 7.56(s, 1H), 8.62(s, 1H);13C NMRδ: 14.2, 18.9, 29.7, 45.2, 64.3, 115.2, 119.9, 122.1, 122.3, 124.0, 125.6, 127.2, 128.9, 134.5, 135.4, 137.6, 157.3, 168.5; HR-MS(ESI-TOF)m/z: Calcd for C24H22N3O3ClNa{[M+Na]+}458.124 7, found 458.124 2。
3h: 黄色固体, m.p. 73.5~74.5 ℃;1H NMRδ: 1.29(t,J=5.8 Hz, 3H), 4.49~4.53(m, 2H), 6.83(d,J=7.6 Hz, 1H), 6.91(d,J=12.4 Hz, 1H), 6.92~6.94(m, 1H), 7.20~7.22(m, 1H), 7.41~7.49(m, 3H), 7.53~7.56(m, 2H), 7.61(s, 1H), 8.64(s, 1H);13C NMRδ: 14.2, 64.4, 109.5, 115.1, 121.0, 122.5, 124.4, 124.6, 126.6, 128.1, 129.6, 130.4, 131.3, 134.3, 144.3, 157.3, 159.4, 166.7, 167.2; HR-MS(ESI-TOF)m/z: Calcd for C21H16N3O2ClNa{[M+Na]+}400.082 9, found 400.083 1。
3i: 黄色固体, m.p. 155.1~157.3 ℃;1H NMRδ: 0.81(d,J=6.4 Hz, 6H), 1.26(s, 1H), 1.45~1.52(m, 2H), 4.44(t,J=6.7 Hz, 2H), 6.80(d,J=7.5 Hz, 1H), 6.85~6.91(m, 1H), 6.96(d,J=7.8 Hz, 1H), 7.21~7.27(m, 1H), 7.50(s, 1H), 8.64(s, 1H), 9.32(br s, 1H);13C NMRδ: 22.3, 24.8, 37.0, 67.0, 110.3, 115.0, 121.5, 122.0, 124.0, 124.4, 130.6, 132.1, 141.9, 157.3, 159.4, 167.2, 169.4; HR-MS(ESI-TOF)m/z: Calcd for C18H18N3O2ClNa{[M+Na]+}366.098 5, found 366.098 6。
3j: 黄色固体, m.p. 106.3~108.4 ℃;1H NMRδ: 2.25(s, 3H), 3.99(s, 6H), 4.06(s, 3H), 5.28(d,J=5.1 Hz, 2H), 6.82(d,J=4.5 Hz, 2H), 6.87~6.94(m, 1H), 7.19~7.24(m, 3H), 7.26~7.32(m, 2H), 7.66(s, 1H);13C NMRδ: 18.9, 45.1, 54.3, 54.9, 93.9, 119.2, 121.5, 122.5, 125.1, 125.7, 126.9, 128.7, 132.8, 138.1, 141.0, 164.5, 169.3; HR-MS (ESI-TOF)m/z: Calcd for C24H23N3O4Na{[M+Na]+}440.158 6, found 440.158 8。
3k: 黄色固体, m.p. 166.3~168.5 ℃;1H NMRδ: 6.81(d,J=7.5 Hz, 1H), 6.86~6.90(m, 1H), 6.99(d,J=7.9 Hz, 1H), 7.28~7.33(m, 1H), 7.45(s, 1H), 8.96(s, 1H), 9.80(br s, 1H);13C NMRδ: 110.4, 120.7, 122.0, 123.2, 124.2, 128.7, 131.6, 133.6, 143.6, 157.8, 160.3, 167.2, 205.6; HR-MS(ESI-TOF)m/z: Calcd for C13H7N3OCl2Na{[M+Na]+}313.986 4, found 313.986 3。
1.3 体外抗肿瘤活性测试
采用MTT法[11-14]测试了3a~3k对人肺癌细胞(A549)和人白血病细胞(K562)的体外抗肿瘤活性,以顺铂为阳性对照药。
2 结果与讨论
2. 1 合成
通过底物扩展,我们发现该反应的活性普遍较高,12 h内基本反应完全(TLC检测)。Z/E值通过粗核磁积分面积确定。鉴于甲氧基的位阻明显大于氯原子,当R5为甲氧基和R4为氯原子时构型最稳定,在产物Z式中占优势构型。其中,在位阻较大的醇类溶剂中反应,产率相对较低,但E/Z选择性较高。在四氢呋喃溶剂中反应,只发生Knoevenagel加成消除反应,未见溶剂参与进一步氯原子的取代反应,产率也相对较低(3k, 70%)。
2.2 抗肿瘤活性
表1为3a~3k对K562和A549的体外抗肿瘤活性。由表1可见, 3a, 3c, 3f, 3g和3j对K562具有较好的抑制活性, IC50分别为29.3 μmol·L-1, 27.6 μmol·L-1, 28.5 μmol·L-1, 24.0 μmol·L-1和27.0 μmol·L-1; 3a, 3h和3j对A549具有较好的抑制活性,分别为28.1 μmol·L-1, 16.4 μmol·L-1和25.2 μmol·L-1,接近于阳性对照药顺铂,说明嘧啶拼接3-烯键氧化吲哚骨架可以作为先导化合物骨架进一步研究。
表1 3a~3k的体外抗肿瘤活性
Table 1Invitroantitumor activities of 3a~3k
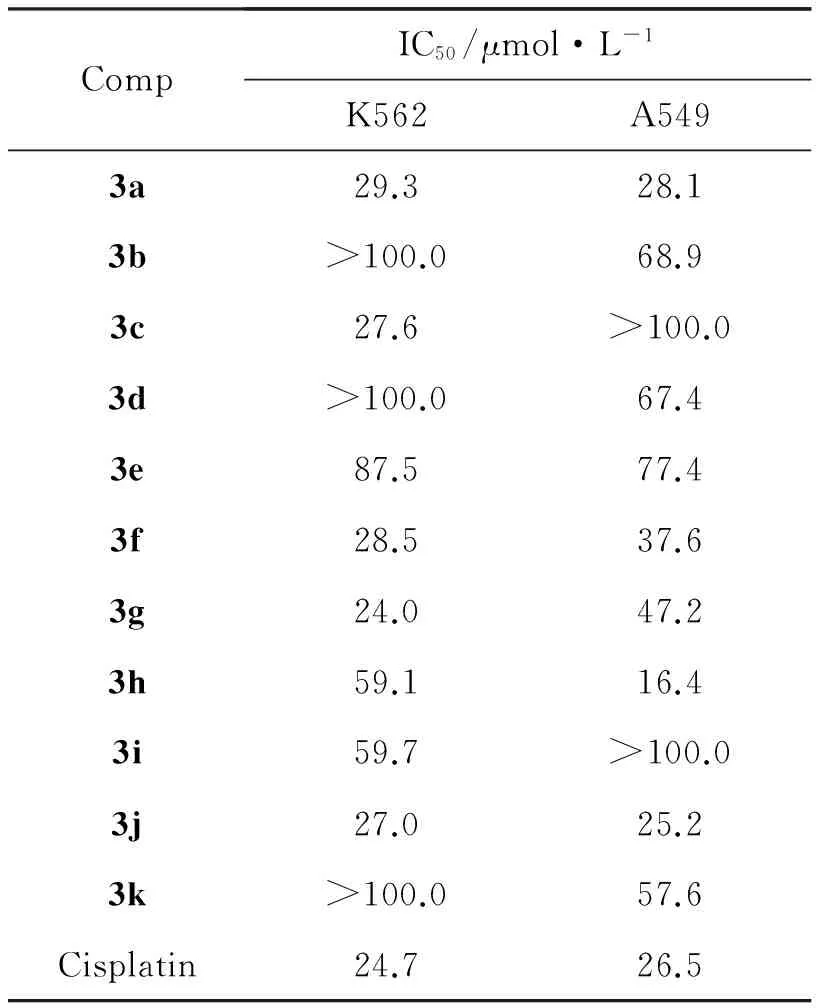
CompIC50/μmol·L-1K562A5493a29.328.13b>100.068.93c27.6>100.03d>100.067.43e87.577.43f28.537.63g24.047.23h59.116.43i59.7>100.03j27.025.23k>100.057.6Cisplatin24.726.5
合成了11个新型的嘧啶拼接3-烯键氧化吲哚衍生物(3a~3k),产率65%~87%,Z/E值5 ∶1~>20 ∶1。并用MTT法研究了3a~3k对人肺癌细胞(A549)和人白血病细胞(K562)的体外抗肿瘤活性。结果表明:3a, 3c, 3f, 3g和3j对K562具有较好的抑制活性, 3a, 3a, 3h和3j对A549具有较好的抑制活性, 接近于阳性对照药顺铂,说明芳嘧啶拼接3-烯键氧化吲哚骨架可以作为先导化合物骨架进一步研究。其他相关药理活性的研究正在进行中。
[1] MacClean D, Schullek J R, Murphy M M,etal. Encoded combinatorial chemistry:Synthesis and screening of a library of highly functionalized pyrrolidines[J].Proc Natl Acad Sci,1997,94:2805-2810.
[2] Hanessian S, Bayrakdarian M. Pyrrolidine as a cogwheel-like scaffold for the deployment of diverse functionality through cycloaddition reactions of metallo-1,3-dipoles in aqueous media[J].Bioorg Med Chem Lett,2000,10:427-431.
[3] Hanessian S, Bayrakdarian M. Solution- and solid-phase asymmetric synthesis of substitutedN-hydroxypyrrolidine dicarboxylic acids[J].Tetrahedron Lett,2002,43:9441-9444.
[4] Neimann C S, Nagayama S, Perlstein E O,etal. A library of spirooxindoles based on a stereoselective three-component coupling reaction[J].J Am Chem Soc, 2004,126:16077-16086.
[5] Inoue M, Mori N, Yamanaka H,etal. Two new cycloartane triterpene glycosides and a new alkaloid from souliea vaginata[J].Heterocycles,2005,65:1409-1914.
[6] Jainil R, Rayman P, Cohen P A,etal. Combination of sunitinib with anti-tumor vaccination inhibits t cell priming and requires careful scheduling to achieve productive immunotherapy[J].Int J Cancer,2014,134:1695-1705.
[7] Mendel D B, Laird A D, Smolich B D,etal. Development of SU5416,a selective small molecule inhibitor of VEGF receptor tyrosine kinase activity,as an anti-angio genesis agent[J].Anticancer Drug Des, 2000,15:29-41.
[8] Dermatakis A, Luk K C, De P W. Synthesis of potent oxindole CDK2 inhibitors[J].Bioorg Med Chem, 2003,11:1873-1881.
[9] Kaminski K, Rapacz A J,uszczki J,etal. Design, synthesis and biological evaluation of new hybrid anticonvulsants derived fromN-benzyl-2-(2,5-dioxopyrrolidin-1-yl)propanamide and 2-(2,5-dioxopyrrolidin-1- yl)butanamide derivatives[J].Bioorg Med Chem,2015,23:2548-2561.
[10] Wan Z Y, Tao Y, Wang Y F,etal. Hybrid chemistry Part 4:Discovery of etravirine-VRX-480773 hybrids as potent HIV-1 non-nucleoside reverse transcriptase inhibitors[J].Bioorg Med Chem,2015,23:4248-4255.
[11] Mosman T J. Rapid colorimetric assay for eellulair growth and survival:Application and cytotxicity assays[J].Immunol Methods,1983,65:55-63.
[12] Alley M C, Scudiero D A, Monks A,etal. Feasibility of drug screening with panals of human tumor cell lines using a mycroculture tetrazolium assay[J].Cancer Res,1988,48:589-601.
[13] 刘雄伟,周根,姚震,等. 异噁唑拼接吡咯螺环氧化吲哚化合物的合成及其抗肿瘤活性[J].合成化学,2016,24(5):389-392.
[14] 彭礼军,周根,韩朔楠,等. 新型芳姜黄酮拼合吡咯螺环氧化吲哚类化合物的合成及其抗肿瘤活性[J].合成化学,2016,24(8):669-672.
《合成化学》再次入选中国科技核心期刊
根据中国科学技术信息研究所发布的最新中国科技论文统计结果,《合成化学》被“中国科学论文与引文数据库”再次编入《2016年中国科技核心期刊目录(自然科学卷)》,有效期至2017年12月,这也是《合成化学》连续第12次入选中国科技核心期刊。
《合成化学》编辑部
第3期, 190~194Chinese Journal of Synthetic ChemistryNo.3, 190~194
Synthesis and Antitumor Activities of Pyrimidine-fused 3-Alkenyloxindoles
ZHOU Gen, LIU Huan-huan, WANG Dan-dan, HAN Shuo-nan, YANG Chao, LIN Bing*, LIU Xiong-li, ZHAO Zhi, ZHOU Ying*
(Guizhou Medicine Edicine Edible Plant Resources Research and Developmant Center, Guizhou University, Guiyang 550025, China)
Eleven novel pyrimidine-fused 3-alkenyloxindoles(3a~3k) were synthesizedviaa Knoevenagel condensation/substitution reaction of pyrimidine aldehydes with 2-oxindoles. The yields andZ/Eof 3a~3k were 65%~87% and 5 ∶1~>20 ∶1, respectively. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI-TOF). Theinvitroantitumor activities against human lung cancer cells(A549) and human leukemia cells(K562) were demonstrated by MTT assays. The results showed that 3a, 3c, 3f, 3g and 3j exhibited good inhibition activities against K562 with IC50of 29.3, 27.6, 28.5, 24.0, 27.0 μmol·L-1, respectively. 3a, 3h and 3j exhibited good inhibition acitvities against A549, showing IC50of 28.1, 16.4, 25.2 μmol·L-1, respectively.
2-oxindole; pyrimidine aldehyde; Knoevenagel reaction; pyrimidine-fused 3-alkenyloxindole; antitumor activity; synthesis
2016-07-23;
2017-02-15
国家自然科学基金资助项目(81560563, 81660576, 81603390); 贵州省教学改革创新项目(SJJG201423, 黔教研合JG字[2016]06); 贵州省制药工程专业学位研究生工作站(黔教研合JYSZ字【2014】002); 贵州省科技合作计划项目(黔科合LH字(2015)7666号)
周根(1990-),男,汉族,贵州安顺人,硕士研究生,主要从事天然产物活性成分研究。 E-mail: 18685389427@qq.com
林冰,博士,副教授,硕士生导师, E-mail: nlin@gzu.edu.cn; 周英,教授,博士生导师, E-mail: yingzhou71@126.com
O626.13; O623.7
A
10.15952/j.cnki.cjsc.1005-1511.2017.03.16196

