耐性肽hCDR1诱发小鼠狼疮样病变的研究
孙玉石,杨 飞,暴玲玉,王 悦,赵凤仪,焦 翔,杨 静,施秉银
(西安交通大学第一附属医院内分泌科,西安 710061;*通讯作者,E-mail:shibingy@126.com)
耐性肽hCDR1诱发小鼠狼疮样病变的研究
孙玉石,杨 飞,暴玲玉,王 悦,赵凤仪,焦 翔,杨 静,施秉银*
(西安交通大学第一附属医院内分泌科,西安 710061;*通讯作者,E-mail:shibingy@126.com)
目的 探讨基于人dsDNA抗体分子互补决定区1(CDR1)的耐受肽(tolerizing peptide)hCDR1作为致病原诱发小鼠狼疮样病变的可能。 方法 6-8周龄B6D2F1雌性小鼠40只,随机分为hCDR1 20 μg组、100 μg组、500 μg组、阴性对照组和阳性对照组。完全弗氏佐剂乳化hCDR1,足跖及尾根部多点皮下注射免疫hCDR1组小鼠,间隔3周,不完全弗氏佐剂乳化hCDR1加强免疫1次;阴性对照组用不含hCDR1的佐剂皮下免疫,阳性对照组小鼠接受DBA/2小鼠脾脏及胸腺单细胞悬液尾静脉注射形成慢性移植物抗宿主样狼疮鼠(SLE-cGVHD)。尿蛋白试纸监测小鼠每周蛋白尿变化。首次免疫后9周采血,检测血液常规;ELISA法检测血清中hCDR1抗体、dsDNA抗体、组蛋白抗体及总IgG抗体;留取肾脏,直接免疫荧光检测肾脏免疫复合物沉积情况;HE染色观察肾脏病理改变。 结果 hCDR1 100 μg组和500 μg组小鼠出现狼疮样改变。与阴性对照组相比,100 μg组小鼠和500 μg组小鼠血清dsDNA抗体、组蛋白抗体OD值增加(P<0.05);外周血血小板减少(P<0.05),白细胞增加(P<0.05);75%小鼠出现狼疮样肾脏改变,表现为尿蛋白阳性,肾小球增生以及肾小球基底膜IgG免疫复合物的沉积。20 μg剂量组小鼠及阴性对照组小鼠未出现狼疮样改变。 结论 hCDR1具有免疫原性,可以作为致病原诱发B6D2F1小鼠出现狼疮样病变。
狼疮样病变; 耐受肽; 移植物抗宿主病; 过继免疫; 小鼠; hCDR1
系统性红斑狼疮(SLE)是以dsDNA抗体、组蛋白抗体、Sm抗体等多种自身抗体的产生为特点,累及全身多个脏器的一种难治性自身免疫性疾病[1]。新型免疫抑制剂及生物靶向药物在改善系统性红斑狼疮患者预后的同时也增加了感染的风险。因而,通过抗原表位肽诱导免疫耐受,作为一种新型的治疗策略逐渐受到人们的重视。hCDR1是基于人dsDNA抗体分子互补决定区1(the complementarity determining region 1 of a human monoclonal anti-DNA autoantibody)设计合成的一段含有19个氨基酸分子多肽。大量研究证实,hCDR1可以在自发性狼疮小鼠(NZB×NZW)F1及因移植了狼疮患者外周血淋巴细胞而表现出狼疮样改变的SCID小鼠体内重新诱导免疫系统对自身抗原的耐受,减缓疾病的发生和发展[2-5]。然而,关于hCDR1的免疫原性以及是否会作为致病原诱发机体产生狼疮病变的研究目前尚无报道。慢性移植物抗宿主狼疮样小鼠(SLE-cGVHD)外周血中可检测到dsDNA抗体、组蛋白抗体等狼疮特异性抗体,小鼠肾病理可见典型狼疮肾炎病理改变。由于上述类似于人类SLE的表现,SLE-cGVHD被广泛应用于狼疮相关的研究[6-8]。本研究通过hCDR1免疫小鼠,并将其与SLE-cGVHD模型进行比较,明确hCDR1是否会诱发无免疫缺陷小鼠产生狼疮样病变,为以后hCDR1的安全应用提供依据。
1 材料与方法
1.1 实验动物
近交系DBA/2(H2d)雌性小鼠16只,6-8周龄,SPF级,杂交系B6D2F1(H2d/b)雌性小鼠40只,6-8周龄,SPF级,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。西安交通大学医学部实验动物中心饲养。所有动物实验均符合西安交通大学医学部动物实验中心管理委员会有关动物管理和使用的规定。
1.2 多肽及主要试剂
hCDR1多肽-GYYWSWIRQPPGKGEEWIG,由上海英骏生物技术有限公司合成;尿蛋白试纸,购自广州市花都高尔宝生物技术有限公司;小牛胸腺DNA、小牛胸腺组蛋白、TMB购自美国Sigma公司;山羊抗小鼠IgG、HRP-山羊抗小鼠IgG,购自北京博奥森生物技术有限公司;FITC-山羊抗小鼠IgG购自北京中杉金桥物技术有限公司。
1.3 动物分组及干预
适应性饲养小鼠1周,饲养室温度22 ℃,湿度为(50±5)%,光照周期为12 h ∶12 h。将B6D2F小鼠随机分为5组:hCDR1 20 μg组、100 μg组、500 μg组、慢性移植物抗宿主狼疮样鼠(SLE-cGVHD)阳性对照组、阴性对照组,每组8只小鼠。
hCDR1免疫小鼠:无菌PBS溶解hCDR1并稀释为0.2 mg/ml,1 mg/ml,5 mg/ml。取上述溶液与等量完全弗氏佐剂混匀,完全乳化。取200 μl混合液对hCDR1免疫组小鼠在足跖及尾根部多点皮下注射免疫。首次免疫后3周,不完全弗氏佐剂乳化hCDR1加强免疫1次,hCDR1剂量同首次免疫。阴性对照组用不含hCDR1的完全弗氏佐剂或不完全弗氏佐剂同样程序免疫小鼠。SLE-cGVHD模型组的诱导:无菌取DBA/2小鼠的脾脏和胸腺并制备成单细胞悬液,调整细胞悬液至2.5×108/ml,将单细胞悬液按照200 μl/只的剂量经尾静脉注入B6D2F1小鼠体内,首次注射记为第0天,在0,4,7,10 d分别免疫小鼠。
1.4 尿蛋白的测定
首次免疫前和首次免疫后每周采集小鼠晨尿,用尿蛋白试纸测尿蛋白量。根据试纸显色程度判断尿里蛋白含量:阴性≤10 mg/dl;+,10-30 mg/dl;++,30-100 mg/dl;+++,300-1 000 mg/dl;++++,>1 000 mg/dl。
1.5 血液常规测定外周血红细胞、血小板和白细胞
首次免疫后第9周,水合氯醛麻醉小鼠后摘眼球取血。全自动血细胞分析仪JM-8800测定小鼠血液常规指标。
1.6 血清抗hCDR1抗体、组蛋白抗体、dsDNA抗体及总IgG抗体的测定
首次免疫后9周,麻醉小鼠眼球取血,4 000 r/min离心10 min,取上清,-80 ℃存贮备用。hCDR1抗体测定:酶联板紫外照射15 min,加入100 μg/ml hCDR1 100 μl,4 ℃过夜,3%BSA 37 ℃封闭2 h,100 μl 1 ∶40稀释的待测血清样品,37 ℃孵育1 h,100 μl 1 ∶3 000稀释的HRP-山羊抗小鼠IgG抗体,37 ℃孵育1 h。每次孵育后PBST洗板3次,甩干。100 μl TMB溶液,室温下显色15-30 min,50 μl 2 mmol/L的H2SO4终止显色,波长450 nm测定光密度值。血清抗双链DNA抗体测定:酶联板紫外照射后加入100 μl 100 μg/ml的L-多聚赖氨酸预包被,室温下放置2 h,去离子水清洗并甩干,100 μl 100 μg/ml小牛胸腺DNA 100 μl包被酶联板。其余操作与抗hCDR1抗体测定相同。组蛋白抗体测定:20 μg/ml小牛胸腺组蛋白包被酶联板,其余操作与抗hCDR1抗体测定相同。血清总IgG水平测定:用10 μg/ml山羊抗小鼠IgG包被酶联板,其余操作与抗hCDR1抗体测定相同。在测定hCDR1抗体、组蛋白抗体、dsDNA抗体时血清稀释倍数为1 ∶40,测定总IgG时血清稀释倍数为1 ∶40 000。
1.7 肾脏病理和直接免疫荧光
甲醛溶液固定小鼠右侧肾脏,石蜡包埋并切片,苏木精-伊红(HE)染色,光镜观察肾脏组织病理改变。左侧肾脏液氮速冻后用OCT包埋,冰冻切片,FITC-山羊抗小鼠IgG孵育,37 ℃避光30 min,PBS洗去未结合的抗体,无荧光甘油封闭后荧光显微镜观察。荧光强度的判定:-,高低倍镜均不显示;±,高倍镜下隐约可见;+,低倍镜下隐约可见,高倍镜下可见;++,低倍镜下可见,高倍镜下清晰;+++,低倍镜下清晰,高倍镜下耀眼;++++,低倍镜下耀眼,高倍镜下刺眼。
1.8 统计学分析
2 结果
2.1 小鼠尿蛋白含量变化
与SLE-cGVHD组小鼠相似,hCDR1免疫组小鼠在首次免疫后第2周开始出现蛋白尿,多为+。第9周时,100 μg组75%小鼠出现蛋白尿,500 μg组62.5%小鼠出现蛋白尿,蛋白尿多为(+)-(++)。20 μg组小鼠及阴性对照组小鼠尿蛋白检测结果始终为阴性。与SLE-cGVHD组小鼠相比,hCDR1免疫组小鼠蛋白尿较轻,在第9周时差异具有统计学意义(P<0.05,见表1)。
表1 不同时点各组小鼠尿蛋白含量分布情况比较
Table 1 Comparison of positive urinary protein in each group at different times
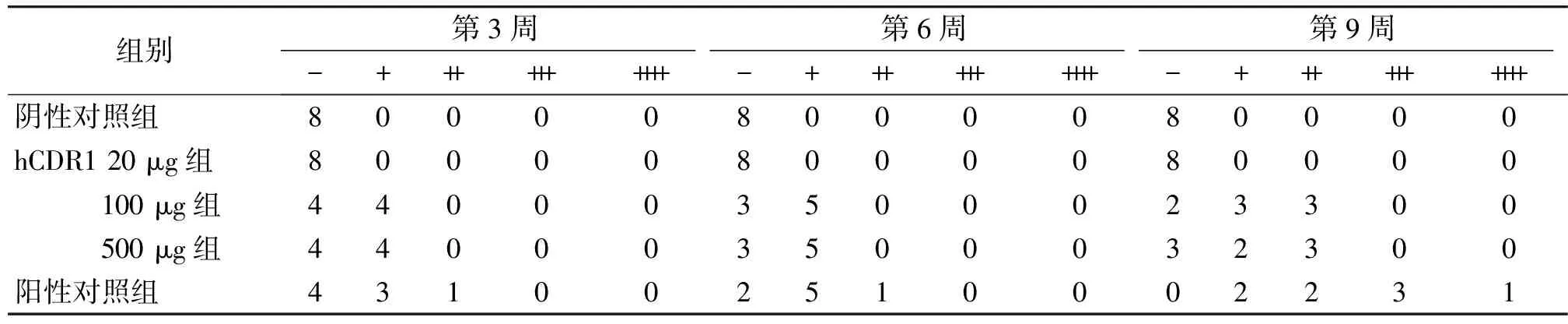
组别第3周第6周第9周-++++++++++-++++++++++-++++++++++阴性对照组800008000080000hCDR120μg组800008000080000 100μg组440003500023300 500μg组440003500032300阳性对照组431002510002231
与阴性对照组相比,100 μg组和500 μg组第6周和第9周均P<0.05,阳性对照组第3,6,9周均P<0.05;hCDR1不同浓度组与阳性对照组比较,第9周P<0.05
2.2 小鼠外周血红细胞、血小板、白细胞的变化
首次免疫后9周检测血常规,hCDR1免疫组小鼠与SLE-cGVHD组小鼠外周血中红细胞、血小板、白细胞变化趋势一致。与阴性对照组小鼠相比,hCDR1 100 μg组、500 μg组及SLE-cGVHD小鼠外周血中血小板减少,白细胞升高,差异具有统计学意义(均P<0.05)。与SLE-cGVHD组小鼠比较,hCDR1免疫组小鼠血小板降低程度及白细胞升高程度均较低,差异具有统计学意义(均P<0.05)。hCDR1 20 μg组小鼠与阴性对照组小鼠相比红细胞、血小板、白细胞均无明显差异(见图1)。
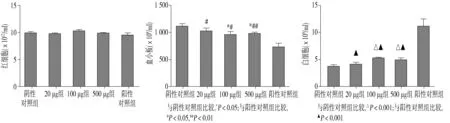
A.各组小鼠外周血红细胞比较 B.各组小鼠外周血血小板比较 C.各组小鼠外周血白细胞比较图1 各组小鼠外周血红细胞、血小板、白细胞比较Figure 1 Comparison of count of peripheral blood erythrocytes,platelets and leukocytes among different groups
2.3 hCDR1免疫小鼠血清自身抗体变化
首次干预后9周,留取小鼠血清测定相关抗体。与阴性对照组小鼠相比,hCDR1 100 μg组及500 μg组小鼠血清中hCDR1抗体、dsDNA抗体、组蛋白抗体和总IgG均增加,差异具有统计学意义(见图2)。hCDR1 20 μg组小鼠,hCDR1抗体及总IgG较阴性对照组显著增加,dsDNA抗体及组蛋白抗体与阴性对照组相比无显著差异。与SLE-cGVHD组小鼠相比,hCDR1免疫组小鼠血清中dsDNA抗体,组蛋白抗体升高幅度小但差异具有统计学意义(均P<0.05)。

图2 各组小鼠血清中相关抗体检测Figure 2 The OD value of antibodies in each group
2.4 小鼠肾脏病理改变
首次免疫后9周,处死小鼠,留取右侧肾脏做病理切片HE染色。hCDR1免疫组小鼠肾脏以肾小球增生,间质炎性细胞浸润为主,未见明显的细胞新月体形成及肾小球硬化,部分肾小管中可见少量嗜伊红的蛋白样物质沉积。SLE-cGVHD组小鼠肾脏以肾小球硬化为主,可见细胞新月体形成,肾小管大量嗜伊红蛋白样物质沉积(见图3)。小鼠肾脏冰冻切片直接免疫荧光结果显示,hCDR1免疫小鼠及SLE-cGVHD小鼠肾脏出现颗粒状荧光物质沿肾小球基底膜沉积,hCDR1免疫组小鼠肾脏荧光强度显著弱于阳性对照(SLE-cGVHD)组小鼠,且差异具有统计学意义(P<0.05,见图4,表2)。
3 讨论
hCDR1是基于人dsDNA抗体分子互补决定区设计合成的一段含有19个氨基酸的多肽,研究表明hCDR1可诱导狼疮小鼠产生免疫耐受,减缓疾病进展[2-5]。目前而言,hCDR1是否会作为致病源诱发或加重狼疮病变尚未可知。本研究将hCDR1辅以免疫佐剂皮下免疫B6D2F1小鼠,小鼠出现与SLE-cGVHD相似的病理改变,证实hCDR1具有免疫原性,可以作为致病原诱发B6D2F1小鼠出现狼疮样病变。
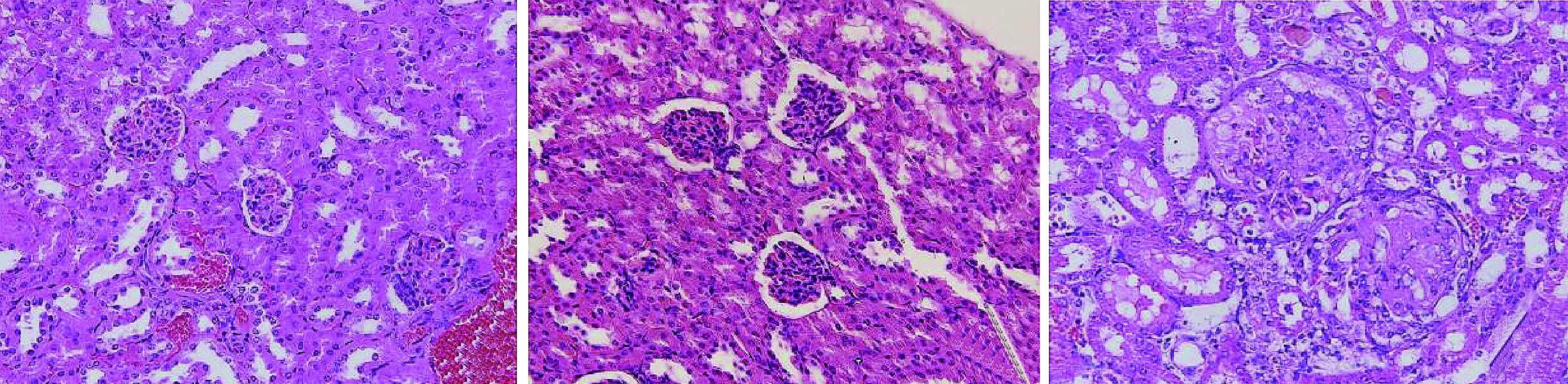
A.阴性对照组 B.hCDR1免疫组 C.阳性对照组图3 各组小鼠肾脏病理改变HE染色 (×400)Figure 3 Pathological changes of kidney by HE staining (×400)
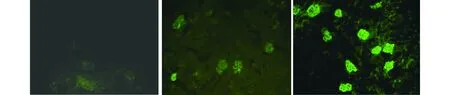
A.阴性对照组 B.hCDR1免疫组 C.阳性对照组图4 各组小鼠肾脏免疫复合物沉积直接免疫荧光结果 (×200)Figure 4 Immunofluorescence results of kidney sections stained with FITC-conjugated IgG antibody (×200)
表2 各组小鼠肾脏荧光强度的分布情况对比
Table 2 IgG deposition scores of kidney sections
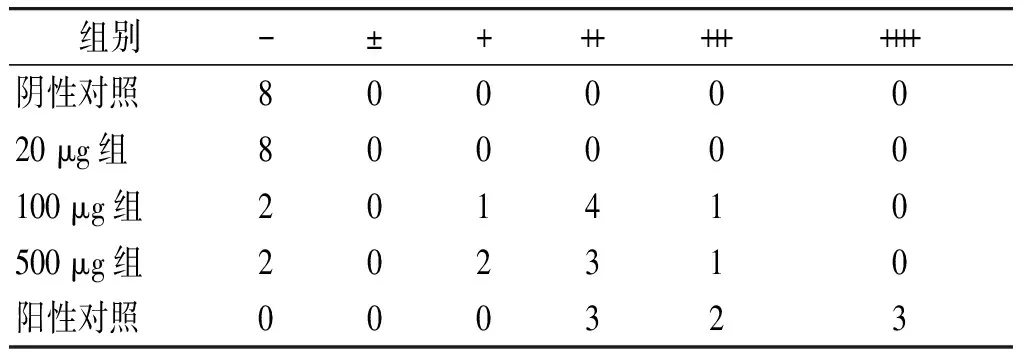
组别-±++++++++++阴性对照80000020μg组800000100μg组201410500μg组202310阳性对照000323
hCDR1 100 μg,500 μg组,阳性对照组与阴性对照相比较均P<0.05;hCDR1免疫组与阳性对照组比较,P<0.05
以dsDNA抗体为代表的多种自身抗体是SLE最主要特征之一,也是SLE诊断的标准之一[1]。本研究表明,hCDR1免疫小鼠血清中除了hCDR1抗体外,还检测出了抗dsDNA、组蛋白等狼疮特异性抗体。SLE可累计全身各个系统,其中肾脏是最常被累及的器官[1,9]。尿蛋白阳性是肾脏受累的主要表现,也是检验狼疮模型成功与否的标准之一。在hCDR1免疫后第9周,75% 100 μg hCDR1免疫的小鼠及62.5% 500 μg hCDR1免疫的小鼠出现了蛋白尿。肾脏HE及直接免疫荧光染色显示,hCDR1免疫小鼠呈现出与经典狼疮模型SLE-cGVHD相似的肾脏病理改变。SLE血液系统受累表现为外周血红细胞、血小板和白细胞同时或单独的降低[1]。本次研究中,SLE-cGVHD小鼠及hCDR1免疫小鼠血液系统表现为血小板数量的下降以及白细胞的增加。抗dsDNA抗体、抗组蛋白抗体等狼疮特异性抗体的出现,肾脏及血液系统的受累,表明作为耐受肽的hCDR1诱发B6D2F1小鼠出现狼疮样病理改变。
表位扩展(epitope spreading)是指机体在免疫应答的过程中由针对某抗原分子的一个表位到多个表位,从某种抗原到其他抗原的逐渐多样化的现象。近年来研究表明,人或者动物的免疫应答过程中均存在表位扩展,并且参与了自身免疫性疾病的发病过程[10-12]。研究显示Sm抗原模拟表位肽免疫小鼠,可以诱导出狼疮样改变[13,14]。本次研究hCDR1皮下免疫小鼠,小鼠血清除了hCDR1抗体之外还检测到抗dsDNA、组蛋白等多种自身抗体。这表明小鼠在对hCDR1发生免疫应答的过程中发生表位扩展,由针对hCDR1的免疫反应发展为针对dsDNA,组蛋白等多种自身抗原的免疫反应。对于这种现象发生的机制及在hCDR1诱发小鼠狼疮样病变中所起的作用尚需进一步研究和探讨。SLE可累计全身各个系统,其中肾脏是最常被累及的器官。研究表明以抗dsDNA抗体为代表的多种自身抗体在狼疮患者肾脏的发病过程中起到重要作用[15,16]。hCDR1免疫小鼠的肾脏损伤是否与外周血中出现的抗dsDNA等自身抗体相关尚需进一步的探究。
相较于非特异性免疫抑制治疗,通过hCDR1等表位肽诱导免疫耐受治疗SLE的同时不会对机体进行全面的免疫抑制,因而具有很好的应用前景。然而,本研究证实,作为耐受肽的hCDR1同样具有致病性可诱发小鼠出现狼疮样病变。这也提示今后应用hCDR1诱导免疫耐受,治疗狼疮发病过程的时候需注意干预途径及剂量,警惕hCDR1作为致病原诱发或加重疾病的可能性。
[1] Lisnevskaia L,Murphy G,Isenberg D.Systemic lupus erythematosus[J].Lancet,2014,384(9975):1878-1888.
[2] Mozes E,Sharabi A.A novel tolerogenic peptide,hCDR1,for the specific treatment of systemic lupus erythematosus[J].Autoimmun Rev,2010,10(1):22-26.
[3] Sthoeger Z,Sharabi A,Mozes E,Novel approaches to the development of targeted therapeutic agents for systemic lupus erythematosus[J].J Autoimmun,2014,54:60-71.
[4] Sharabi A,Sthoeger ZM,Mahlab K,etal.A tolerogenic peptide that induces suppressor of cytokine signaling(SOCS)-1 restores the aberrant control of IFN-gamma signaling in lupus-affected(NZB x NZW)F1 mice[J].Clin immunol,2009,133(1):61-68.
[5] Mauermann N,Sthoeger Z,Zinger H,etal.Amelioration of lupus manifestations by a peptide based on the complementarity determining region 1 of an autoantibodyin severe combined immunodeficient(SCID)mice engrafted with peripheral blood lymphocytes of systemic lupus erythematosus(SLE)patients[J].Clin Exp Immunol,2004,137(3):513-520.
[6] Van Rappard-Van Der Veen FM,Radaszkiewicz T,Terraneo L,etal.Attempts at standardization of lupus-like graft-vs-host disease:inadvertent repopulation by DBA/2 spleen cells of H-2-different nonirradiated F1 mice[J].J Immunol,1983,130(6):2693-2701.
[7] Perry D,Sang A,Yin Y,etal.Murine models of systemic lupus erythematosus[J].J Biomed Biotechnol,2011,2011:271694.
[8] Xiao ZY,Chen SH,Cheng JP,etal.Y27,a novel derivative of 4-hydroxyquinoline-3-formamide,prevents the development of murine systemic lupus erythematosus-like diseases in MRL/lpr autoimmune mice and BDF1 hybrid mice[J].Arthritis Res Ther,2012,14(6):R235.
[9] Koutsokeras T,Healy T.Systemic lupus erythematosus and lupus nephritis[J].Nat Rev Drug Discov,2014,13(3):173-174.
[10] 吴瑾,吴厚生.自身免疫病中表位扩展的研究进展[J].上海免疫学杂志,2001,21(1):62-64.
[11] Cornaby C,Gibbons L,Mayhew V,etal.B cell epitope spreading:mechanisms and contribution to autoimmune diseases[J].Immunol Lett,2015,163(1):56-68.
[12] Seitz-Polski B,Dolla G,Payre C,etal.Epitope spreading of autoantibody response to PLA2R associates with poor prognosis in membranous nephropathy[J].J Am Soc Nephrol,2016,27(5):1517-1533.
[13] 谢红付,冯浩,曾海燕,等.利用Sm抗原模拟表位肽构建狼疮样鼠模型[J].中国医学科学院学报,2007,29(2):191-195.
[14] James JA,Harley JB.A model of peptide-induced lupus autoimmune B cell epitope spreading is strain specific and is not H-2 restricted in mice[J].J Immunol,1998,160(1):502-508.
[15] Goilav B,Putterman C.The Role role of anti-DNA antibodies in the development of lupus nephritis:a complementary,or alternative,viewpoint?[J].Semin Nephrol,2015,35(5):439-443.
[16] Fenton KA,Tommeras B,Marion TN,etal.Pure anti-dsDNA mAbs need chromatin structures to promote glomerular mesangial deposits in BALB/c mice[J].Autoimmunity,2010,43(2):179-188.
Tolerizing peptide hCDR1 induces lupus-like symptom in mice
SUN Yushi,YANG Fei,BAO Lingyu,WANG Yue,ZHAO Fengyi,JIAO Xiang,YANG Jing,SHI Bingyin*
(DepartmentofEndocrinology,FirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China;*Correspondingauthor,E-mail:shibingy@126.com)
ObjectiveTo explore the possibility of hCDR1,a peptide based on the complementarity determining region(CDR)1 of a human monoclonal anti-DNA autoantibody,inducing an SLE-like disease in B6D2F1 mice.MethodsForty B6D2F1 mice were divided into five groups randomly:hCDR1 20 μg group,100 μg group,500 μg group,normal control group and positive control group[chronic graft versus host disease murine model of lupus(SLE-cGVHD)].Mice were subcutaneously injected with 0.2 ml hCDR1 in hCDR1 groups and 0.2 ml adjuvant in normal control group.SLE-cGVHD was induced by intravenous injections of parental female DBA/2 lymphocytes. The serum hCDR1 antibody, anti-dsDNA antibody,anti-histone antibody and total IgG were detected by ELISA.Kidney spe-cimens were observed by immunofluorescence and histological examination.ResultsSLE-like symptoms were successfully induced by hCDR1 in 100 μg group and 500 μg group.Compared with normal control group,mice in 100 μg group and 500 μg group acquired higher OD value of dsDNA antibodies(P<0.05)and anti-histone antibodies(P<0.05).Compared with normal control group,periphe-ral blood PLT significantly decreased,while peripheral blood WBC increased in 100 μg group and 500 μg group(P<0.05).In 100 μg group and 500 μg group,75% mice got nephritis characterized by proteinuria and immunocomplex deposition in glomeruli.No SLE-like symptom was detected in 20 μg hCDR1 immunized mice and normal control mice.ConclusionSLE-like symptom could be induced by hCDR1 in B6D2F1 mice.
systemic lupus erythematosus; tolerizing peptide; chronic graft versus host disease; adoptive immunity; mice; hCDR1
国家自然科学基金资助项目(81471005)
孙玉石,女,1988-10生,在读博士,E-mail:395755862@qq.com
2016-12-12
R593.2
A
1007-6611(2017)03-0235-06
10.13753/j.issn.1007-6611.2017.03.008

