半枝莲阻滞人结肠癌细胞周期的机制
张铃,方翌,蔡巧燕,林珊,魏丽慧,彭军(福建中医药大学中西医结合研究院,福建福州350122)
半枝莲阻滞人结肠癌细胞周期的机制
张铃,方翌,蔡巧燕,林珊,魏丽慧,彭军
(福建中医药大学中西医结合研究院,福建福州350122)
目的研究半枝莲氯仿极性部位提取物(ECSB)阻滞人结肠癌细胞周期的机制。方法用ECSB干预结肠癌细胞株HCT-8、SW620,检测其细胞周期相关基因的表达。结果ECSB干预SW620细胞后,其p16表达上升,PCNA表达下降;ECSB干预HCT-8细胞后,Cyclin D1、CDK2、CDK4表达下降。结论ECSB通过调控细胞周期相关基因的表达,抑制人结肠癌细胞的增殖。
半枝莲氯仿极性部位提取物;结肠癌;细胞周期
结肠癌(colorectal cancer,CRC)的发病率和死亡率呈逐年上升趋势,目前治疗CRC的常见方法有手术、放疗、化疗、靶向治疗等,但均未取得突破性进展,主要原因是肿瘤细胞具有无限增殖能力,容易产生复发和转移。半枝莲为唇形科黄芩属植物半枝莲Scutellaria barbata D.Don的干燥全草,归肺、肝、肾、大肠经,具有清热解毒、活血化瘀、利尿消肿的功效[1]。临床证实半枝莲与其它药物联合应用,可明显减轻患者放化疗的副作用,改善生活质量,延长生存时间。半枝莲对肿瘤的疗效确切,但由于组分复杂使得其抗肿瘤的有效成分仍然未知。我们前期研究将半枝莲萃取为氯仿、乙酸乙酯、正丁醇、石油醚,初步确定氯仿极性部位提取物(ECSB)为4个部位中最有效的抗肿瘤部位[2]。本研究从ECSB阻滞人结肠癌细胞周期方面进行研究,以确定半枝莲的物质基础及作用机制,为临床应用提供实验依据。
1 实验材料
1.1 细胞来源结肠癌细胞株SW620(上海中科院细胞库);HCT-8(南京凯基生物科技发展有限公司)。
1.2 药物与试剂半枝莲购于福建中医药大学国医堂;L-15、RPMI-1640培养基(南京凯基生物科技发展有限公司);胰蛋白酶、胎牛血清、Trizol、Super-Script III First-Strand Synthesis System试剂盒(美国Invitrogen公司);Extensor Hi-Fidelity PCR Master Mix试剂盒(美国Fermentas公司);氯仿、异丙醇、无水乙醇(国药集团化学试剂有限公司);引物合成、DEPC处理水(上海生物工程有限公司);Taq酶(德国Sigma公司);GenomeLabTM Gexp start kit试剂盒、分离胶、甲酰胺(SLS)、DSS-400(美国Beckman公司)。
1.3 主要仪器CO2培养箱(力康生物医疗科技控股有限公司),PCR扩增仪(美国Bio-rad公司),GenomeLabTM Gexp遗传分析系统(美国Beckman公司)。
2 实验方法
2.1 半枝莲不同极性部位提取物的制备制备方法见文献[2]。
2.2 细胞培养将结肠癌细胞株SW620和HCT-8分别接种到250 mL的培养瓶中,加入含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的L-15和RPMI-1640培养基,在37℃、5%CO2培养箱进行传代培养。
2.3 RT-PCR检测SW620细胞基因表达SW620以5×105个/mL接种于6孔板中,加入25、50、75 μg/mL ECSB干预24 h后收集细胞。用Trizol提取总RNA,-20℃保存备用。用SuperScript III First-Strand Synthesis System试剂盒进行逆转录,将获得的cDNA通过PCR扩增得到p16(多肿瘤抑制因子)、PCNA(增殖细胞核抗原)基因,以GAPDH为内参。PCR扩增用Extensor Hi-Fidelity PCR Master Mix试剂盒,具体操作按试剂盒说明书。PCR产物进行1.5%琼脂糖凝胶电泳,电压80~100 V。电泳结束后,用凝胶成像系统进行图像采集。
2.4 Gexp技术检测HCT-8细胞基因表达HCT-8以2×105个/mL接种于6孔板中,加入150 μg/mL ECSB干预48 h后收集细胞,用Trizol提取总RNA,-20℃保存备用。引物配制:将要检测的所有基因的下游引物混合,配制终浓度为500 nmol/L的混合液。将要检测的所有基因的上游引物混合,配制终浓度为200 nmol/L的混合液。逆转录时用下游混合引物,PCR时用上游混合引物,其余加样按试剂盒说明书操作。逆转录的反应程序为:48℃1 min,42℃1 h,95℃5 min,4℃hold。将获得的cDNA进一步通过PCR扩增得到Cyclin D1(细胞周期素D1)、CDK2(细胞周期素依赖性激酶2)、CDK4(细胞周期素依赖性激酶4)基因。PCR的反应程序为:94℃1 min(94℃30 s,55℃30 s,70℃1 min)×35个循环。用SLS稀释Marker(DSS-400),PCR产物经稀释后进行毛细管电泳分离,用默认分析参数对毛细管电泳的结果进行片段分析。以TBP、GAPDH、CYPLOPHOH为参考基因,将其峰值求几何均数,各基因的峰值与该几何均数的峰值相除,得到各基因的相对表达量。
3 实验结果
实验结果见图1、表1。
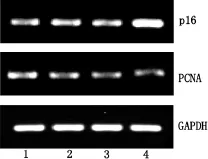
图1 RT-PCR检测SW620细胞在ECSB干预后其p16、PCNA的mRNA表达量
表1 Gexp检测HCT-8细胞在ECSB干预后其Cyclin D1、CDK4、CDK2的mRNA表达量

表1 Gexp检测HCT-8细胞在ECSB干预后其Cyclin D1、CDK4、CDK2的mRNA表达量
注:与0 μg/mL组比较,1)P<0.05,2)P<0.01。
ECSB浓度150 μg/mL组0 μg/mL组CDK2 0.41±0.111)0.70±0.28 n 3 3 Cyclin D1 1.73±0.602)17.45±4.58 CDK4 1.78±0.222)6.04±0.50
4 讨论
4.1 细胞周期中可以影响细胞从一个时期向另一个时期转换的时间点,称为限制点。常见的限制点有G1/S、G2/M和纺锤体装配限制点。恶性肿瘤的生物学特性之一就是使这些限制点紊乱,导致细胞的失控性增殖[3]。红花多糖能阻滞肝癌SMMC-7721细胞在G2/M期[4],白花蛇舌草能阻滞结肠癌HT-29细胞在G1/S期[5]。细胞周期的调控可分为外源性和内源性途径进行,内源性途径主要是通过细胞周期素(Cyclins)、细胞周期素依赖性激酶(CDKs)、细胞周期素依赖性激酶抑制因子(CKIs)的调控来实现[6]。CDKs与不同的Cyclins结合形成二聚体后驱动细胞进入不同的时期,其中CDK2、CDK4能结合Cyclin D1,控制细胞G1/S期的进展。研究[7]表明许多肿瘤的CDKs和Cyclins常过度表达,从而导致其细胞周期的异常活跃。CKIs参与细胞周期限制点的负调控,阻滞细胞周期进展,这些小分子蛋白家族为细胞周期抑制蛋白,包括p16、p53、p27、pRB[8],其中p16基因位于人类的第9号染色体短臂2区1带(9p21),能抑制CDK4的活性,阻止细胞进入S期,在许多恶性肿瘤中存在纯合性缺失[9-10]。
4.2 我们前期研究通过colony formation实验证实,ECSB能显著抑制SW620细胞的增殖,并且是通过下降Cyclin D1和CDK4的表达所介导的,但对p16的影响不明确。本实验在前期研究基础上进一步证实SW620细胞在ECSB干预24 h后,其p16的表达呈剂量依赖性的上调。本实验在另外一株结肠癌细胞HCT-8中也得到相同结果。150 μg/mL ECSB能下调HCT-8细胞的Cyclin D1、CDK4、CDK2,提示ECSB可通过调控细胞周期的相关基因起到抑制细胞增殖的作用。
4.3 ECSB能显著下调SW620细胞的PCNA表达,并呈剂量依赖性,证明了ECSB能抑制结肠癌细胞的增殖。
[1]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2005:77-78.
[2]ZHANG L,CAI Q,LIN J,et al.Chloroform fraction of Scutellaria barbata D.Don promotes apoptosis and suppresses proliferation in human colon cancer cells[J].Molecular medicine reports,2014,9(2):701-706.
[3]孙阳,史默怡,王亚贤.中药对肿瘤细胞周期影响的研究进展[J].中医药信息,2013,29(6):109-111.
[4]梁颖,张晓莉,陶冀,等.红花多糖对人肝癌SMMC-7721细胞增殖的抑制作用[J].中医药学报,2011,5(5):32-35.
[5]LIN M,LIN J,WEI L,et al.Hedyotis diffusa Willd extract inhibits HT 29 cell proliferation via cell cycle arrest[J].Experimental and therapeutic medicine,2012,4(2):307-310.
[6]彭飞,彭玲,黄琼瑶.血根碱调控肿瘤细胞周期机制研究进展[J].湖南中医杂志,2011,27(2):130-132.
[7]ASGHAR U,WITKIEWICZ A K,TURNER N C,et al.The history and future of targeting cyclin-dependent kinases in cancer therapy[J].Nature reviews Drug discovery,2015,14(2):130-146.
[8]韩世愈,王娇.细胞周期蛋白在恶性肿瘤中的表达及其在肿瘤治疗中的作用[J].分子诊断与治疗杂志,2013,5(15):357-360.
[9]PEURALA E,KOIVUNEN P,HAAPASAARI K M,et al.The prognostic significance and value of cyclin D1,CDK4 and p16 in human breast cancer[J].Breast Cancer Research,2013,15(1):1-10.
[10]王新华,崔涌,孟宪杰.PTEN、p16、突变型p53在膀胱癌组织中的表达及意义[J].山东医药,2013,53(10):37-39.
R285.5
A
1000-338X(2017)01-0024-02
2016-10-05
福建省自然科学基金资助课题(2015J01687);福建省卫生厅青年科研项目资助课题(2014-2-29);
张铃(1986—),女,理学硕士,实验师,主要从事中药抗肿瘤的机制研究。
彭军(1969—),男,教授。E-mail:pjunlab@hotmail.com

