前列宁胶囊调控Caspase-3通路治疗良性前列腺增生的机制
周建衡,林久茂,钟晓勇,洪振丰(.福建中医药大学中西医结合学院,福建福州50;.福建中医药大学中西医结合研究院,福建福州50;.福建中医药大学附属人民医院,福建福州50004)
·实验研究·
前列宁胶囊调控Caspase-3通路治疗良性前列腺增生的机制
周建衡1,林久茂2,钟晓勇3,洪振丰2
(1.福建中医药大学中西医结合学院,福建福州350122;2.福建中医药大学中西医结合研究院,福建福州350122;3.福建中医药大学附属人民医院,福建福州350004)
目的研究前列宁胶囊治疗良性前列腺增生(BPH)的机制。方法用SD大鼠制作BPH模型,光镜观察6组大鼠前列腺组织病理改变,Real-time PCR法检测6组大鼠前列腺组织Fas、Caspase-8、Caspase-3、Bax及bcl-2基因表达,BPH-1细胞培养,前列宁胶囊不同剂量干预,比色法分析Caspase-8、Caspase-3活化,Real-time PCR检测Fas、Bax及bcl-2基因表达,Westen-blot检测Fas、bcl-2、Bax蛋白表达。结果病理显示前列腺病理组织明显改善,前列腺组织中Fas、Caspase-8、Caspase-3、Bax基因表达增强,bcl-2表达降低;BPH-1细胞培养,前列宁胶囊干预后,倒置显微镜观察BPH-1细胞胞密度明显减少,细胞变小,细胞凋亡增加,前列宁胶囊不同剂量干预比色法分析Caspase-8、Caspase-3活化增强,Real-time PCR、Westen-blot检测Fas、Bax基因及蛋白表达增强,bcl-2降低。结论前列宁胶囊调控Caspase-3通路中的相关因子,促进前列腺组织细胞凋亡,是其治疗BPH的机制。
前列宁胶囊;前列腺良性增生;细胞凋亡
课题组前期研究发现前列宁胶囊治疗良性前列腺增生(BPH)有明显效果,能够促进BPH-1凋亡、抑制细胞增殖,并调控多种细胞因子,但其治疗BPH机制尚未明了[1-4]。本实验通过研究前列宁胶囊对caspase-3信号通路过程中的相关因子Fas、caspase-8的影响,探讨前列宁胶囊治疗BPH的机制。
1 材料
1.1 动物及细胞株健康SPF级成年雄性SD大鼠60只,体质量190~220 g,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪2007-0005),批号:0017446。正常喂养,在实验室适应环境5 d后进行实验。BPH-1细胞株(南开大学生命科学院分子生物研究所)。
1.2 药物制备前列宁胶囊(福建省人民医院院内制剂,批号:闽Z20110009)。动物治疗浓度:前列宁胶囊低中高剂量组[2.25 g/(kg/d)组、4.5 g/(kg/d)组、9 g/(kg/d)组]。细胞干预浓度:用40%DMSO溶解,配制成0.5 g/mL溶液,经高压灭菌后,4℃保存待用。用时用培养基稀释成10 mg/mL过滤后再配成0、1.25、2.5、5 mg/mL的终浓度。
1.3 试剂丙酸睾酮注射液(上海通用药业股份有限公司,规格:25 mg/mL,批号:H31020524);保列治(杭州默沙东制药公司,批号:J20050041);RT试剂盒、Trizol、PCR试剂盒(大连Takara Biotechnolo gy公司);Taq聚合酶、Rnaseinhibitor(日本TaK-aRa公司);引物由上海英俊生物有限公司合成;RPMI 1640培养基、胰蛋白酶,胎牛血清(FBS)(美国Hyclone公司);Caspase-3、Caspase-8检测试剂盒(美国Biovision公司);Caspase-3、Caspase-8底物Asp-Glu-Val-Asp(DEAD)-p-nitroaniline(pNA),Bcl-2、Bax、Fas一抗、二抗,DAB(河北博海生物工程开发有限公司)。
1.4 仪器RE-2000旋转蒸发仪(上海亚荣生化仪器厂);DLSB-5/20低温冷却循环泵(郑州长城科工贸有限公司);B-290型实验室小型喷雾干燥机(瑞士Buchi公司);多功能彩色细胞图象分析管理系统(美国Media Cybernetics公司);ELX800酶标仪(美国BioTek公司);HF212UV CO2培养箱、IX70荧光倒置相差显微镜(日本Olympus公司);GST-1型PCR仪(英国Gstorm公司);Gel DOC 2000型凝胶成像分析系统、APC 300型电泳仪(美国Bio-Rad公司);DU-650型蛋白核酸分析仪(美国Beckman公司);LG16-3高速冷冻离心机(北京时代北利离心机有限公司);流失细胞仪(美国BD公司)。
2 方法
2.1 BPH大鼠动物模型的制备、给药及取材SPF级雄性SD大鼠60只,100 mg/kg氯胺酮腹腔注射麻醉,经阴囊行无菌手术,摘除双侧睾丸,恢复1周
后,每只皮下注射5 mg/(kg/d)丙酸睾酮,连续28 d,每周称体质量1次。造模成功后,6组继续注射造模的同时,空白对照组和病理模型组大鼠灌服生理盐水,其余6组按照相应剂量给药。给药剂量为:空白组、病理模型组生理盐水10 ml/(kg/d)、保列治组0.5 mg/(kg/d)、前列宁胶囊低剂量组2.25 g/(kg/d)、中剂量组4.5 g/(kg/d)、高剂量组9 g/(kg/d),灌胃给药每日1次,连续28 d。给药期间,每周称体质量/次以调整给药剂量。末次灌胃后禁食24 h,各鼠称质量,麻醉,腹主动脉取血,分离出完整的前列腺组织,测量前列腺湿重和体积,计算前列腺指数。6组取相同部位的前列腺组织1块,10%福尔马林固定液固定,待测。6组取50~100 mg前列腺组织保存于液氮中,待测。
2.2 BPH-1细胞培养及形态学观察BPH-1细胞株置含10%热灭活FBS的RPMI-1640培养液中,于37℃、5%CO2饱和湿度的细胞培养箱中培养。对数生长期的BPH-1细胞经胰酶消化后,BPH-1细胞按2×105、个细胞/孔接种到6孔板中,每组设0、1.25、2.5、5 mg/mL剂量组,2个复孔,每孔用2 mL培养液,培养24 h后,用不同浓度的前列宁胶囊处理,前列宁胶囊干预BPH-1细胞培养24 h,在倒置显微镜下观察细胞的形态变化并拍照。
2.3 RealtimePCR法检测大鼠前列腺组织中Caspase-3、Caspase-8、Fas、Bax、Bcl-2及BPH-1中Fas、Bax、Bcl-2基因表达取新鲜冻存前列腺组织和BPH-1细胞,Trizol法提取细胞总RNA,Nanodrop蛋白核酸分析仪检测RNA纯度和浓度。进行逆转录反应(反应体系20 μL),得到cDNA模板。取cDNA模板1 μL进行反应,反应总体积20 μL,反应体系包括2×SYBR GreenMaster Mix 10 μL,上游引物1 μL,下游引物1 μL,DEPC水7 μL,混匀。扩增条件为95℃预变性2 min(95℃变性15 s,57℃退火15 s,72℃延伸60 s,循环40次),引物见表1和表2。上机进行扩增,在每次循环延伸处收集荧光信号,分析整理数据。

表1 BPH-1细胞Fas、Bax、Bcl-2和GAPDH基因的引物序列

表2 大鼠Fas、Bax、Bcl-2、Caspase-3、Caspase-8、GAPDH基因的引物序列
2.4 比色法分析BPH-1细胞中Caspase-8、Caspase-3的活化BPH-1细胞按2×105个细胞/孔接种到6孔板中,每孔用2 mL培养液,培养24 h后,前列宁前囊高中低浓度处理24 h后的细胞,用裂解液在冰上放置30 min,裂解的细胞16 000 r/min离心10 min,100 μg的蛋白质加50 μL的Asp-Glu-Val-Asp(DEVD)-p-nitroaniline-pNA(caspase-3特异底物)或Leu-Glu-His-Asp-pNA(caspase-8特异底物),37℃避光反应2 h,用酶标仪检测样品在405 nm处的吸光度值。
2.5 检测BPH-1细胞中Fas、Bax、Bcl-2蛋白表达Western Blot法检测Bax的蛋白表达。BPH-1细胞按2×105个细胞/孔接种到6孔板中,每孔用2 mL培养液,培养24 h后,前列宁前囊高中低浓度处理24 h后的细胞,用裂解液抽提。含有等量蛋白的细胞裂解液用样品缓冲液溶解后,将细胞的蛋白样品定量,变性,进行聚丙烯酰胺凝胶电泳,转膜。脱脂牛奶封闭2 h;洗膜,加入Fas、Bax、Bcl-2(稀释倍数1∶1 000)的一抗以及β-actin(稀释倍数1∶1 000)作为阳性对照,4℃震荡过夜,加入辣根过氧化物酶标记的二抗(稀释倍数1∶25 000)后,室温孵育1 h,用含0.25%tween-20的TBS洗膜,加1∶1的ECL发光液,25℃温育5 min,立即曝光,等条带清晰后将胶片取出,用凝胶成像系统扫描并进行数据分析。2.6统计学方法实验数据用表示,用SPSS 12.0统计软件进行分析,组间比较用单因素方差分析,P<0.05为差异性具有统计学意义。
3 结果
3.1 前列宁胶囊对大鼠前列腺组织病理形态的影响正常组大鼠前列腺组织细胞腺上皮呈单层柱状,核椭圆形,腺体无扩张,间质无增生;模型组腺上皮呈假复层,细胞排列紧密,腺腔上皮增生呈多层,QC及保列治治疗组较模型组病变明显减轻,腺上皮呈单层柱状,核位于基底部,腺体数目明显减少,见图1。

图1 SD大鼠前列腺组织病理改变图(×100)
3.2 前列宁胶囊对SD大鼠前列腺组织中Fas、Caspase-8、Caspase-3、Bax、Bcl-2基因表达见表3。
表3 SD大鼠前列腺组织Fas、Caspase-8、Caspase-3、Bax、Bcl-2基因表达

表3 SD大鼠前列腺组织Fas、Caspase-8、Caspase-3、Bax、Bcl-2基因表达
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。
组别空白组模型组保列治组低剂量组中量组组高剂量组Bcl-2 1.0±0.1 3.1±0.51)1.6±0.32)2.4±0.22)1.6±0.42)1.3±0.42)Fas 4.0±1.1 2.0±0.41)3.7±0.82)2.9±0.22)3.6±0.42)3.7±0.42)Caspase-8 4.2±0.4 2.9±0.21)3.3±0.42)3.5±0.42)4.6±0.82)3.5±0.52)Caspase-3 4.8±0.8 2.3±0.51)2.6±0.32)2.5±0.8 4.5±0.62)4.0±0.22)Bax 1.0±0.2 0.5±0.11)0.8±0.22)0.6±0.1 0.9±0.22)1.1±0.22)

图2 高中低剂量前列宁胶囊干预BPH-1细胞倒置显微镜镜下改变图(×100)
3.3 前列宁胶囊对BPH-1细胞形态及细胞活力的影响见图2。图2所示,通过倒置显微镜可观察到细胞形态逐渐改变,细胞数逐渐减少,细胞多呈圆形,体积缩小,细胞悬浮,脱落而死亡,细胞完整性和数量下降。
3.4 前列宁胶囊对BPH-1细胞中Caspase-8、caspase-3活化影响见表4。
表4 QC干预BPH-1对Caspase-8和Caspase-3活化的影响

表4 QC干预BPH-1对Caspase-8和Caspase-3活化的影响
注:与0 mg/mL组比较,1)P<0.05。
组别0 mg/mL组1.25 mg/mL组2.5 mg/mL组5 mg/mL组Caspase-3 1.0±0.1 1.3±0.11)1.8±0.11)3.0±0.21)Caspase-8 1.0±0.2 1.1±0.3 1.4±0.21)1.6±0.41)
前列宁胶囊作用24 h后,BPH-1细胞中Caspase-8、caspase-3的活化,随着药物浓度的升高。
3.5 前列宁胶囊对BPH-1细胞Fas、Bax、Bcl-2基因及蛋白的影响见表5、图3。
表5 高中低剂量前列宁胶囊干预BPH-1对Fas、Bax、Bcl-2基因的影响

表5 高中低剂量前列宁胶囊干预BPH-1对Fas、Bax、Bcl-2基因的影响
注:与0 mg/mL组比较,1)P<0.05。
组别0 mg/mL组1.25 mg/mL组2.5 mg/mL组5 mg/mL组Bcl-2 1.0±0.41 0.6±0.071)0.3±0.121)1.5±0.341)Bax 1.0±0.04 1.5±0.221)1.6±0.121)1.8±0.231)Fas 1.0±0.62 1.0±0.231)1.5±0.341)1.7±0.571)
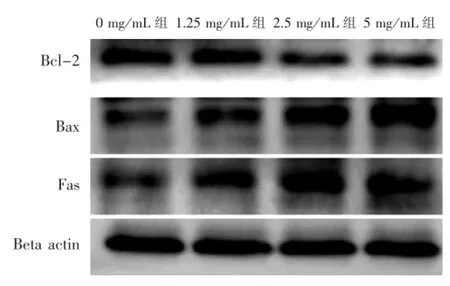
图3 高中低剂量前列宁胶囊干预BPH-1对Fas、Bax、Bcl-2蛋白影响的电泳图
4 讨论
4.1 细胞凋亡是遵循自身的程序,自己结束其生命的过程,这个过程中在一系列酶参与基因控制下,细胞有程序死亡。Caspase家族在细胞凋亡过程中发挥着重要作用,Caspase凋亡信号通路可通过外源性和内源性凋亡通路在TNF、Fas的启动剂诱导下,最终导致caspase-8活化,进一步使caspase-3活化,并引起随后的级联反应,最终导致细胞凋亡[5-10]。
4.2 在本实验中,用大鼠模型及BPH-1细胞培养,前列宁胶囊干预治疗,大鼠实验表明,正常组大鼠前列腺组织细胞腺上皮呈单层柱状,核椭圆形,位于基底部,腔内无或少许分泌物,腺体无扩张,间质无增生;模型组腺上皮呈假复层,细胞排列紧密,核位于基底部,腺腔上皮增生呈多层表明造模成功。前列宁胶囊及保列治治疗组较模型组病变明显减轻,腺上皮呈单层柱状,核位于基底部,腺体数目明显减少,表明前列宁胶囊对大鼠前列腺增生具有明显治疗作用。Real-time PCR检测各组大鼠前列腺组织中Fas、caspase-8、caspase-3、Bax、Bcl-2基因显示,前列宁胶囊治疗组中,Fas、caspase-8、caspase-3、Bax基因表达明显增强,并成量效关系,Bcl-2基因表达随前列宁胶囊浓度增加明显减弱,表明前列宁胶囊能促进BPH大鼠前列腺凋亡,并对caspase-3通路中相关因子有明显调控作用。前列宁胶囊干预BPH-1细胞培养显示,前列宁胶囊干预后倒置显微镜观察细胞活力明显降低,凋亡增多;比色法检测细胞中Caspase-8、Caspase-3活化增加,Realtime PCR及Westen-blot检测Fas、Bax基因、蛋白表达增强,Bcl-2基因、蛋白表达减弱,离体实验进一步验证前列宁胶囊治疗BPH可能是增强caspase-3活力,促进相关因子表达。
4.3 实验结果表明,前列宁胶囊对BPH具有明显治疗作用,其治疗机制是促进前列腺细胞凋亡,抑制其增殖。由于细胞凋亡受多种因子调控,本实验中前列宁胶囊可上调Fas、caspase-8、caspase-3含量,使Bax基因、蛋白表达增强,Bcl-2基因、蛋白表达减弱。总之,前列宁胶囊调控caspase-3促进细胞凋亡,是其治疗BPH的重要机制之一。
[1]JIANHENG ZHOU,JIUMAO LIN,ZHENFENG HONG,et al.Jun peng.Qianliening capsule treats benign prostatic hyperplasia through regulating the expression ofsex hormones,estrogen receptor and androgen receptor[J].African Journal of Pharmacy and Pharmacology,2012,6(3):173-180.
[2]XIAOYONG ZHONG,JIUMAO LIN,JIANHENG ZHOU,et al. Qianliening capsule treats benign prostatic hyperplasia(BPH)by down-regulating theexpression of PCNA,CyclinD1 and CDK4[J].African Journal of Biotechnology,2012,11(30):7731-7737.
[3]周建衡,林久茂,洪振丰,等.前列宁胶囊对BPH大鼠前列腺组织中IL-10 TNF-α的影响[J].中华中医药学刊,2010,28(12):2657-2569.
[4]林久茂,周建衡,钟晓勇,等.前列宁胶囊对BPH大鼠EGF及EGFR表达的的影响[J].福建中医药,2010,41(6):49-51.
[5]SUN Q,ZHONG W,ZHANG W,et al.Zinc deficiency mediates alcohol-induced apoptotic cell death in the liver of rats through activating ER and mitochondrial cell pathways[J].Lab Invest,2015,95:223-236.
[6]LONG F Y,CHEN Y S,ZHANG L,et al.Pennogenyl saponins induce cell cycle arrest and apoptosis in human hepatocellular careionma HepG2 cells[J].J Ethnopharmaco,2015,162:112-120.
[7]SEONG M K,LEE J Y,BYEON J,et al.Bcl-2 is a highly signifecant prognlstic marker of hormone-receptor-positive,human epidermal growth factor receptor-2-negative breastcancer[J]. Breast Cancer Res Treat,2015,150:141-148.
[8]BERGHAUSER PONT LM,SPOOR JK,VENKATESAN S,et al. The Bcl-2 inhibitor Obatlclax overcomes resistance to histone deacetylase inhibitors SAHA and LBH589 as radiosensitizers in patient-derived glilblastoma stem-like cells[J].Cenes Cancer,2014,5:445-459.
[9]CAI Y,ZOU Z,CHEN Y,et al.Bone marrow-derived mesenchymal stem cells inhibits hepatocyte apoptosis after acute liver injury[J].Int JClin Exp Pathol,2015,8:107-116.
[10]苏苗,俞腾飞,郭敏,等.肝细胞凋亡机制的研究进展[J].中国临床药理学杂志,2015,31(16):1684-1686.
R285.6
A
1000-338X(2017)01-0009-04
2016-10-26
国家自然科学基金资助课题(81373817,81273938),福建省自然科学基金资助课题(2015J01333)
周建衡(1968—),男,副教授,主要从事老年男性疾病的中西医结合基础研究。
洪振丰(1953—),男,教授。E-mail:zfHong1953@163.com

