巧用始末分析法 复杂问题简单化
陕西 赵 维
(作者单位:陕西省渭南高级中学)
巧用始末分析法 复杂问题简单化

在研究化学反应时,我们经常会见到多步反应。这类反应的一大特点就是分步反应中某一步的某些产物又作为另一反应的反应物参与下一步反应。传统的解方是一步一步分析,分割计算直至得出最终结果。但由于此类题目一般给出的量比较少,且多给起始量和终了量,中间分步反应的多个量可能需要大量数学运算才能获得,如果分析不到位或者不细心,很有可能出现少算、多算和漏算的情况,最终导致做了大量的分析计算,却得到了错误的结果,这会大大削弱学生学习的信心。对于此类题,如果我们能换个思路,既然分步分析复杂且效果不好,那我们就采取整体分析法,从反应的起始和终了状态来把握整个反应,运用守恒思想来处理。采用“始末分析法”,就可以把多步反应的复杂问题变得简单,使此类问题得到快速而准确地解决。
【高考速递】
(2016天津,7节选)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成(已推知为N、O),气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为 ________ ,生成的硫酸铜物质的量为________。
答案: NO 0.9 mol,NO21.3 mol; 2 mol
始末分析法解析:生成气体的相对分子质量小于50,可知生成的两种气体只能是NO和NO2, 设二者的物质的量分别为xmol和ymol,由质量守恒和电荷守恒可知:x+y=2.2 mol/L×1 L,由得失电子相等可知,3x+y=1×4,解得:x=0.9 mol,y=1.3 mol。生成硫酸铜的物质的量可采用始末分析法求解,n(Cu)×2=n(O2)×4,n(CuSO4)=n(Cu)=2 mol。
题型一:运用电子守恒的始末分析法
( )
A.1.6 g___________B.3.2 g___________C.6.4 g___________D.12.8 g
解析:本题反应过程如下:
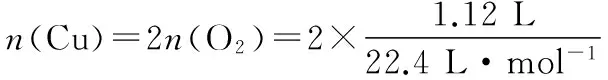
答案:C
典例2:取amol KMnO4固体加热一段时间后,收集到bmol单质气体M。在反应的残留固体中加入过量的浓盐酸加热充分反应,又收集到cmol单质气体N,Mn元素全部以Mn2+形式存在于反应后的溶液中,则b=___________ 。
解析:本题若分步解决,则涉及多个反应方程式,且量的关系均以字母形式表示,在分步解决过程中还应讨论字母的关系,过于麻烦。但通过分析我们可知:单个氧化还原反应得失电子相等,总反应过程得失电子也相等。因此,我们采用始末分析法,找始态和终态,用得失电子相等计算,省略中间过程,简化计算。

这些问题我们是解答不了的,因为除了按书本章节背了一些理论外,其他就不甚了了。巴克夏被问得支支吾吾,满头冒汗,求援似的望着我。我灵机一动,连忙遮掩:“大家问的都是关于农作物的疾病与虫害部分,将来会讲到的,现在暂不涉及——”
答案:b=1.25a-0.5c
【规律方法】典例1,2均是反应过程中发生多个氧化还原反应,分步分析,写方程式,分割求解均难以操作或很烦琐,对解题造成很大不便。但若能分析反应前后的始态和终态,根据始末状态物质化合价的变化,对整个反应过程运用得失电子相等列式,解题思路清晰明了,解题步骤少易操作,且耗时少但准确率高,收获的是事半功倍的效果。
题型二:运用质量守恒和电荷守恒的始末分析法
典例3:向一定量的Fe、FeO、Fe2O3混合物中加入1 mol·L-1的盐酸100 mL,恰好使混合物完全溶解,放出 0.01 mol 气体,向所得的溶液中加入硫氰化钾,无血红色出现,若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的质量为
( )
A.2.8 g___________B.5.6 g___________C.11.2 g___________D.22.4 g

如果直接按照反应步骤,分步求解混合物中各成分的含量,进而根据方程式求解被H2还原得到的Fe的质量,显然分析与计算量很大。观察反应流程可发现:起始混合物中所有的Fe元素最终都转移到了终态产物FeCl2溶液中,HCl中的Cl元素也全部转移到了FeCl2溶液中,这即是质量守恒思想,然后再结合电荷守恒2n(Fe2+)=n(Cl-)可得,n(铁元素)=0.5n(Cl-)=0.5n(HCl)=0.5c(HCl)·V(HCl)=0.5×1 mol·L-1×0.1 L=0.05 mol,所以还原得到的Fe的质量为m(Fe)=0.05 mol×56 g·mol-1=2.8 g。
答案:A
典例4:一定量的Fe和Fe2O3的混合物投入200 mL 2 mol·L-1的HNO3中,固体完全溶解后,生成0.1 mol NO(HNO3还原产物仅此一种)。再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素完全沉淀下来,加入NaOH溶液的体积最少是
( )
A.250 mL___________B.300 mL___________C.450 mL___________D.500 mL
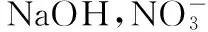
答案:B
典例5:现有19.7 g由Fe、FeO、Al、Al2O3组成的混合物,将它完全溶解在540 mL 2.00 mol·L-1的H2SO4溶液中,收集到标准状况下的气体8.96 L。已知混合物中,Fe、FeO、Al、Al2O3的质量分数分别为0.284、0.183、0.274和0.259。欲使溶液中的金属阳离子完全转化为氢氧化物沉淀,至少应加入2.70 mol·L-1的NaOH溶液体积是___________ 。

答案:800 mL
【规律方法】典例3,4,5均是在分析多步反应始态和终态的基础上应用质量守恒和电荷守恒来处理问题。任何化学反应都满足质量守恒定律,因此,质量守恒法是化学定量计算中必须高度重视的一种解题方法。在此基础上,我们再辅助电荷守恒关系,抓住反应过程中的不变量来列式求解,可以快速解决一些复杂的运算。
【总结】“始末分析法”实质就是守恒法。灵活运用质量守恒、得失电子相等以及电荷守恒去解决一些多步反应所涉及的计算问题,不仅可以避开复杂的反应过程,抓住问题核心直接分析,更重要的是可以将复杂问题简单处理,化难为易,化繁为简,提高解题效率。
综合训练
1.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与aL O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入bmol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积为___________ L(用a、b表示)。
2.ag Cu-Mg合金溶解在一定量的某浓度的稀HNO3中,收集到标准状况下bL NO气体(设HNO3还原产物只有NO),向反应后溶液中加入足量NaOH溶液,计算沉淀质量为___________ g(用a、b表示)。
答案及解析
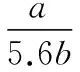

(作者单位:陕西省渭南高级中学)

