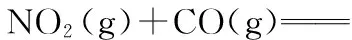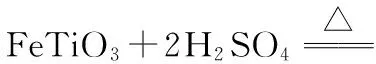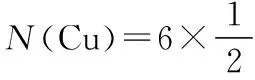高考化学模拟试题(二)
河北 蒋阔航
(作者单位:河北省衡水市武邑中学)
高考化学模拟试题(二)

一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法正确的是
( )
A.乙醇用作医用消毒剂时,无水乙醇消毒效果最好
B.高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理不同
C.公益调查《柴静雾霾调查:穹顶之下》发布,其中雾霾中的PM2.5属于胶体
D.用灼烧的方法可以区分蚕丝和人造纤维
2.若NA表示阿伏加德罗常数,下列说法正确的是
( )
A.Na2O和Na2O2的混合物共1 mol,阴离子数目在NA~2NA之间
B.常温常压下,92 g NO2和N2O4的混合气体中含有的分子数目为2NA
C.一定条件下,密闭容器充入1 mol N2和3 mol H2充分反应,转移电子的数目为6NA
D.FeCl3溶液中,若Fe3+数目为NA,则Cl-数目大于3NA
3.雌二醇的结构简式如下图,下列说法不正确的是
( )

A.能与Na、NaOH溶液、Na2CO3溶液反应
B.能发生加成反应、取代反应、消去反应
C.该分子中所有碳原子不可能在同一个平面内
D.可与FeCl3溶液发生显色反应,但不能发生氧化反应
4. 全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极。电池工作原理如图所示,下列说法不正确的是
( )

A.充电过程中,N电极附近酸性减弱
B.充电过程中,N电极上V3+被还原为V2+
C.放电过程中,H+由N电极向M电极移动
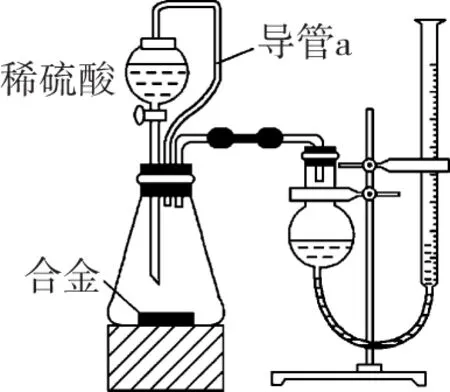
5.下列实验设计能达到相应实验目的的是

( )
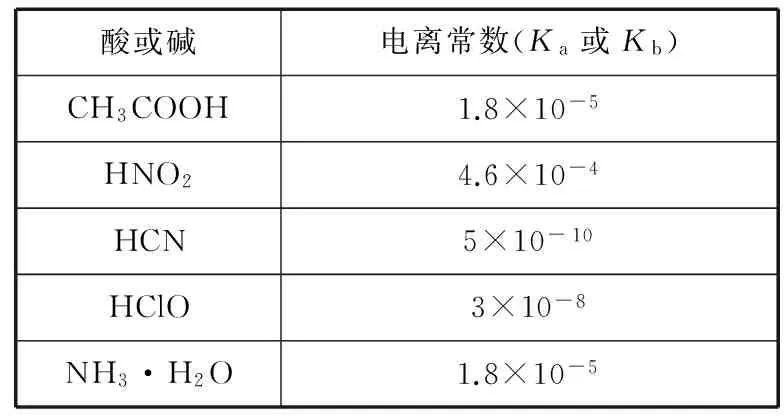
6. 常温下,用0.10 mol·L-1NaOH溶液分别滴定 20.00 mL 浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
( )
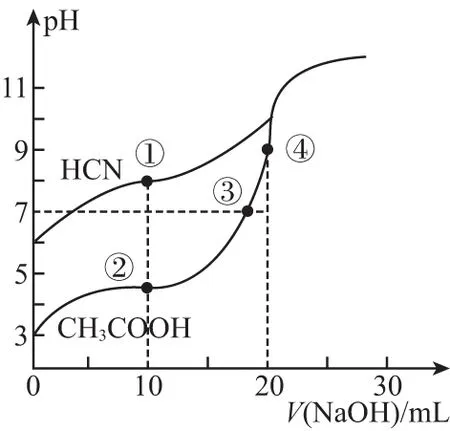
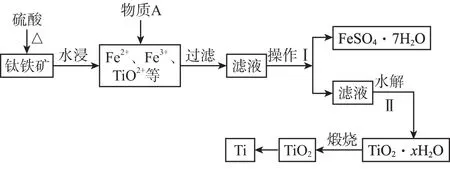
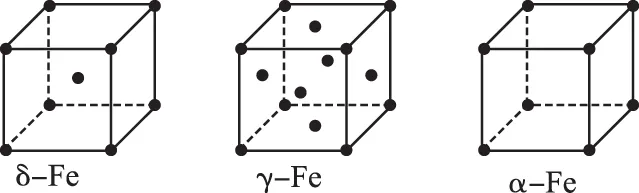
A.点①和点②所示溶液中:c(CH3COO-) B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) ①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲; ②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体; ③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3 g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是 ( ) B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ D.原溶液一定存在Cl- 二、必考题:本题共3小题,共43分。 8.(14分)铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白: 【方案一】 【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是___________。 【实验步骤】 (1) 称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol/L的NaOH溶液中,充分反应。 则NaOH溶液的体积V≥___________ mL。 (2) 过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将___________ (填“偏高”“偏低”或“无影响”)。 【方案二】 【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。 【实验步骤】 (1) 同学们拟选用下列实验装置完成实验: 你认为最简易的装置其连接顺序是A→( )→( ) →( ) →( ) →( )(填接口字母,可不填满)。 (2) 仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差: 稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。 ① 装置中导管a的作用是___________。 ② 实验中将碱式滴定管改装成量气管,且实验前后量气管中液面读数分别为V1mL、V2mL,则产生氢气的体积为___________ mL。 ③ 若需确定产生氢气的物质的量,还需测定的数据是___________ 。 9.(15分)Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要的作用。请回答下列问题: (1) 如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________。 T/℃200300400KK1K20.5 ①试比较K1、K2的大小:K1___________ (填“>”“=”或“<”)K2。 ②下列各项能作为判断该反应达到化学平衡状态的依据的是___________ (填字母)。 a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v正(N2)=3v逆(H2) c.容器内压强保持不变 d.混合气体的密度保持不变 ③ 在400 ℃时,当测得NH3和N2、H2的物质的量分别为1 mol 和2 mol、3 mol 时,该反应的v正(N2) ___________ (填“>”“=”或“<”)v逆(N2)。 Ⅱ.描述弱电解质电离情况可以用电离度和电离常数,下表是常温下几种弱酸的电离常数(Ka)和弱碱的电离常数(Kb)。 酸或碱电离常数(Ka或Kb)CH3COOH1.8×10-5HNO24.6×10-4HCN5×10-10HClO3×10-8NH3·H2O1.8×10-5 (1)上述四种酸中,酸性最弱的是________________(用化学式表示)。 下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是___________ (填字母)。 A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 (2) CH3COONH4的水溶液呈___________ (填“酸性”“中性”或“碱性”),理由是________________ ,溶液中各离子浓度大小的关系是___________。 10.(14分)钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示: (1)钛铁矿的主要成分与硫酸反应的化学方程式为___________________________ 。 (2)加入的物质A为________ 。 (3)步骤Ⅱ中发生反应的离子方程式为________________ ;水解过程中需要升高温度,其目的是①加快反应水解速率; ②________________。 (4)若把制得的固体TiO2·xH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。 (5) 由TiO2获得金属Ti可用以下两种方法。 ①电解法:以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为________________。 ②热还原法:首先将TiO2、氯气和过量焦炭混合,高温反应生成TiCl4;然后用Mg还原TiCl4即可制取Ti。生成TiCl4的反应中,氧化剂与还原剂的物质的量之比为___________ ;生成Ti的反应需在Ar气氛中,其原因为___________。 三、选做题:共15分。请考生从给出的两道化学题中任选一题作答,多答则按所答的第一题计分。 11.【化学—选修:物质结构与性质】(15分) (1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题: ①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点FeO___________ (填“<”或“>”)NiO。 ②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为___________ 。 (2) 元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___________ ;该晶体中,原子之间的强相互作用是___________。 (3) 某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。 ① 用A、B、O表示这类特殊晶体的化学式:___________。 ② 已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为___________ 。 ③下列有关说法正确的是___________ 。 A.镧、锰、氧分别位于周期表f、d、p区 B.氧的第一电离能比氮的第一电离能大 C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强 D.铬的堆积方式与钾相同,则其堆积方式如图2所示 12.【化学—选修:有机化学基础】(15分) 芳香族化合物X是一种天然食用香料,可以从某些植物中提取。X能发生下列转化: 已知:①A的核磁共振氢谱有6个峰;②H为酯类结构,结构中除苯环外还含有一个六元环;③G的产量是衡量一个国家石油化工发展水平的标志。 请回答下列问题: (1)反应①~⑥中,属于加成反应的是___________ (填序号)。③的反应条件是___________ 。 (2)反应①的化学方程式为________________ 。检验A中非含氧官能团所用的试剂为___________ 。 (3)D的结构简式为________ 。 (4)F的同分异构体中,遇FeCl3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为___________ 种,写出所有的同分异构体结构简式:________________。 参考答案及解析 1.D 【解析】医用酒精为70%~75%乙醇溶液,利于杀菌;而在高浓度时(如95%),由于乙醇使细菌表面迅速脱水,会形成一层保护膜,不利于完全杀菌,故A错误;高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同,都是因为其具有强的氧化性,故B错误;胶体粒子直径介于1 nm到100 nm之间,胶体粒子直径是小于1微米,雾霾中PM2.5是很多1微米到2.5微米之间的微粒,不是胶体,故C错误;蚕丝的主要成分是蛋白质,蛋白质在灼烧时会产生烧焦羽毛的气味,人造纤维在灼烧时会蜷缩成一个小球,有浓烈的黑烟,有与蛋白质灼烧的不一样的气味,故可以区别蚕丝和人造纤维,D正确。 3.D 【解析】该物质含有醇羟基、酚羟基,可以与Na发生反应产生氢气;含有酚羟基,可以与NaOH溶液、Na2CO3溶液反应,A正确。该物质含有苯环,能发生加成反应;含有酚羟基,所以可以发生取代反应;由于醇羟基连接的碳原子的邻位碳原子上含有H原子,所以可以发生消去反应,B正确。该物质含有饱和碳原子,由于饱和碳原子是四面体结构,所以该分子中所有碳原子不可能在同一个平面内,C正确。由于物质分子中含有酚羟基,所以可与FeCl3溶液发生显色反应,也能发生氧化反应,绝大部分有机物都可以燃烧,所以D错误。 6.C 【解析】A项,①点为CH3COOH和CH3COONa的1∶1溶液,溶液显酸性c(H+)>c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),可得c(CH3COO-)>c(Na+)>c(H+)>c(OH-);②点为HCN和NaCN的1∶1溶液,溶液显碱性,可得c(Na+)>c(CN-)>c(OH-)>c(H+);所以溶液中CH3COO-大于CN-,故A错;B项,点③所示溶液中为中性,氢离子和氢氧根离子浓度相等,故B错误;C项,根据物料守恒:c(CH3COO-)+c(CH3COOH)=c(HCN)+c(CN-),故C正确;D项,根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故D错误。 8.(14分,除标注外,每空2分) (1)97 (2)偏高 【方案二】(1)E D G (共2分) (2)①平衡压强 ②(V1-V2) ③实验时的温度和压强 9.(15分,除标注外,每空2分) (2)①> ②c ③> Ⅱ.(1)HCN (1分) B (1分) 10.(14分,除标注外,每空2分) (2) Fe (或铁) (1分) (4) 2.79×103 ②1∶1 防止高温下Mg(或Ti)与空气中的O2(或CO2、N2)反应 (1分) 11.(15分,除标注外,每空2分) (1)①< ②4∶3 (2)3∶1 金属键 (3)①ABO3②(1-x)∶x(3分) ③AC 12.(15分,除标注外,每空2分) (1)② 浓硫酸、170℃ (作者单位:河北省衡水市武邑中学) 趣味阅读 诺贝尔化学奖趣闻(二) 化学奖与女性——从1901年到2013年,获得诺贝尔化学奖的女性共有4位,人数虽不占优,但成就独一无二。她们是:法国科学家居里夫人,因研究放射性元素在化学和医学上的应用并分离出纯的金属钋、镭,于1911年获奖;法国科学家伊伦·约里奥·居里,因发现人工放射性,于1935年获奖;英国科学家多罗西·克劳福特·霍奇金,因用X射线衍射方法研究青霉素和维生素B12等分子结构取得成功,于1964年获奖;以色列科学家阿达·约纳特,因核糖体的结构和功能的研究,于2009年获奖。 梅开二度——化学界的大拿非弗雷德里克·桑格莫属,他曾于1958年和1980年两次折桂。另外还有两位跨界高手:居里夫人,继1903年获得物理学奖之后,又于1911年摘取化学奖;美国化学奖莱纳斯·鲍林,分别将1954年的化学奖和1962年的和平奖两枚奖牌纳入囊中。 得奖一家亲——居里一家是当之无愧的“诺贝尔奖之家”:4人、3次获奖。1903年,玛丽·居里和皮埃尔·居里共同获得物理学领域的最高荣誉;8年之后的1911年,居里夫人摘得化学奖桂冠;1935年,他们的大女儿伊雷 娜·约里奥·居里和其夫弗雷德里克·约里奥,又戴上了属于自己的化学奖奖牌。有意思的是,小女儿艾芙·居里的夫婿亨利·拉布伊斯,在1965年以联合国儿童基金会(UNICEF)总干事的身份代表儿基会领取了诺贝尔和平奖。 父子在各自的研究领域均有建树并分别获得诺贝尔奖殊荣的例子还有:1929年诺贝尔化学奖得主、瑞典生物化学家汉斯·冯·奥伊勒·切尔平,其子乌尔夫·冯·奥伊勒是1970年生理学或医学奖得主;1959年生理学或医学奖获得者、美国科学家阿瑟·科恩伯格,其子罗杰·D·科恩伯格于2006年捧得诺贝尔化学奖 被迫弃奖——历史上曾有3位来自德国的诺贝尔奖获得者被迫弃奖,分别是1938年化学奖得主理查德·库恩、1939年化学奖得主阿道夫·布特南特和1939年生理学或医学奖得主格哈德·多马克,当时阿道夫·希特勒阻挠了他们领奖。后来诺贝尔奖委员会为他们补发了奖章和证书,但是没有奖金。 (摘自网络,有删改)