18F-ML-10监测多柔比星诱发心脏毒性的可行性探讨
黄世明,陈 薇,张锦明,马永强,岳建兰,李彦峰,林志春
18F-ML-10监测多柔比星诱发心脏毒性的可行性探讨
黄世明1,陈 薇1,张锦明2,马永强3,岳建兰1,李彦峰1,林志春1
目的 探讨放射性核素凋亡显像剂18F-ML-10无创监测多柔比星诱发心脏毒性的可行性。方法 36只KM小鼠随机分为对照组、低剂量(15 mg/kg)多柔比星模型组和高剂量(20 mg/kg)多柔比星模型组,每组12只。对照组腹腔注射生理盐水,多柔比星模型组腹腔注射一定剂量的多柔比星,48 h后进行小动物超声检测左室射血分数 (left ventricular ejection fraction, LVEF),以及放射性显像剂18F-ML-10与18F-FDG在小鼠体内的生物分布并测定每克组织放射性摄取值(%ID/g),处死的小鼠取出心脏进行caspase 3免疫组化检测心肌细胞的凋亡情况。结果 超声结果显示低剂量组[LVEF=(59.49±5.32)%]与高剂量组LVEF=(52.41±6.47)%小鼠左室射血分数明显低于对照组LVEF=(70.58±5.06)%,18F-FDG在低剂量组(%ID/g=21.67±3.69)与高剂量组(%ID/g=15.58±1.92)的摄取也明显低于对照组(%ID/g=36.18±3.65),而凋亡显像剂18F-ML-10在低剂量组(%ID/g=0.50±0.11)与高剂量组(%ID/g=1.100.55)的摄取明显明显高于对照组(%ID/g=0.02±0.02),差异均有统计学意义(P<0.05),caspase 3免疫组化显示模型组心肌细胞发生明显凋亡,与18F-ML-10在心脏的摄取相一致。结论 心肌细胞的凋亡是多柔比星诱导心脏毒性的重要途径,特异性凋亡显像剂18F-ML-10用于多柔比星诱发心肌细胞凋亡的毒性监测具有较好的应用前景。
多柔比星;心脏毒性;凋亡;18F-ML-10
多柔比星是蒽环霉素类使用最广泛的药物之一,属于广谱抗肿瘤药物,是多种肿瘤标准化疗方案的一线药物,主要针对乳腺癌、淋巴瘤和白血病等其他肿瘤[1, 2]。多柔比星可诱发严重的心脏毒性反应,常见的有心肌缺血、心肌梗死、心律失常、心衰(最严重)等,这种毒性作用具有累积性和剂量依赖性,从而影响其临床使用[3]。多柔比星诱发心脏毒性主要通过DNA损伤、抑制DNA复制与蛋白合成、促进肌纤维退化、抑制特定基因转录等多种途径,最终经caspase 3途径诱发心肌细胞发生凋亡,导致心脏收缩功能的降低与左心室重塑,从而出现相应的临床症状[4]。18F-ML-10是Aposense家族中的一种小分子示踪剂,经人体试验证实,是一种非常安全、有效的凋亡示踪剂[5, 6],18F-ML-10与凋亡细胞的结合与caspases的激活等凋亡变化呈正相关,具有高特异性与灵敏性[7]。本研究拟通过研究凋亡显像剂18F-ML-10在小鼠体内分布,以探讨特异性凋亡显像剂18F-ML-10用于多柔比星诱发心肌凋亡毒性监测的可行性。
1 材料与方法
1.1 实验材料 (1)实验动物:36只6~8周雄性昆明(KM)小鼠,体重20~25 g(北京维通利华实验动物技术有限公司)。饲养于SPF级环境中,温度22~25 ℃,相对湿度40%~70%,照明12 h。(2)实验试剂与耗材:多柔比星(PHR1789,sigma)、5%水合氯醛、anti-casepase 3抗体(ab44976,abcom)、DAB显色试剂盒(ZLI-9032,北京中衫金桥医药公司)、通用型SP检测试剂盒(SP-9000,北京中衫金桥医药公司),18F-ML-10、18F-FDG(解放军总医院合成提供)。小动物超声(Visual Sonics view 2100);井型γ探测仪(FT-603型,北京261厂);荧光显微镜(Nikon Eclipse 80i)。
1.2 实验方法 36只KM小鼠随机分为3组,正常对照组、低剂量组、高剂量组,每组12只。适应性喂养1周后进行实验。正常对照组腹腔注射生理盐水,正常喂养,低剂量多柔比星模型组腹腔注射多柔比星(溶于生理盐水)15 mg/kg,高剂量多柔比星模型组腹腔注射多柔比星(溶于生理盐水)20 mg/kg,48 h后进行下一步实验。
1.2.1 小鼠动物超声 多柔比星注射48 h后,进行小动物超声,检测小鼠心功能变化,选用MS550心脏超声探头,频率40 MHz,超声切面选择为胸骨旁左心室短轴切面获得M型超声图像。超声检测指标包括左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、室间隔厚度(IVS)、左室后壁厚度(LVPWT)及心率,根据容量公式V=[7.0/(2.4+D)]×D3,计算左室舒张末期容积(LVEDV)和收缩末期容积(LVESV),左室射血分数(left ventricular ejection fraction,LVEF)=(LVEDV-LVESV)/LVEDV×100%[8]。
1.2.218F-ML-10在KM小鼠体内分布 48 h后,各组随机取6只KM小鼠,通过尾静脉注射0.2 ml(100 μG)18F-ML-10,给药60 min后处死,先取小鼠的血、心、肝、脾、肺、肾、骨和肌肉分别称重,在自动定标器上进行γ射线放射性计数,减去背景放射性计数,根据放射性显像剂的注射时间进行放射性校正,然后计算每克组织放射性摄取率(%ID/g)。
1.2.318F-FDG在KM小鼠体内分布 各组48 h后取剩余6只KM小鼠,通过尾静脉注射0.2 ml(100 uG)18F-FDG,其余步骤与测定18F -ML-10在KM小鼠的体内分布相同,最后计算每克组织放射性摄取率(%ID/g)。
1.2.4 caspase 3免疫组化凋亡检测 上述小鼠心脏测定完放射性计数后,将心脏放于新配制的4%多聚甲醛中固定24 h,而后蔗糖脱水,将心脏做连续短轴切片,迅速将切片贴于明胶预处理的载玻片上,晾干后置于-20 ℃冰箱中待用。
将各组小鼠心脏相同切片部位进行caspase 3免疫组化检测。具体步骤: 3% H2O2孵育10 min, PBS洗3 min×3次,0.3%TritonX-100 孵育10min, PBS 洗3 min×3 次,滴加封闭用正常山羊血清工作液孵育15 min,直接去封闭液滴加兔抗鼠的caspase 3 一抗放入湿盒中4 ℃孵育过夜。第2天从4 ℃中取出湿盒于室温中复温30 min,PBS 洗3 min×3 次,滴加生物素化二抗工作液37 ℃孵育15 min,PBS 洗3 min×3 次,滴加辣根酶标记链霉卵白素工作液37 ℃孵育15 min, PBS 洗3 min×3 次,而后DAB 显色。自来水冲洗,苏木素复染6 min,盐酸乙醇分化10 s,流水冲洗反蓝10 min,依次在梯度乙醇中脱水,二甲苯透明后封片显微镜下观察心肌细胞凋亡染色变化。
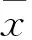
2 结 果
2.1 超声结果 对照组左室射血分数为(70.58±5.06)%,低剂量组48 h后左室射血分数为(59.49±5.32)%,明显低于对照组,差异有统计学意义(P<0.05),高剂量组左室射血分数为(52.41±6.47)%,明显低于对照组与低剂量组,差异有统计学意义(P<0.05,图1、2)。

图1 各组KM小鼠超声心动图检测心脏短轴M-Mode

图2 多柔比星注射48 h后各组KM小鼠左室
2.2 放射性显像剂体内分布18F-ML-10在对照组与实验组KM小鼠体内生物分布见表1,18F-FDG在小鼠体内的生物分布见表2。特异性凋亡显像剂18F-ML-10注射60 min后,相比于对照组(%ID/g =0.02±0.02),18F-ML-10在低剂量组(%ID/g=0.50±0.11)与高剂量组(%ID/g=1.10±0.55)的心脏毒性动物模型中均有明显摄取(P<0.05),高剂量组比低剂量组的放射性摄取增加更明显(P<0.05)。而糖代谢显像剂18F-FDG在低剂量组(%ID/g=21.67±3.69)与高剂量组(%ID/g=15.58±1.92)的心脏毒性动物模型中的摄取均明显低于对照组(%ID/g=36.18±3.65)(P<0.05),高剂量组相比于低剂量组的18F-FDG放射性摄取降低更明显(P<0.05)。
2.3 心肌细胞Caspase 3凋亡检测 Caspase 3是凋亡过程中非常重要的执行分子,Caspase3酶原被激活后,裂解相应的胞浆胞核底物,最终导致细胞的凋亡,其免疫组织化学染色结果显示:高剂量组caspase 3 抗体染色颜色最深,染色区域最大,低剂量组次之,而对照组染色为阴性(图3)。

表1 18F-ML-10在KM小鼠体内的分布 (n=6;
注:与正常对照组比比较,①P<0.05;与低剂量组比较,②P<0.05

表2 18F-FDG在KM小鼠体内的分布 (n=6;
注:与对照组比比较,①P<0.05;与低剂量组(15mg/kg)比较,②P<0.05
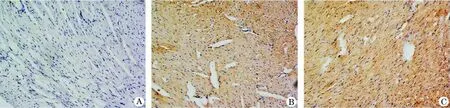
图3 KM小鼠腹腔注射多柔比星诱发急性心脏损伤48 h后心肌细胞的凋亡变化(caspase 3免疫组化染色,×200)
3 讨 论
多柔比星一旦诱发心室功能障碍,预后极差,因此迫切需要一种有效、无创、实时、动态的早期监测心脏毒性的方法,以利于早期使用心脏保护药[9],或及时调整肿瘤治疗方案预防心衰同时避免抗肿瘤治疗中断,从而最大限度的降低心脏毒性风险提高患者生存质量并改善预后[10]。目前,对于心脏毒性的监测方法有多种,包括组织活检、血液标志物检测、超声心动图显像等。心肌内膜活检反应心脏毒性的敏感性较高,但并不能反应心肌受损的严重程度和范围,因有创、滞后、不能反复检测等原因限制了其在临床上的应用。蒽环霉素治疗可诱发肌钙蛋白的升高,但一系列研究并没有证明肌钙蛋白的升高与蒽环霉素类药物的注射量具有明显的相关性[11]。超声测定左室射血分数是目前临床上普遍接受的检测方法,甚至作为临床的标准,但LVEF只能是作为心脏功能受损严重程度的评估,当组织活检或其他生化指标已经显示心肌受损时,心肌可能因代偿作用而使LVEF没发生明显的变化,因此LVEF的下降不能用于早期监测心脏毒性的风险[12]。
导致心肌细胞凋亡是多柔比星诱发心脏毒性的重要机制之一,可导致心功能异常,早期监测心肌细胞的凋亡可及早调整化疗药物并尽早使用心脏保护剂。目前已有一些凋亡显像探针用于心脏毒性监测的研究,包括Annexin-V、18F-CP18,不同的凋亡显像剂靶向结合于凋亡的不同过程,然而目前仍没有常规用于临床PET显像的凋亡显像剂[13, 14],18F-ML-10已用于人体显像。临床试验表明,对人体安全、无副作用,体内分布稳定,剂量浓度与生物分布均较适宜能够特异性的与凋亡细胞结合显像[15]。
本研究利用多柔比星单次高剂量注射到KM小鼠体内,小动物超声检测观察到低剂量组与高剂量组小鼠心脏射血分数均明显降低,与对照组比较,分别降低了15.7%与25.7%,表明小鼠心脏功能受损,多柔比星对小鼠心脏会产生较明显的毒性作用。同时,糖代谢显像剂18F-FDG在模型组心脏的分布明显降低,表明多柔比星药物诱发心脏毒性时,在急性期会导致心肌细胞糖代谢水平的下降,糖代谢供能降低。而凋亡显像剂18F-ML-10在对照组小鼠心脏的分布(%ID/g =0.02±0.02)接近于本底,本研究结果表明,正常心肌细胞几乎不摄取,而模型组心脏的放射性分布明显的增加,同时caspase 3免疫组化检测显示对照组未发生明显的凋亡,而模型组心肌细胞发生明显的凋亡,验证了心肌细胞的凋亡作用是多柔比星诱导心脏毒性重要途径之一,表明18F-ML-10能够有效地与多柔比星诱发的心肌凋亡细胞结合。
综上所述,心肌细胞的凋亡是多柔比星诱发心脏毒性的重要作用途径,18F-ML-10能够特异性的与凋亡心肌细胞结合,有望成为无创监测多柔比星诱发心脏毒性的凋亡显像剂。
[1] Jean S R, Tulumello D V, Riganti C,etal. Mitochondrial Targeting of Doxorubicin Eliminates Nuclear Effects Associated with Cardiotoxicity[J]. ACS Chem Biol, 2015, 10(9):2007-2015.
[2] 王雅婧, 刘德权, 叶剑桥. 多西他赛与表柔比星联合或序贯化疗治疗局部晚期乳腺癌临床观察[J]. 武警医学, 2014, 25(09):921-923.
[3] Yancy C W, Jessup M, Bozkurt B,etal. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2013, 62(16):e147-239.
[4] Cao Y, Ruan Y, Shen T,etal. Astragalus polysaccharide suppresses doxorubicin-induced cardiotoxicity by regulating the PI3k/Akt and p38MAPK pathways[J]. Oxid Med Cell Longev, 2014, 2014:674219.
[5] Hoglund J, Shirvan A, Antoni G,etal.18F-ML-10, a PET tracer for apoptosis: first human study[J]. J Nucl Med, 2011, 52(5):720-725.
[6] Oborski M J, Laymon C M, Lieberman F S,etal. First use of (18)F-labeled ML-10 PET to assess apoptosis change in a newly diagnosed glioblastoma multiforme patient before and early after therapy[J]. Brain Behav, 2014, 4(2):312-315.
[7] Hyafil F, Tran-Dinh A, Burg S,etal. Detection of Apoptotic Cells in a Rabbit Model with Atherosclerosis-Like Lesions Using the Positron Emission Tomography Radiotracer[18F]ML-10[J]. Mol Imaging, 2015, 14:433-442.
[8] Gardin J M, Siri F M, Kitsis R N,etal. Echocardiographic assessment of left ventricular mass and systolic function in mice[J]. Circ Res, 1995, 76(5):907-914.
[9] Kalam K and Marwick T H. Role of cardioprotective therapy for prevention of cardiotoxicity with chemotherapy: a systematic review and meta-analysis[J]. Eur J Cancer, 2013, 49(13):2900-2909.
[10] Curigliano G, Cardinale D, Dent S,etal. Cardiotoxicity of anticancer treatments: Epidemiology, detection, and management[J]. CA Cancer J Clin, 2016, 66(4):309-325.
[11] Dodos F, Halbsguth T, Erdmann E,etal. Usefulness of myocardial performance index and biochemical markers for early detection of anthracycline-induced cardiotoxicity in adults[J]. Clin Res Cardiol, 2008, 97(5):318-326.
[12] Ewer M S ,Lenihan D J. Left ventricular ejection fraction and cardiotoxicity: is our ear really to the ground?[J]. J Clin Oncol, 2008, 26(8):1201-1203.
[13] Su H, Gorodny N, Gomez L F,etal. Noninvasive molecular imaging of apoptosis in a mouse model of anthracycline-induced cardiotoxicity[J]. Circ Cardiovasc Imaging, 2015, 8(2):e001952.
[14] Panjrath G S, Patel V, Valdiviezo C I,etal. Potentiation of Doxorubicin cardiotoxicity by iron loading in a rodent model[J]. J Am Coll Cardiol, 2007, 49(25):2457-2464.
[15] Allen A M, Ben-Ami M, Reshef A,etal. Assessment of response of brain metastases to radiotherapy by PET imaging of apoptosis with (1)(8)F-ML-10[J]. Eur J Nucl Med Mol Imaging, 2012, 39(9):1400-1408.
(2016-08-11收稿 2017-02-01修回)
(责任编辑 郭 青)
Feasibility of using18F-ML-10 to monitor cardiotoxicity induced by doxorubicin
HUANG Shiming1,CHEN Wei1,ZHANG Jinming2,MA Yongqiang3,YUE Jianlan1,LI Yanfeng1, and LIN Zhichun1.
1.Department of Nuclear Medicine, Affiliated Hospital of Logistics University of Chinese People’s Armed Police Force, Tianjin 300162, China;2. Department of Nuclear Medicine, the PLA General Hospital, Beijing 100853, China; 3. Tianjin Key Laboratory of Cardiovascular Remodeling and Target Organ Injury Institute of Cardiovascular Disease and Heart Center, Tianjin 300162,China
Objective To investigate the feasibility of noninvasive monitoring of doxorubicin-induced cardiotoxicity by radionuclide apoptosis imaging agent18F-ML-10.Methods Thirty-six KM mice were randomly and equally divided into control group, low dose (15 mg / kg) model group and high dose (20 mg/kg) model group. The mice in control group were injected with normal saline. Doxorubicin was injected into model group at some dose. After 48 hours, mice were subjected to cardiac ultrasonography and the biodistribution of18F-FDG and18F-ML-10 was determined with gamma counting. The mice were sacrificed to remove the heart for caspase 3 immunohistochemical detection of myocardial cell apoptosis.Results The left ventricular ejection fraction was significantly lower in low dose group (LVEF=59.49±5.32%) and high dose group (LVEF=52.41±6.47%) than that in control group (LVEF=70.58±5.06%), but the uptake of18F-FDG in low dose group (%ID/g=0.50±0.11) and high dose group (%ID/g=15.58±1.92) was significantly lower than that in control group (%ID/g=36.18±3.65).The uptake of apoptotic imaging agent18F-ML-10 in low dose group (%ID/g=0.50±0.11) and high dose group(%ID/g=1.10±0.55)was significantly higher than that in control group (%ID/g=0.02±0.02) (P<0.05). Caspase 3 immunohistochemistry showed obvious apoptosis of myocardial cells in model group, which was consistent with the uptake of18F-ML-10 in the heart.Conclusions Apoptosis is an important pathway for doxorubicin-induced cardiotoxicity.18F-ML-10 may contribute to the detection of doxorubicin-induced myocardial apoptosis.
doxorubicin; cardiotoxicity; apoptosis;18F-ML-10
天津市自然科学基金资助项目(13JCYBJC22000),武警后勤学院附属医院种子基金资助项目(FYQ201601)
黄世明,在读硕士研究生。
1.300162 天津,武警后勤学院附属医院核医学科;2.100853 北京,中国人民解放军总医院核医学科;3.300162,天津市心血管重塑与靶器官损伤重点实验室
林志春,E-mail: zhichunlin@163.com.
R817

