泡菜中植物乳杆菌的鉴定及其发酵液抑菌活性研究
全永亮
(山东商务职业学院,山东烟台 264670)
泡菜中植物乳杆菌的鉴定及其发酵液抑菌活性研究
全永亮
(山东商务职业学院,山东烟台 264670)
从山东烟台家庭自制泡菜中分离得到1株产抑菌物质的乳酸菌菌株。综合菌株的形态学特征、生理生化特征和16SrDNA序列分析,鉴定该菌为植物乳杆菌并命名为LactobacillusplantarumQYL-1。该菌株发酵上清液对短小芽孢杆菌(CMCC 63202)、金黄色葡萄球菌(ATCC 25923)、藤黄微球菌(CMCC 28001)、大肠杆菌(ATCC 25922)等有较好的抑菌作用,其中对大肠杆菌(ATCC 25922)的抑菌性最强,表现出广谱抑菌活性。研究对于纯种发酵及乳酸菌的抑菌活性,具有一定的启发和借鉴价值。
泡菜;植物乳杆菌;抑菌活性
植物乳杆菌是乳酸菌的一种,厌氧或者兼性厌氧,杆状,同型发酵,广泛分布于自然界中,特别是发酵蔬菜中,比如LactobacillusplantarumKLDS1.0391[1],LactobacillusplantarumLB-B1[2]。某些植物乳杆菌产生的细菌素能抑制病原微生物、腐败性细菌的生长繁殖,在食品添加剂、饲料添加剂、医药等方面均有较好的应用前景。烟台气候温和,气温变幅较小,独特的理环境孕育了丰富的微生物菌群。笔者从烟台家庭自制泡菜中,分离筛选广谱抑菌的乳酸菌,并对其产抑菌物质进行研究,以期得到生产纯菌乳酸菌发酵剂以及乳酸菌细菌素。
1 材料与方法
1.1 试验材料
1.1.1 菌种与培养基
泡菜:山东烟台家庭自制;实验菌:本实验室从泡菜中分离得到1株有抑菌效果的植物乳杆菌菌株;指示菌:短小芽孢杆菌(CMCC 63202)、蜡样芽孢杆菌(AS 1.1846)、金黄色葡萄球菌(ATCC 25923)、藤黄微球菌(CMCC 28001)、荧光假单胞菌(AS 3.6452)、大肠杆菌(ATCC 25922)6株菌株。
MRS培养基;乳酸菌分离培养基:MRS培养基的基础上添加0.3%CaCO3。
指示菌培养基(NA);PY基础培养基,PYG培养基:PY培养基基础上添加10g葡萄糖。
精氨酸产氨培养基,葡萄糖/葡萄糖酸盐产酸产气培养基:PY培养基基础上添加30g葡萄糖和0.5mL吐温80;碳水化合物发酵产酸培养基:PY培养基基础上分别添加一种碳水化合物;产硫化氢培养基。
1.1.2 主要试剂
BTB-MR试剂:溴百里酚蓝(BTB)0.2g,甲基红(MR)0.1g,95%乙醇300mL,蒸馏水200mL。
革兰氏染色试剂盒产自杭州百思生物技术有限公司,细菌基因组提取试剂盒(Bacterial DNA Kit(200),OMEGA),引物序列为16SF:5'-AGAGTTTGATCCTGGCTCAG-3'(P1);16SR:5'-CTACGGCTACCTTGTTACGA-3'(P2),TaqTMDNA聚合酶(TaKaRa),Gel Extraction Kit(TaKaRa),菌株DNA提取试剂盒:上海生物工程有限公司;化学试剂:均为分析纯。
1.1.3 仪器与设备
YXQ.SG41.280手提式压力蒸汽灭菌锅,TOMYSX-700全自动高压灭菌,SW-CJ-IBU超净工作台,RE-6000旋转蒸发仪,BCD-215YD海尔冰箱,Orion 3STAR pH计,PYX-DHS-50X65隔水式电热恒温培养箱。
1.2 实验方法
1.2.1 乳酸菌的分离纯化及保存
在无菌操作台上,将泡菜与汁液混合均匀,用已灭菌过的生理盐水,按照10倍稀释法处理,选取10-4,10-5,10-6的稀释浓度,分别涂布于MRS固体培养基,于30℃条件下培养2~3天;挑取单菌落,在乳酸菌分离培养基平板上,于30℃条件下培养2~3天;继续观察培养基,反复划线筛选,挑取单菌落;将其转移到MRS斜面上,做好标记,于4℃条件下保存。
1.2.2 乳酸菌的鉴定
形态学鉴定:参照微生物学实验[4]进行,镜检、糖发酵等生理生化试验参考乳酸菌-生物学基础及应用[5]进行。
接触酶试验,乳酸菌属过氧化氢酶阴性;菌株精氨酸产氨试验;菌株葡萄糖和葡萄糖酸盐产酸产气试验;菌株产硫化氢能力检测参考试验[6]进行;菌株碳水化合物发酵试验,用BTB-MR指示剂检测发酵液,观察颜色反应。
1.2.3 总DNA制备、PCR反应扩增、16SrDNA与序列分析、同源性比较
保藏的菌株接种于MRS液体培养基30℃静置培养14h活化后,按照细菌基因组提取试剂盒[Bacterial DNA Kit(200),OMEGA]操作说明提取细菌总DNA。
16SrDNA分子鉴定,选用细菌基因组DNA提取试剂盒,PCR扩增引物,循环30次;72℃终延伸10min,4℃保存,并对其产物进行序列测定。
PCR产物琼脂糖凝胶电泳观察,利用TaKaRa公司Gel Extraction Kit试剂盒割胶回收,由金斯瑞生物科技有限公司(南京)测序,测序结果在NCBI上的GeneBank序列数据库进行BLAST分析,在非重复的GeneBank+EMBI+PDB基因库中进行同源性比较。
1.2.4 发酵上清液的抑菌试验
1.2.4.1 乳酸菌的产酸曲线与生长曲线的测定
将经活化的乳酸菌,接入液体MRS培养基中,于30℃条件下静置培养,用分光光度计,选取波长600nm,每隔3h测定液体培养基的吸光度值(OD值),同时并用pH计每隔3h测定1次pH值,连续测定54h,以不接种的液体MRS培养基作对照,以pH值和OD值分别为纵坐标,培养时间为横坐标,绘制乳酸菌的产酸曲线与生长曲线。
1.2.4.2 上清液的抑菌试验
取经过12h培养活化的乳酸菌菌株3~5环接种于10mL灭菌的MRS液体培养基中,30℃条件下培养24h,取此培养液1mL接入100mL已灭菌的MRS液体培养基中,30℃条件下培养48h,将发酵液装入发酵液测定离心管,于4℃,在10000r/min下离心5min,获得上清液。对本实验室保存的6株指示菌株进行抑菌试验。打孔器公称内径为6mm,故抑菌圈直径大于6mm的视为具有抑菌性。同时用pH值4.5的乳酸和生理盐水作对照。
1.2.4.3 上清液调节pH值后的抑菌试验
发酵液离心步骤同1.2.4.2,为提高效果,采用旋转蒸发仪将上清液浓缩2倍,以短小芽孢杆菌(CMCC 63202)为指示菌,分别将上清液pH值调到4.5,5.0,5.5,用pH值为4.5的乳酸作对照。
2 结果与分析
2.1 菌落形态及个体形态
经过初筛、复筛,挑选出1株抗菌作用强的菌株,该实验菌划线接种于MRS培养基,30℃培养48h,观察该实验菌的菌落形态为圆形,呈白色,中间略有隆起,表面光滑,边缘整齐,不透明,见图1。
革兰氏染色结果显示为革兰氏阳性菌,呈杆状或棒形,多数成对出现,见图2。
图2 革兰氏染色Fig.2Gram staining
进一步进行芽孢染色和鞭毛染色实验,发现实验菌不生芽孢,无鞭毛,不运动,这一特征与革兰氏阳性、兼性厌氧杆菌的特征描述一致,从形态学特征判断该株菌符合乳酸杆菌属特征分离出乳酸菌的特性,见表1。

表1 分离出乳酸菌的特性Table 1The characteristics of isolated strains
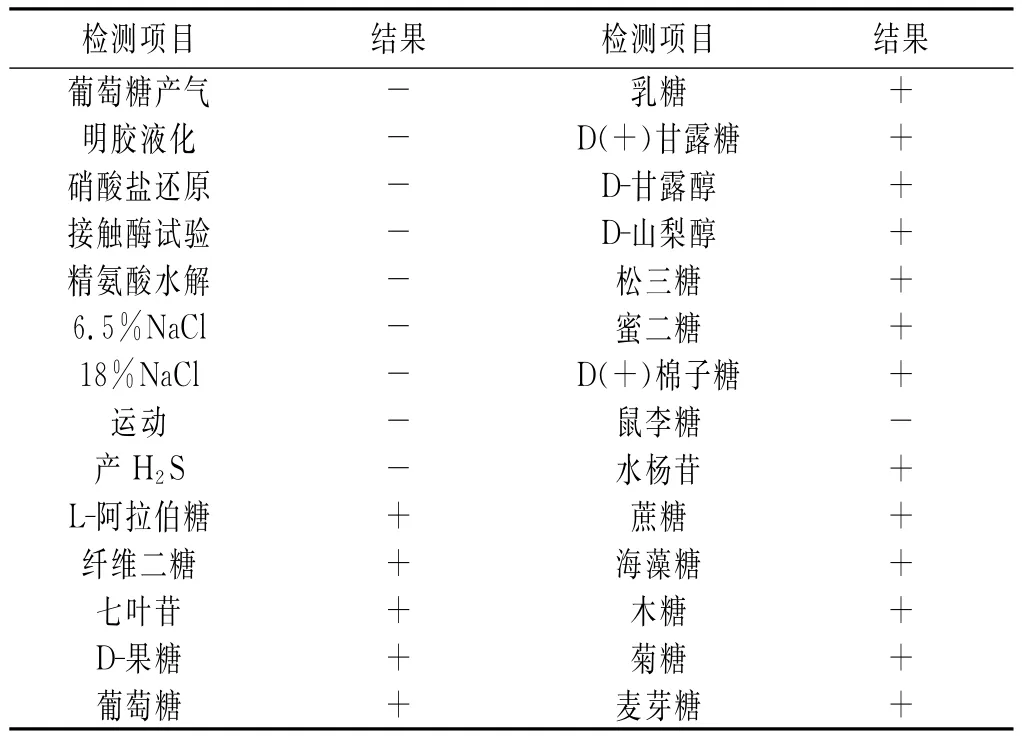
表2 实验菌的生理生化特征及糖发酵试验结果Table 2Physiological and biochemical properties and sugar fermentation results of tested lactic acid bacteria
根据《伯杰氏系统细菌学手册》[7]及《乳酸细菌分类鉴定及实验方法》[8],该实验菌的一系列生理生化实验表明,过氧化氢酶试验为阴性,不产气,不产H2S,不液化明胶,产酸,耐酸,能在40℃条件下生长,发酵葡萄糖产酸不产气,不能水解精氨酸,无精氨酸水解酶,能利用乳糖发酵产酸,但不能利用鼠李糖产酸,结合表1和表2,这些生理生化反应与常见细菌鉴定手册可以初步鉴定该株菌为乳酸杆菌属(Lactobacillus)乳酸菌。
2.2 乳酸菌的产酸曲线与生长曲线的测定
实验菌的生长曲线和产酸曲线见图3,该菌株的延滞期相对较长,约为9h左右,说明其对环境适应能力不是太强。在菌株进入平衡期后,可以大量产酸,产酸能力较强,使发酵液的酸度急剧下降至pH值3.82,可以防止有害菌的繁殖。
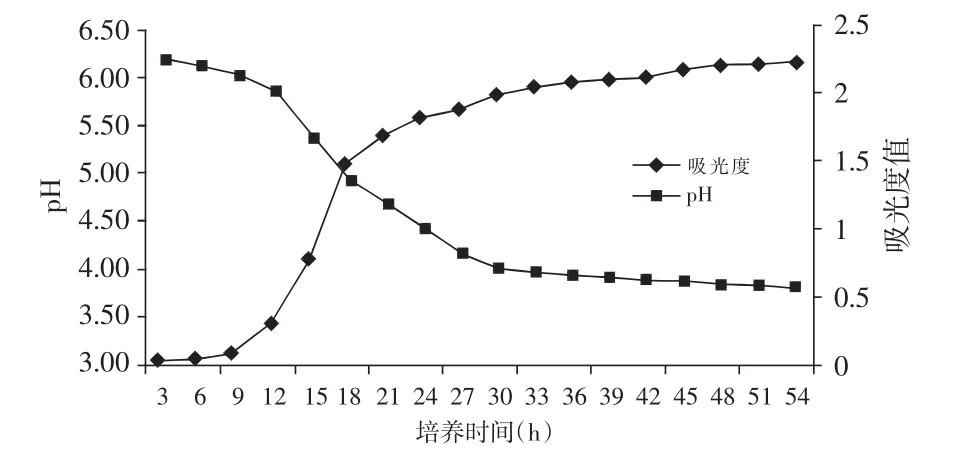
图3 乳酸菌的产酸曲线与生长曲线Fig.3The curves of growth and acid-producing of the strain
2.3 16SrDNA扩增、序列测定与构建系统发育树
16SrDNA鉴定是目前被最常用来作为细菌鉴定的方法[9-11]。以该实验菌株的总DNA为模板,以细菌16SrDNA通用引物进行PCR扩增,得到约1300bp的扩增产物,经对扩增产物测序,并将所测定的序列从GenBank数据库中进行Blast分析后发现,该实验菌株扩增产物与植物乳杆菌亚种的菌株NR_075041.1,NR_104573.1,NR_117813.1等5株菌相似性高达100%,而与其他菌株NR_113338.1,NR_115605.1,NR_025447.1等10株菌种序列相似性则均在99%,对Blast结果中该菌株的89个近缘种群进行构建系统发育树分析,将实验菌株命名为LactobacillusplantarumQYL-1,见图4,结果表明:其可归属于植物乳杆菌,且与植物乳酸杆菌亚种更为接近。
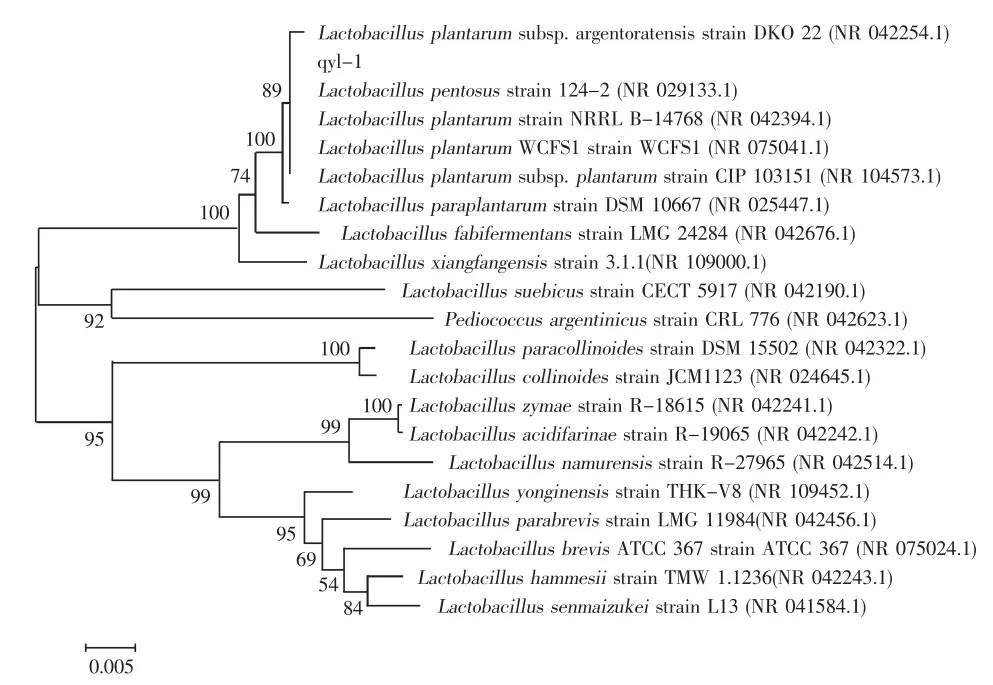
图4 植物乳杆菌QYL-1系统发育树Fig.4The phylogenetic tree ofLactobacillusplantarumQYL-1
2.4 上清液的抑菌试验
通过对6种指示菌的抑菌实验可以看出,菌株LactobacillusplantarumQYL-1对短小芽孢杆菌(CMCC 63202)、金黄色葡萄球菌(ATCC 25923)、藤黄微球菌(CMCC 28001)、大肠杆菌(ATCC 25922)4株指示菌的抑菌效果较好,均超过孔径的2倍,而其中对大肠杆菌(ATCC 25922)的抑菌性最强,抑菌圈直径达到18.38mm,达到打孔器直径的3倍,见图5。而对荧光假单胞菌(AS 3.6452),蜡样芽孢杆菌(AS 1.1846)的抑菌效果相对较差,仅仅在8mm左右。本抑菌测试结果表明该细菌素具有较广的抗菌谱。
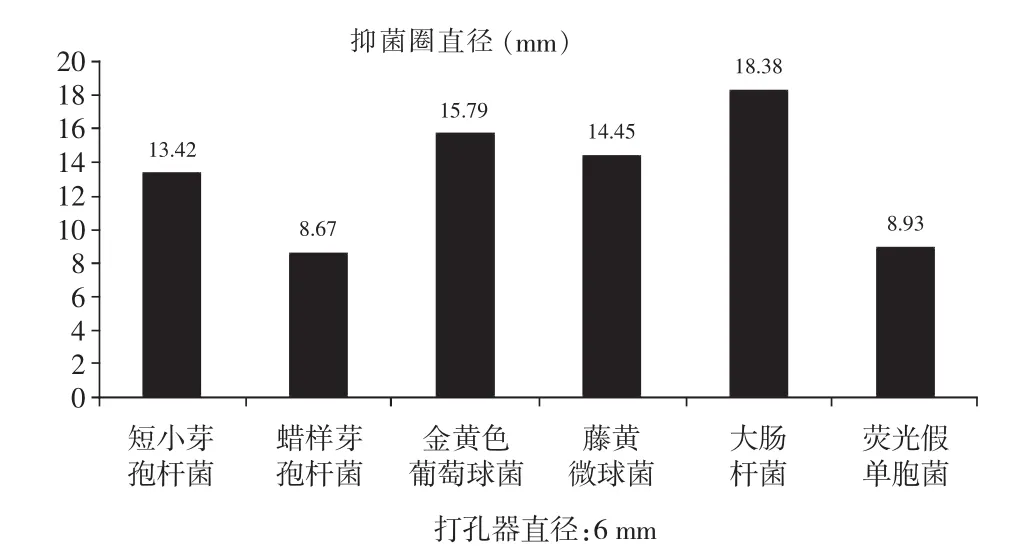
图5 上清液抑菌圈大小Fig.5The size of supernate inhibition zone
2.5 上清液调节pH值后的抑菌试验
将菌株LactobacillusplantarumQYL-1发酵上清液浓缩2倍,以此浓缩液分别调整出3个不同的pH值,以短小芽孢杆菌为指示菌做抑菌实验,由图6可知,浓缩液pH值调整至4.5,其抑菌效果降低24.56%;pH值调整至5.0,其抑菌效果降低45.69%,下降明显,pH值调整至5.5,其抑菌效果降低64.01%,下降最明显,说明该菌株培养的上清液在酸性较强的环境中抑菌效果更好。
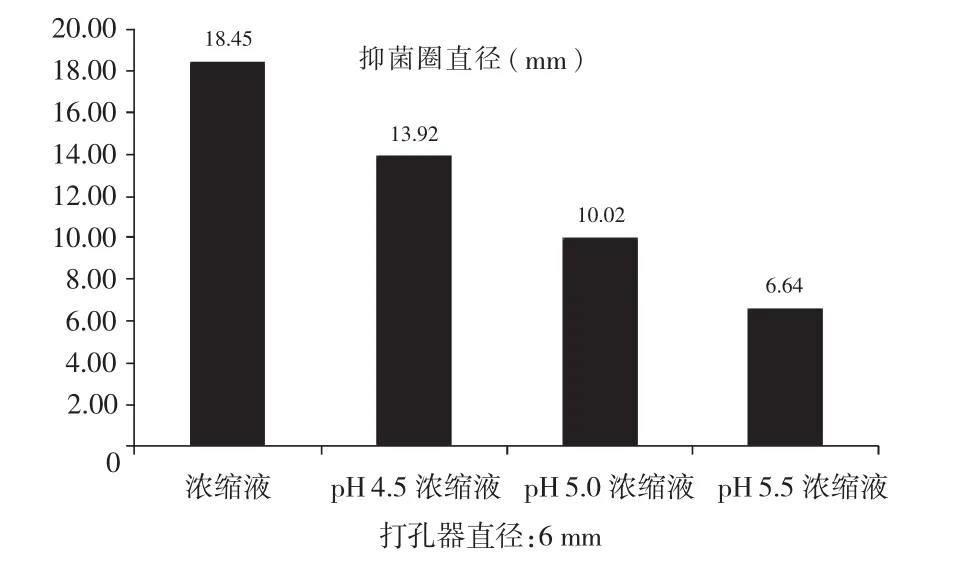
图6 调整pH值后抑菌圈大小Fig.6The size of supernate inhibition zone after adjusting pH values
3 结论与讨论
许多乳酸菌在生长代谢过程中,会产生乳酸、乙酸等有机酸和过氧化氢,此外还能产生多种具有抑菌或杀菌生物活性的细菌素(bacteriocin),在抑制多种病原微生物和食物腐败菌等方面具有重要的作用[12]。本研究从泡菜中分离得到1株优良乳酸菌,并对其生理生化特性及抑菌特性进行研究,运用16SrDNA鉴定,在www.ncbi.nlm.nlh.gov网站中通过BLAST,在GENBANK+EMBL+DDBJ+PDB基因库中进行同源性搜索,鉴定出实验菌株为植物乳杆菌,将该实验菌株命名为LactobacillusplantarumQYL-1,并且利用mega5构建出该菌株的系统进化树。生长曲线和产酸曲线测定试验结果显示:菌株Lactobacillus plantarumQYL-1具有较强的产酸能力,但其发酵延迟期较长,产酸能力较强。抑菌试验显示其发酵上清液能对短小芽孢杆菌(CMCC 63202)、蜡样芽孢杆菌(AS 1.1846)、金黄色葡萄球菌(ATCC 25923)、藤黄微球菌(CMCC 28001)、荧光假单胞菌(AS 3.6452)、大肠杆菌(ATCC 25922)6株菌株,均有较好的抑菌活性,但具体抑菌物质还需深入研究确定。该研究结果对于纯种发酵以及乳酸菌的开发应用具有一定的启发和借鉴价值。
[1]Gong H S,Meng X C,Wang H.Plantaricin MG active against Gram-negative bacteria produced byLactobacillus plantarumKLDS1.0391isolated from"Jiaoke",a traditional fermented cream from China[J].Food Control,2010,21(1):89-96.
[2]Xie Y,An H,Hao Y,et al.Characterization of an anti-Listeria bacteriocin produced byLactobacillusplantarumLB-B1isolated from koumiss,a traditionally fermented dairy product from China[J].Food Control,2011,22(7):1027-1031.
[3]Hammami R,Zouhir A,Hamida J B,et al.Bactibase:a new web-accessible database for bacteriocin characterization[J].BMC Microbiology,2007,7(1):89.
[4]沈萍,范秀荣,李光武.微生物学实验[M].北京:高等教育出版社,1999.
[5]杨洁彬,郭兴华,张篪,等.乳酸菌——生物学基础及应用[M].北京:中国轻工业出版社,1996.
[6]Hu M,Zhao H,Zhang C,et al.Purification and characterization of plantaricin 163,a novel bacteriocin produced byLactobacillus plantarum163isolated from traditional Chinese fermented vegetables[J].Journal of Agricultural and Food Chemistry,2013,61(47):11676-11682.
[7]Metchnikoff E.The prolongation of life[M].New York:A.P.Putnam's Sons,1907.
[8]Campbell-Platt G.Fermented foods—a world perspective[J].Food Research International,1994,27(3):253-257.
[9]焦振泉,刘秀梅.细菌分类与鉴定的新热点:16S-23SrDNA间区[J].微生物学通报,2001,58(28):1.
[10]刘文强,贾玉萍,赵宏坤.16SrRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2007,27(11):15-18.
[11]杨霞,陈陆,王川庆.16SrRNA基因序列分析技术在细菌分类中应用的研究进展[J].西北农林科技大学学报(自然科学版),2008,36(2):55-60.
[12]朱文淼,刘稳.乳酸菌细菌素的研究动向[J].生物技术,1999(6):32-36.
Study on the Identification ofLactobacillusplantarumand Antimicrobial Activity of the Pickled Vegetable
QUAN Yong-liang
(Shandong Business Institute,Yantai 264670,China)
The bacteriocin-producing strain is isolated from Yantai home-made pickled vegetable.Through the morphological observation,physiological and biochemical characteristics and sequencing of 16SrDNA,the strain is identified to be a gram-positiveLactobacillusplantarumQYL-1.The results of antimicrobial test show that the supernatant could effectively inhibit the growth ofBacilluspumilus(CMCC 63202),Staphylococcusaureus(ATCC 25923),Micrococcusluteus(CMCC 28001)andEscherichiacoli(ATCC 25922),which indicates that it has broad-spectrum antibiotic activity.Therefore,the result could provide the reference value for development and application of the fermentation and antimicrobial activity of lactic acid bacteria.
pickled vegetable;Lactobacillusplantarum;antimicrobial activity
TS255.54
A
10.3969/j.issn.1000-9973.2017.03.015
1000-9973(2017)03-0064-05
2016-09-13
山东省高等学校青年骨干教师国内访问学者项目
全永亮(1977-),男,山东菏泽人,副教授,硕士,研究方向:食品微生物。

