条件性噪声听觉保护作用的频率特异性及耳蜗形态学研究
陶源 聂国辉 胡洪义 琚良艳 宋为明
噪声这一常见的环境污染影响着人们的健康。噪声性听觉损伤(noise induced hearing loss,NIHL)是一种典型的强噪声导致的感音神经性耳聋。提前暴露于中等水平的声刺激一定时间,可以显著减少其后由于高强度声刺激引起的永久性阈移[1~3],此为条件性噪声保护作用,第一次是由Canlon等[4]提出,以后在多种哺乳动物乃至人类在研究中被涉及。如毛丝鼠[5],豚鼠[6,7]等。不同的研究目的会选择不同频率的噪声。Canlon[4]等人选择了1 kHz,Campo等[8]使用0.5 kHz,Subramaniam[9]等人公布了4 kHz的结果。目前对于条件性噪声频率特异性未有肯定的研究。为了研究条件性噪声保护作用的频率特异性,笔者观察不同频率声音刺激的条件性噪声是否具有保护作用。此外,通过耳蜗基底膜铺片荧光染色进行形态学观察,为进一步的分析提供依据。
1 材料与方法
1.1 实验动物
本实验使用32只重250~300克的雌性白毛红目豚鼠。动物实验协议由北京大学深圳医院伦理委员会通过。
1.2 分组与噪声暴露
豚鼠被随机分成8组(每组4只),命名为A、B、C、D、E1、E2、E3和E4组。A~D组分别暴露于4 kHz 85 dB SPL的噪声10小时(A组),4 kHz 105 dB SPL的噪声10小时(B组),0.5 kHz 85 dB SPL的噪声10小时(C组),0.5 kHz 105 dB SPL的噪声10小时(D组)。另外,为了进行交叉对照,E1~E4组分别给予较低水平的条件性噪声(85 dB SPL,0.5 kHz或4 kHz,10小时)。它们在实验过程中被放置在2 m×2 m×2 m的静音室(<25 dB A)中。详细的噪声暴露过程如表1所示。

表1 各组噪声暴露过程
每组的4只豚鼠在静音室中同时暴露于音频设备(Yamaha MSP7 Studio,印度尼西亚)发出的噪声。在实验过程中豚鼠拥有充足的水和食物。
1.3 听阈测量
1.3.1 ASSR 使用ASSR测量每组噪声暴露前后的听觉阈值。ASSR发生在连续多频声音刺激听觉系统时。由于刺激是幅度调制信号,它可以提供高强度和高超的频率特征。
1.3.2 听力监听 用ASSR对所有豚鼠双耳在任何处理之前(基线阈值)和噪声暴露后的听觉阈值进行测评。所有组在最后噪声暴露20小时后进行ASSR测量以确认临时阈值变动(temporarg threshold shift,TTS)的恢复。豚鼠用20%的乌拉坦(氨基甲酸乙酯,1.5 g/kg,腹腔注射)进行麻醉,针电极放置在测量耳下面(参考极),鼻根(地极)和两个耳朵之间的头皮(记录极)。在监测过程中,刺激的强度从-10 dB SPL~130 dB SPL,步长5 dB SPL。
1.3.3 统计学分析 采用Origin 9.0用于平均值、标准差和方差等数值分析。数据采用单因子方差分析方法,P<0.05被认为具有统计学意义。
1.4 耳蜗基底膜铺片及形态学观察
1.4.1 手术过程 豚鼠在乌拉坦腹腔注射麻醉后,断头法处死,取出并打开听泡,蜗尖用尖针钻孔,镫骨推入前庭窗,4%多聚甲醛(PFA)灌注,以上步骤在3分钟内完成,4% PFA室温固定2小时或4℃ 8小时,10% EDTA 4℃过夜脱钙,0.01 MPBS(PH7.4)内浸泡剥离基底膜,按底回,二回,三回,顶回取下基底膜[9,10]。
1.4.2 Hoechst免疫荧光染色 将剥下之标本在培养皿中加入4%PFA,常温下再次固定2小时,取固定处理好豚鼠耳蜗基底膜放于60 mm细胞培养皿中,用PH7.4生理浓度PBS缓冲液清洗(5 min×3次,摇床40转速缓摇)。吸出PBS后,使用Hoechst(Hoechst 33342,Life Technologies,USA)进行染色。取Hoechst:PBS=1:2000(20 ml配10 μg)稀释染核3min,吸出,用PH 7.4生理浓度PBS清洗3次,每次5 min。取出耳蜗基底膜组织放置于载玻片上,滴加25 ul封片剂,分清正反后将螺旋器这面朝上用盖玻片封片,注意不要有气泡,在组织湿润的条件下封片。最后使用莱卡荧光显微镜(Leica DM400B/DFC480),蓝光激发340~380 nm下观察。
2 结果
2.1 不同噪声暴露下整体听力损伤
对比噪声暴露前后的平均听觉阈值变化见图1,表2。
实验动物整体听阈提高大约25.5 dB SPL,左耳26.9 dB SPL,右耳24.1 dB SPL,每组前后对比方差分析(P<0.05)。
2.2 听觉损伤与保护作用的频率特异性
2.2.1 单次噪声暴露 A~D组,单次噪声暴露的各频率听阈变化,见图2。
表3中对比A、B两组,除1 kHz频率外,对于0.5 kHz、2 kHz和4 kHz,B组造成的听阈变化明显高于A组(0.5 kHz,P=0.000<0.05;1 kHz,P=0.049<0.05;2 kHz,P=0.003<0.05;4 kHz,P=0.000<0.05;整体,P=0.000<0.05)。4 kHz噪声对所有频率都造成了更大的听阈位移,尤其在105 dB SPL时。B组如图2所示,4 kHz的听阈频率产生了59.3 dB SPL的位移(左耳52.5dB SPL,右耳66 dB SPL)。
对比C、D两组,通过方差分析,两组造成的听阈变化并不明显(0.5 kHz,P=0.280;1 kHz,P=0.600;2 kHz,P=0.180;4 kHz,P=0.340;整体,P=0.060)。
2.2.2 条件性噪声的噪声暴露 如图3所示,E1和B组两组整体平均听阈变化差异有统计学意义,P=0.000<0.05。
表4中E1与E2组两者听阈差别无明显统计学意义(P=0.050)。对于0.5 kHz、1 kHz,P值分别为0.080、0.150,均不具备统计学意义。然而,对于2 kHz、4kHz,E2、E1的听阈变化有统计学意义(P=0.000<0.05)
D组和E2组两者听阈变化不具统计学意义,P=0.590。
D组和E4组的听阈变化对比无统计学意义(D组14.3 dB SPL,E4组12.5 dB SPL,P=0.160>0.05)。
E3组和D组,D组阈值变化大约为14.3 dB SPL(左耳15.4 dB,右耳13.2 dB SPL),E3组达到34.2 dB SPL(左耳38.9 dB SPL,右耳29.5 dB SPL),差异具有统计意义(P=0.000<0.05)。
对比A组与B组,4 kHz 105 dB SPL造成的听阈变化明显大于85 dB SPL(A组18.4 dB,B组42.5 dB,P=0.000<0.05)。对比C组和D组,0.5 kHz 105 dB SPL噪声比85 dB导致更多的移位,对于所有频率约3.1分贝。然而,105 dB SPL和85 dB SPL 0.5 kHz的噪音对于2 kHz和4 kHz频率听阈的影响并未表现出显著不同,见表5。
2.3 耳蜗基底膜铺片染色
耳蜗基底膜铺片染色处理结果可分为三种类型:基本正常、部分受损和严重损坏,见图4。
基本正常的耳蜗内、外毛细胞结构排列整齐,见于各组豚鼠接受刺激前。部分受损的耳蜗内、外毛细胞排列不规则,核肿胀(黑色箭头),部分细胞损失(白色箭头),见于C、E4组。严重受损的耳蜗出现核肿胀(黑色箭头)和核溶解(红色箭头),以及部分细胞损失(白色箭头),见于B组。

图1 给予特定噪声dB SPL暴露处理前后平均听阈变化(±SD)
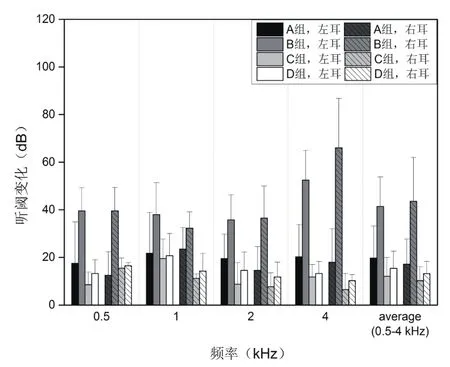
图2 A~D组噪声暴露后的听阈变化(±SD dB SPL),左耳右耳分别进行展示

表2 给予特定噪声暴露处理前后平均听阈变化(x± SD)(,dB SPL)
3 讨论
ASSR相较于同样具有频率特性的频率特异性ABR(tone burst auditory brainstem response,tbABR)来说,具有客观检查,客观判断的特点,减少了人为干预的误差,在低频区域的测试更有着明显优势,临床应用相对成熟,因此被用于本次研究中对豚鼠的听阈进行客观测量[11]。Subramaniam[12]研究了在噪声习服中,低水平的声音与低频刺激不能掩蔽高频噪音。但基于Canlon等人和Campo等人的结论,Subramaniam认为低频噪声可能刺激了耳蜗的更大范围的耳蜗,所以拥有更大的保护作用[4,8,13]。
表3 A~D组每个频率的听阈变化(±SD.dB SPL)

表3 A~D组每个频率的听阈变化(±SD.dB SPL)
组别 样本数量 0.5 kHz 1 kHz 2 kHz 4 kHz 平均值 (0.5~4 kHz)左耳 右耳 左耳 右耳 左耳 右耳 左耳 右耳 左耳 右耳A 4 17.5±17.4 12.5±9.8 21.8±17.2 23.5±9.0 19.5±10.2 14.5±10.0 20.3±13.5 18.0±14.0 19.8±13.4 17.1±10.6 B 4 39.5±9.7 39.5±9.8 38.0±13.4 32.3±6.8 35.8±10.5 36.5±13.5 52.5±12.4 66.0±20.8 41.4±12.4 43.6±18.4 C 4 8.5±5.3 15.5±4.2 19.5±8.3 11.3±1.7 8.8±9.0 7.8±5.7 11.8±5.3 6.5±6.8 12.1±7.9 10.3±5.7 D 4 13.3±5.7 16.5±1.3 20.8±9.3 14.3±7.4 14.5±7.7 11.8±6.2 13.3±5.1 10.3±2.5 15.4±7.1 13.2±5.1
表4 E1~E4组每个频率的平均听阈变化(±SD.dB SPL)
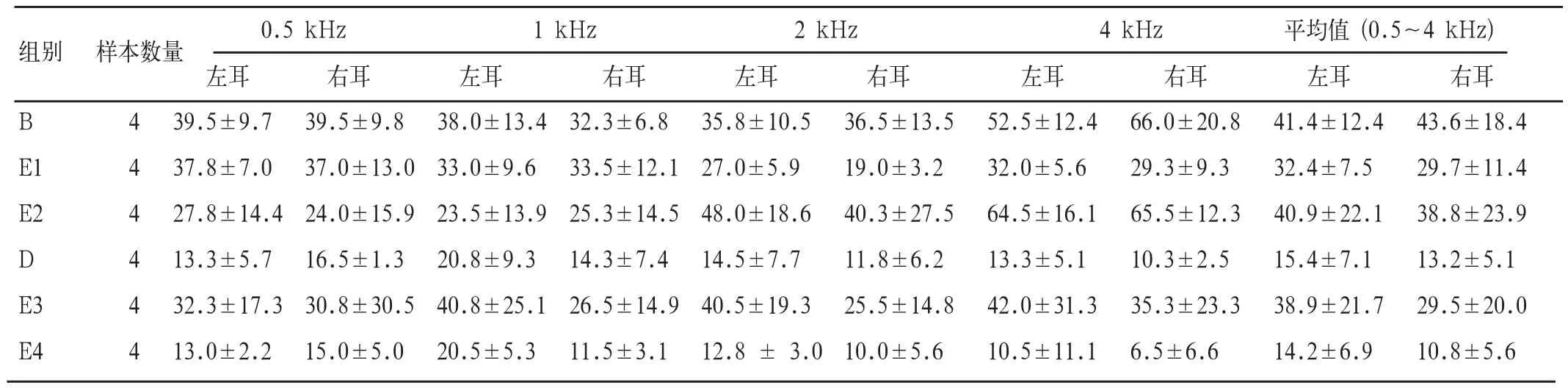
表4 E1~E4组每个频率的平均听阈变化(±SD.dB SPL)
组别 样本数量 0.5 kHz 1 kHz 2 kHz 4 kHz 平均值 (0.5~4 kHz)左耳 右耳 左耳 右耳 左耳 右耳 左耳 右耳 左耳 右耳B 4 39.5±9.7 39.5±9.8 38.0±13.4 32.3±6.8 35.8±10.5 36.5±13.5 52.5±12.4 66.0±20.8 41.4±12.4 43.6±18.4 E1 4 37.8±7.0 37.0±13.0 33.0±9.6 33.5±12.1 27.0±5.9 19.0±3.2 32.0±5.6 29.3±9.3 32.4±7.5 29.7±11.4 E2 4 27.8±14.4 24.0±15.9 23.5±13.9 25.3±14.5 48.0±18.6 40.3±27.5 64.5±16.1 65.5±12.3 40.9±22.1 38.8±23.9 D 4 13.3±5.7 16.5±1.3 20.8±9.3 14.3±7.4 14.5±7.7 11.8±6.2 13.3±5.1 10.3±2.5 15.4±7.1 13.2±5.1 E3 4 32.3±17.3 30.8±30.5 40.8±25.1 26.5±14.9 40.5±19.3 25.5±14.8 42.0±31.3 35.3±23.3 38.9±21.7 29.5±20.0 E4 4 13.0±2.2 15.0±5.0 20.5±5.3 11.5±3.1 12.8 ± 3.0 10.0±5.6 10.5±11.1 6.5±6.6 14.2±6.9 10.8±5.6
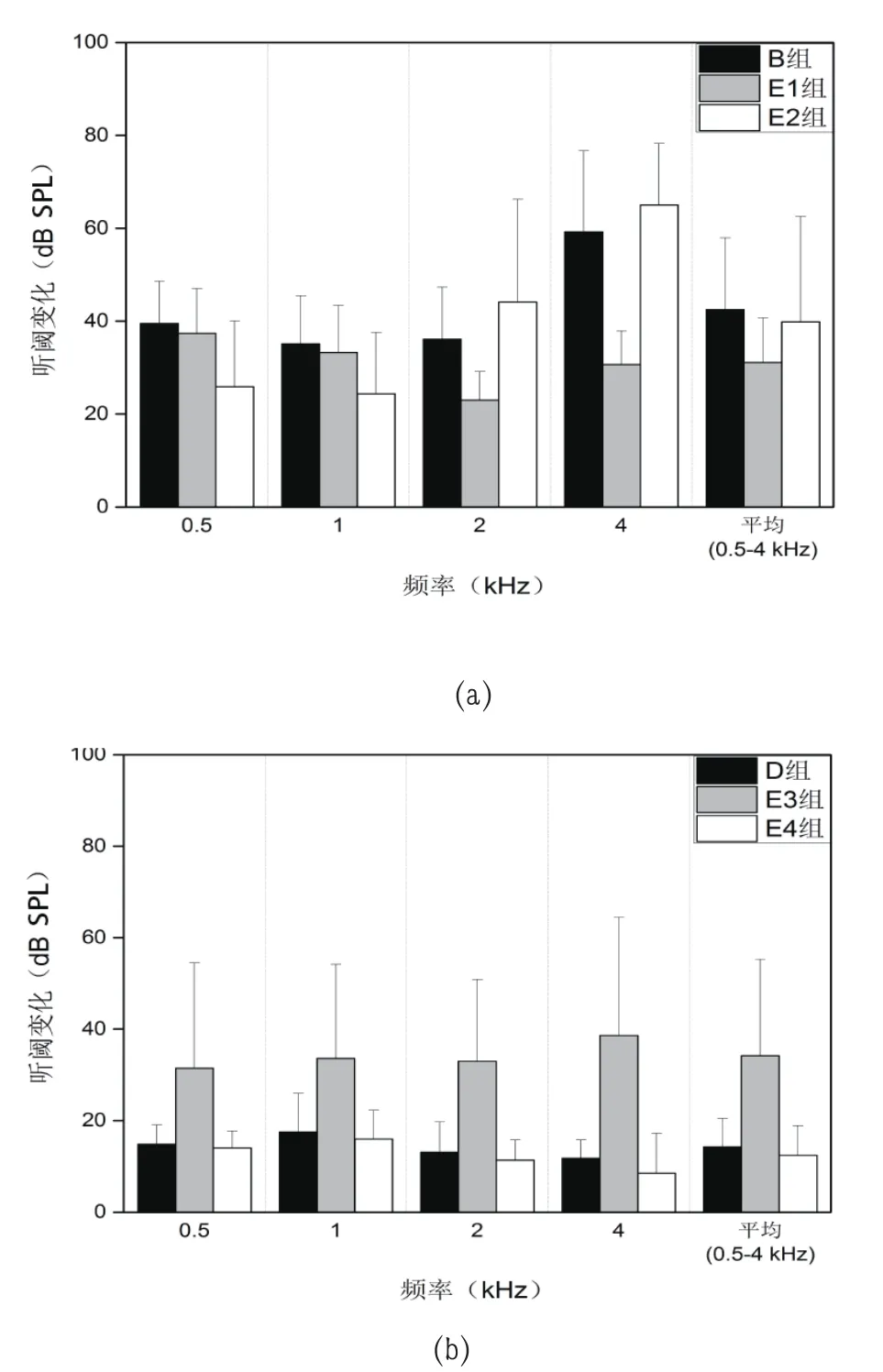
图3 B组、E1组和E2组的听阈变化(±SD,dB SPL)比较(a),D组、E3组和E4组的听阈变化(±SD,dB SPL)比较(b)

图4 耳蜗基底膜铺片染色处理结果:基本正常(a),部分受损(b),严重损坏(c)
一般动物听力曲线的敏感范围从0.5~16 kHz,而鼠则从6.3~24 kHz。为了验证噪声习服的频率特异性,Fowler[14]等人使用了小鼠听力图。尽管如此,结果并没有显示有任何的保护作用,小鼠的听觉系统一度被认为对于噪声习服有特殊的反应。所以目前对于条件性噪声频率特异性未有肯定的研究,对于各种频率的交叉保护作用亦不明确。
E1组和B组平均阈移之间的差异是明显的,尤其是在高频率(2 kHz 13.1 dB SPL,4 kHz 28.6 dB SPL,P=0.000<0.05),这证明了条件性噪声的保护作用是存在的。Masoud Motalebi Kashani[15]发现不同频率预处理声音的频差不影响ABR阈移,这不同于本实验结果。由于不同声刺激方法的使用,4 kHz噪音表现出良好的同频率和交叉频率保护作用,E1和E2在4 kHz的听阈差异充分揭示了4 kHz条件噪声的频率特异性。此外,0.5 kHz预处理噪声降低了随后的4 kHz的噪声暴露低频率的阈值偏移(0.5 kHz 13.6 dB SPL,4 kHz 10.8 dB SPL,P=0.006<0.05)。因此,低频率声音可能会为进一步的噪声暴露提供保护,特别是对低频范围内的噪音,但是0.5 kHz的条件性噪声对于4 kHz的保护性不明显。而且,0.5 kHz中等水平声音对后续0.5 kHz高强度噪声的高频区域几乎不能起到保护作用(D组,E4组)。D组E3组,4 kHz的声音提高了所有频率的阈值变化,没有任何保护作用,这与之前skellett[16]的报道一致。
此前的研究表明,强烈的噪音刺激会导致细胞坏死和细胞凋亡同时发生。Hoechst是一种具有核酸的特异性染料,用来区分坏死与凋亡。染色质浓缩和核碎裂发生在凋亡细胞中,荧光显微镜下呈现为核密集染色或碎片密集染色。然而,坏死细胞通常为核肿胀的荧光褪色。荧光染色描绘了三个病理变化:核肿胀、核溶解和部分细胞丢失。如图4所示,外毛细胞比内毛细胞有更多的损伤。此外,外毛细胞的损伤主要集中在耳蜗底转和二转,与之前Hu[17]的研究相符。损坏的细胞往往从底转到顶转越来越少。由于底转和二转更接近鼓膜,它更有可能受到噪声影响。
表5 每组每个频率的平均听阈(±SD,dB SPL)

表5 每组每个频率的平均听阈(±SD,dB SPL)
组别 样本数量 0.5 kHz 1 kHz 2 kHz 4 kHz 平均值 (0.5~4 kHz)A 4 15.0±13.4 22.6±12.7 17.0±9.8 19.1±12.8 18.4±12.0 B 4 39.5±9.1 35.1±10.3 36.1±11.2 59.3±17.4 42.5±15.5 C 4 12.0±5.8 15.4±7.1 8.3±7.0 9.1±6.3 11.2±6.8 D 4 14.9±4.2 17.5±8.5 13.1±6.6 11.8±4.0 14.3±6.2 E1 4 37.4±9.7 33.3±10.1 23.0±6.1 30.6±7.3 31.1±9.6 E2 4 25.9±14.2 24.4±13.2 44.1±22.1 65.0±13.2 39.8±22.7 E3 4 31.5±23.0 33.6±20.6 33.0±17.9 38.6±25.8 34.2±21.1 E4 4 14.0±3.7 16.0±6.3 11.4±4.4 8.5±8.7 12.5±6.5
4 结论
本次研究初步证明了不同频率条件性噪声保护作用的频率特异性。不同频率的条件性噪声对于不同类型的噪声损害的保护作用是有明显差异的,这对于研究不同噪声损害保护中是否应该使用不同的频率类型提供了依据,此外,更多频率的组别、基底膜上不同的部位的损害情况及形态学依据也将加入后续研究。
[1]Miller JD.Deafening effect of noise on the cat[J].Acta Otolaryngol 1963;suppl 176:44-52.
[2]Clark WW.Effect of periodic rest on hearing loss and cochlear damage following exposure to noise[J].The Journal of the Acoustical Society of America 1987;82:1253-1264.
[3]Sinex DG.Effect of periodic sensitivity following exposure to noise[J].J Acoust Soc Am 1987,82:1265-1273.
[4]Canlon B,Borg E,Flock A.Protection against noise trauma by pre-exposure to a low level acoustic stimulus[J].Hear-Res,1988,34(2):197-200.
[5]McFadden SL,Henderson D,Shen YH.Low-frequency“conditioning” provides long-term protection from noiseinduced threshold shifts in chin chillas[J].Hear-Res. 1997,103:142-150.
[6]Dagli,Canlon B.The effect of repeated daily noise exposure on sound-conditioned and unconditioned guinea pigs[J].Hear-Res,1997,104(1-2):39-46.
[7]Yamasoba T,Dolan DF,Miller JM.Acquired resistance to acoustic trauma by sound conditioning is primarily mediated by changes restricted to the cochlear,not by systemic responses[J]. Hear-Res,1999,127(1-2):31-40.
[8]Campo P,Subramaniam M,Henderson D.The effect of“conditioning”exposures on hearing loss from traumatic exposure[J].Hear-Res,1991,55(2):195-200.
[9]Subramaniam M,Campo P,Henderson D.Development of resistance to hearing loss from high frequency noise[J].Hear-Res.1991.56:65-68.
[10]武瑾,崔勇,施泽涛.噪声对大鼠耳蜗基底膜凋亡诱导因子表达的影响[J].中华耳科学杂志,2013,11(2):296-301.
[11]丁大连,李明,姜泗长等[M].内耳形态学.哈尔滨:黑龙江科学技术出版社,2001:24-25.
[12]李兴启.正确认识听觉诱发反应测听技术及其应用[J].听力学及言语疾病杂志,2012,20(1):1-5.
[13]Subramaniam M,Henderson D,Pongr V.Effect of lowfrequency“conditioning”on hearing loss from high-frequency exposure[J].J-Acoust-soc-Am.1993,93(2):952-956.
[14]Fowler T,Canlon B.The effect of noise trauma following training exposures in the mouse[J].Hear-Res,1995,88(1-2)1-13.
[15]Masoud Motalebi Kashani,Mehdi Akbari,Akram Pourbakht.Effect of Sound Conditioning on Click Auditory Brainstem Response Threshold Shifts in Guinea Pigs[J].Audiology,10,2012.
[16]Skellett RA,Cullen JK.Conditioning the auditory system with continuous vs.Interrupted noise of equal acoustic energy:is either exposure more protective? [J]Hear-Res,1998,116(1-2):21-32.
[17]Hu,BH,Guo W,Wang PY,et a1.Intense noise-induced apoptosis in hair cells of guinea pig cochleae[J].Acta Otolaryngol,2000.120(1):19-24.

