固相萃取-气相色谱-串联质谱法检测土壤中15种邻苯二甲酸酯
宫俊杰,孙欣,王明林
(1.龙大食品集团有限公司,山东烟台 265231; 2.山东农业大学食品科学与工程学院,山东泰安 271018)
固相萃取-气相色谱-串联质谱法检测土壤中15种邻苯二甲酸酯
宫俊杰1,孙欣2,王明林2
(1.龙大食品集团有限公司,山东烟台 265231; 2.山东农业大学食品科学与工程学院,山东泰安 271018)
建立了固相萃取结合气相色谱串联质谱联用仪检测土壤可15种邻苯二甲酸酯残留的方法。样品采用丙酮和石油醚超声提取,取上清液浓缩,上弗罗里硅土固相萃取柱净化,收集洗脱液,定容,以气相色谱串联质谱法分析。该方法在20~2 000 ng/g范围内线性关系良好(r2>0.999 0),检出限(S/N=3)为0.12~0.61 ng/g。20,50,200 ng/g 3个添加浓度的15种邻苯二甲酸酯的加标回收率在78.9%~101.8%之间,测定结果的相对标准偏差为0.19%~8.34%(n=5)。该方法准确、灵敏,符合痕量分析的要求,适用于土壤可邻苯二甲酸酯类残留的分析。
邻苯二甲酸酯类;固相萃取;气相色谱串联质谱法;土壤
作为重要的工业原料,邻苯二甲酸酯(PAEs)在塑料制品、化妆品、纺织品等工业产品中有着非常广泛的应用,常作为工业生产中塑料、树脂和橡胶类制品的增塑剂,是一类重要的环境激素类化合物[1]。PAEs可增加聚合物材料的延展性和柔软度,并具有难挥发、耐热、耐光和耐寒等特点,在塑料中的添加量可高达20%~50%[2]。塑化剂使用过多产生的负面影响日益凸显。长期摄入含有塑化剂及其代谢产物的农作物会对人体产生肝肾毒性,发育毒性,生殖毒性和致癌作用[3-6]。土壤中的PAEs主要来自农用塑料废弃物在土壤中的沉积与扩散。许多调查表明,在各地的土壤组分中,检出较多的是邻苯二甲酸二异辛酯(DEHP)和邻苯二甲酸二异丁酯(DIBP),邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)及邻苯二甲酸丁苄酯(BBP)检出相对较少,部分地区的PAEs含量甚至超过美国土壤PAEs的控制标准[7],土壤中的PAEs超标会直接导致农作物中PAEs的高残留。
目前,PAEs常用的检测方法有高效液相色谱法[8]、气相色谱法[9]、液相色谱串联质谱法[10]、气相色谱串联质谱法[11]。国内文献及国家行业标准以气相色谱串联质谱法居多[12-15],而土壤中PAEs的检测还没有相关标准。笔者采用固相萃取-气相色谱-质谱法测定土壤中的PAEs,为建立土壤中PAEs检测技术标准提供依据。
1 实验部分
1.1 主要仪器与试剂
三重串联四极杆气相色谱-质谱联用仪:GCMS-TQ 8030型,附带自动进样器,日本岛津有限公司;
高速冷冻离心机:TGL-16型,湖南湘仪实验室仪器开发有限公司;
超声仪:DS-8510型,上海生析超声仪器有限公司;
电子天平:E204型,感量为0.000 1 g,梅特勒-托利多国际贸易(上海)有限公司;
玻璃离心管:50 mL,上海佛雷堡生物科技有限公司;
具塞三角瓶:100 mL,姜堰市夏南生化器械厂;
有机系过滤膜:孔径为0.22 μm,菲罗门科技有限公司;
弗罗里硅土固相萃取柱:容量为5 mL,美国Suplco公司;
C18固相萃取柱:容量为5 mL,美国Suplco公司;
硅胶固相萃取柱:容量为5 mL,美国Suplco公司;
丙酮、石油醚、正己烷、无水硫酸镁:分析纯;
乙腈:色谱纯;
DMP、DEP、邻苯二甲酸二丁酯(DBP)、DEHP、邻苯二甲酸正辛酯(DNOP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二戊酯(DPP)、BBP、DIBP、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二己酯(DHXP)、邻苯二甲酸二丙酯(DPRP)、邻苯二甲酸二烯丙酯(DAP)标准样品:德国Dr. Ehrenstorfer公司。
1.2 溶液配制
DPRP-DAP混合标准储备液:100 μg/mL,准确称取DPRP和DAP标准样品各5 mg( 精确至0.01 mg),用乙腈溶解混合,置于50 mL容量瓶中,定容至标线。
DMP,DEP,DBP,DEHP,DNOP,DCHP,DPP,BBP,DBP,DMEP,BMPP,DEEP,DHXP 13种PAEs混合标准溶液:各组分质量浓度均为100 μg/mL。
15种标准混合储备液:各组分质量浓度为50 μg/mL,各取上述DPRP-DAP混合标准储备液和13种PAEs混合标准溶液5 mL,混合定容于10 mL容量瓶中,避光于冰箱中4℃下保存。
混合标准工作溶液:为了消除基质对测定结果的影响,每次实验前土壤样品按照1.4.1处理,得到提取后的上清溶液,用上清液梯度稀释标准混合储备液,分别制成0.02,0.05,0.2,1.0,2.0 mg/L系列混合标准工作溶液。不同批次样品现用现配。
1.3 仪器工作条件
1.3.1 气相色谱
色谱柱:Rtx-5 ms柱(30 m×0.25 mm,0.25 μm,美国RESTEK公司);载气:氦气;进样口温度:280℃;柱流量:1 mL/min;进样体积:1 µL;不分流进样;柱温:程序升温,升温程序见表1。
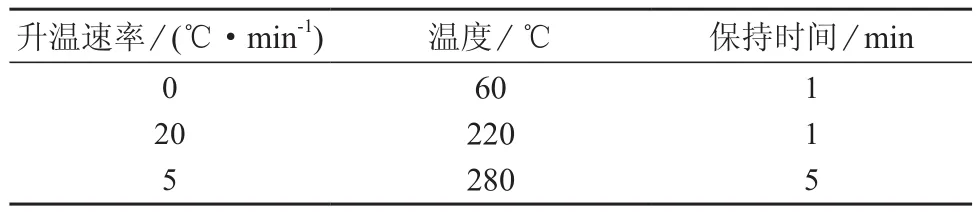
表1 色谱柱升温程序
1.3.2 质谱
电离方式:电子轰击电离源EI;监测模式:多反应监测(MRM)模式;离子源温度:280℃;接口温度:280℃;碰撞气:氩气;溶剂延迟:3.0 min。
15种PAEs的目标离子对和参考离子对的色谱保留时间及部分质谱参数见表2。
1.4 实验步骤
1.4.1 样品提取与富集
采集后的土壤样品去除杂质,于60℃干燥箱中鼓风干燥8 h,干燥后的样品用研钵研磨均匀,过0.25 mm孔径的筛子。准确称取5.00 g土壤样品于100 mL具塞三角瓶中,加入40 mL丙酮-石油醚混合溶剂(1∶5),于30℃超声提取15 min,加入4 g无水硫酸镁,振荡10 min后静置3 min,取上清液25 mL于50 mL玻璃离心管中,以4 000 r/min转速离心5 min,取20 mL上清液,氮吹浓缩至2 mL。
1.4.2 样品净化
先后用石油醚5 mL和丙酮5 mL淋洗弗罗里硅土固相萃取柱,弃去淋洗液,加入1.4.1所得浓缩后的样品提取液,再用10 mL丙酮-石油醚混合溶剂(1∶1)洗脱,收集洗脱液,氮吹浓缩至干,用甲醇定容至1.0 mL,上样分析。
2 结果与讨论
2.1 气相色谱条件的优化
2.1.1 色谱柱与进样方式
邻苯二甲酸酯类是中等偏弱极性物质,沸点比较高,适合选择弱极性或者非极性固定相的色谱柱。实验所选Rtx-5 ms色谱柱(30 m×0.25 mm,0.25 μm)以5%的二苯基-95%二甲基聚硅氧烷为固定相,极性弱,柱流失少,是理想的GC-MS分析色谱柱。为了提高灵敏度、达到痕量分析的要求,选择不分流进样方式。

表2 15种PAEs的GC-MS/MS分析参数
2.1.2 溶剂延迟时间
溶剂出峰会引起仪器检测器饱和,导致机器报错,所以设置合理的溶剂延迟时间既能防止机器报错又不影响样品出峰。本实验根据真空度监测窗口的真空度波动和第一目标物的出峰时间选择溶剂延迟时间为3 min。
2.1.3 程序升温
试验了两个程序升温条件方案。
方案一:初始温度设为40℃,保持1 min,以10℃/min 升至280℃并保持5 min。此方案3~4.5 min内样品和混合标准溶液都没有出峰;4.5~13 min样品出峰少,且保留时间间隔长;13~25 min出峰多且比较集中,总用时30 min。
方案二:初始温度设为60℃,保持1 min,以20℃/min 升至220℃,保持1 min,然后以5℃/min升至280℃并保持5 min。此方案3 min后即出现样品峰,3~21 min出峰基本分开,总用时26 min。
方案二比方案一用时短,所以选择方案二。
图1为最佳色谱条件下15种PAEs混合标准溶液的总离子流色谱图。由图1可知,15种PAEs化合物分离良好。
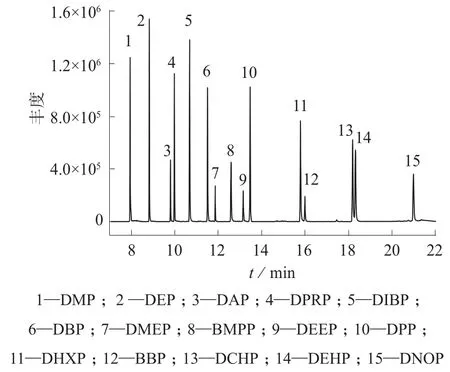
图1 15种PAEs标准物质总离子流色谱图
2.2 质谱条件的优化
2.2.1 检测器电压
当仪器真空度达到实验要求时进行色谱峰监测,检测器电压设置为0.7 kV,观察氮气和水色谱峰,氮气峰小于水峰的二分之一,则在要求范围内,即可进行调谐,保存调谐所得到电压值0.9 kV。为了增加灵敏度,使用“SCAN”模式时选择检测器电压为1.0 kV;使用“MRM”模式时选择检测器电压为1.2 kV。
2.2.2 离子对和碰撞电压
在Q3SCAN全扫描模式下,将混合标准溶液进样扫描,得15种PAEs的特征一级质谱图。对于每一种组分,选择多个或一个质荷比较大的特征离子作为该目标物的母离子。选定母离子后,编辑产物离子扫描方法。在不同的能量下将目标物的母离子打碎,得到不同电压下15种PAEs的特征二级质谱图,选择3个丰度较高的特征离子作为子离子,从而确定15种PAEs的离子对和碰撞电压,得到MRM扫描方法。以DONP为例,图2为在Q3SCAN全扫描模式下得到的DONP碎片离子丰度图,图中丰度高且质荷比较大的特征离子为m/z149,选择149为DONP的母离子,使用碎片离子扫描模式选择m/z65,m/z93,m/z121 3个丰度较高的离子作为子离子。图3为MRM模式下的到的3个碎片离子的质量离子色谱(MIC)图。

图2 DONP在Q3SCAN模式下的质谱离子丰度
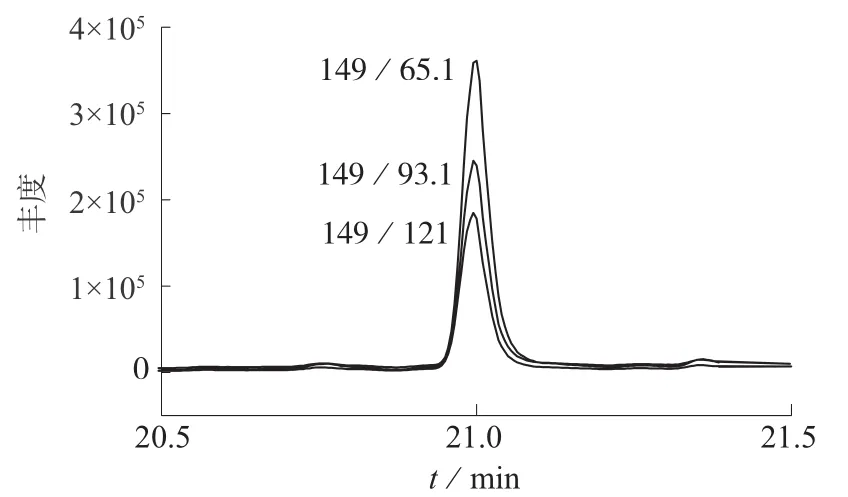
图3 DONP在MRM模式下三个碎片离子的MIC图
2.3 基质效应的考察
考虑到质谱对基质效应比较敏感,采用相对响应值法对土壤基质效应进行考察[16]。测定15种不同浓度PAEs时土壤基质效应见表3。
由表3可知,土壤基质对15种PAEs的测定普遍存在基质干扰,且浓度小的成分受到的干扰较大,所以本实验采用前处理后的基质溶液配制系列标准溶液,绘制标准工作曲线,校准后以获取较准确的结果。
2.4 土壤样品固相萃取前处理技术
2.4.1 不同提取溶剂对PAEs萃取效率的影响
PAEs是弱极性的化合物,在正己烷、丙酮和石油醚这4种常用有机溶剂中的溶解度都很高。试验比较了正己烷、石油醚、丙酮和丙酮-石油醚混合溶剂(1∶5)作为提取溶液对PAEs萃取率的影响,结果表明不同提取溶液对PAEs的萃取效果不同,使用丙酮-石油醚混合溶剂(1∶5)为提取溶液时各组分回收率最高。
2.4.2 固相萃取柱的选择
使用固相萃取小柱对提取溶液进行净化,比较了弗罗里硅土柱、C18柱和硅胶柱对净化效果和回收率的影响,结果表明使用弗罗里硅土柱净化样品回收率最高。
2.5 线性方程和检出限
将1.2配制的混合标准工作液按1.4方法进样分析,得每种浓度的溶液对应的色谱峰面积,以每个PAEs色谱峰面积Y对质量浓度X(µg/L)绘制基质标准工作曲线,以信噪比3确定检出限,信噪比10确定定量限,线性关系、相关系数、检出限和定量限见表4。由表4可知,15种PAEs的质量浓度在20~2 000 ng/g内线性关系良好,相关系数均大于0.999 0,检出限为0.08~0.61 ng/g,定量限为0.04~2.03 ng/g。
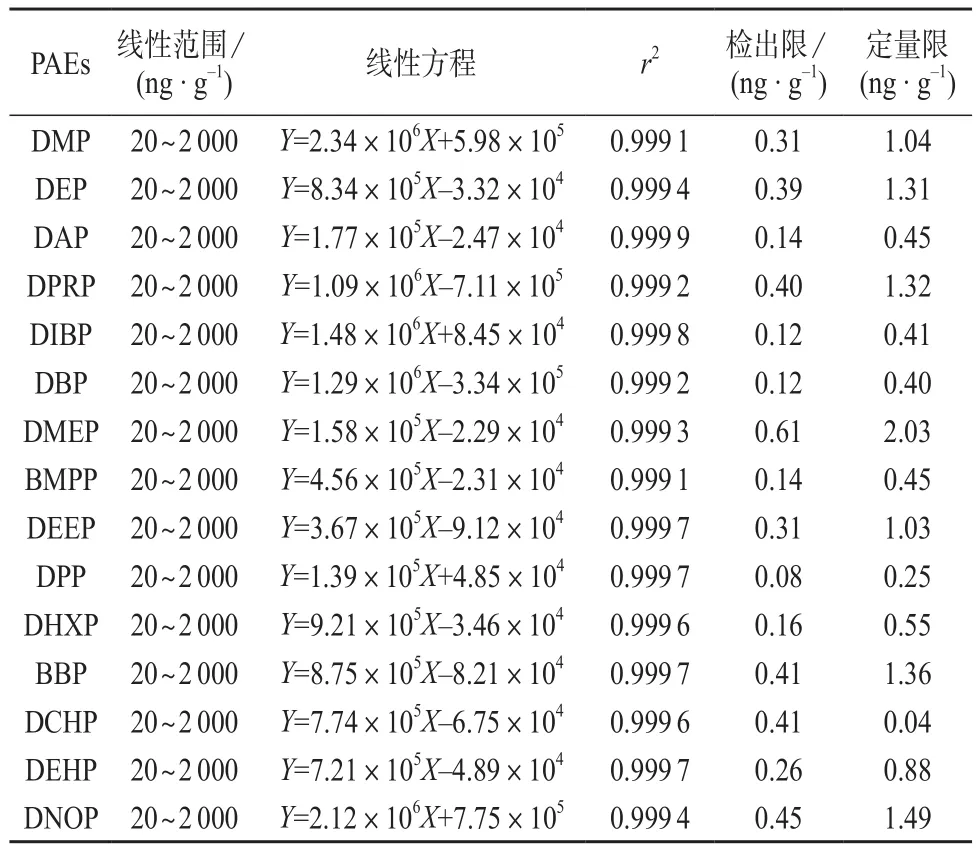
表4 15种PAEs的线性范围、相关系数、检出限和定量限
2.6 加标回收试验和精密度
设置20,50,200 ng/g 3个添加水平,向土壤空白样品中加入15种PAEs混合标准溶液,测定结果见表5。
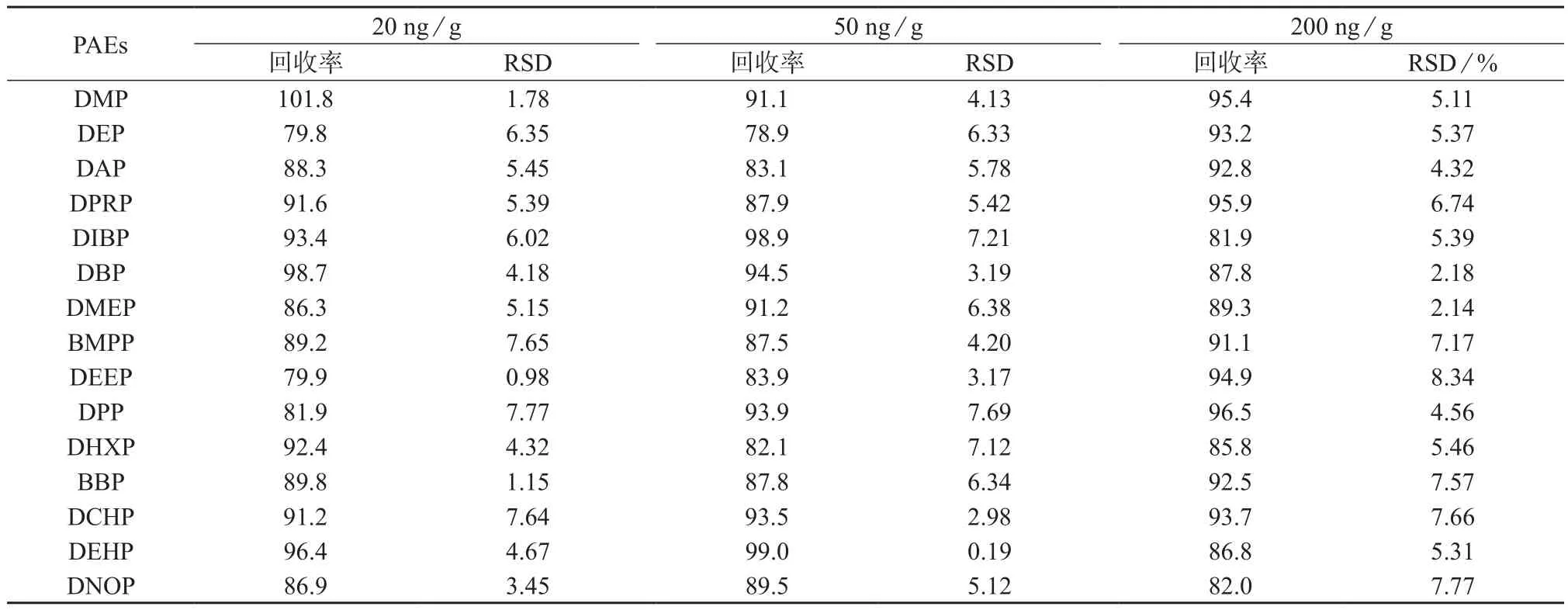
表5 15种PAEs加标回收及精密度试验结果(n=5) %
由表5可知,15种PAEs在土壤样品中的平均回收率在78.9%~101.8%之间;测定结果的相对标准偏差为0.19%~8.34%(n=5),表明该方法有良好的精密度和准确度,能满足邻苯二甲酸酯类的检测要求。
3 结语
建立了固相萃取-气相色谱串联质谱检测土壤中15种邻苯二甲酸酯类的方法。利用弗罗里硅土固相萃取柱对土壤样品进行净化,既可以吸附样品中的干扰杂质,又可以阻止固体悬浮物,不需离心操作,缩短分析时间。该方法具有良好的回收率、精密度和灵敏度,可用于土壤中邻苯二甲酸酯类的分析。
[1] 刘庆,杨红军,史衍玺,等.环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J].中国生态农业学报,2012,20(8): 968-975.
[2] 陈永山,骆永明,章海波,等.设施菜地土壤酞酸酯污染初步研究[J].土壤学报,2011,48(3): 516-523.
[3] Sui H X,Zhang L,Wu P G,et al. Concentration of di(2-ethylhexyl) phthalate (dehp) in foods and its dietary exposure in china[J].International Journal of Hygiene and Environmental Health,2014,217: 695-701.
[4] Latini G,De Felice C,Presta G,et al. Exposure to Di(2-ethylhexyl) phthalate in humans during pregnancy[J]. Apreliminary Report Biol Neonate,2003,83(1): 22-24.
[5] Foster P M. Disruption of reproductive development in male rat offspring following in utero exposure to phthalate esters[J].International Journal of Andrology,2006,29(1): 140-147.
[6] Wang P,Wang S L,Fan C Q.Atmospheric distribution of particulate-and gas-phase phthalic esters (PAEs) in a Metropolitan City,Nanjing,East China[J].Chemosphere,2008,72:1 567-1 572.
[7] 崔学慧,李炳华,陈鸿汉,等.中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展[J].生态环境学报,2010,19(2):472-479.
[8] 马燕玲,陈令新,丁养军,等.超声辅助分散液液微萃取-高效液相色谱测定水样中的4种邻苯二甲酸酯类增塑剂[J].色谱,2013,31(2): 155-161.
[9] 綦敬帅,宋吉英,史衍玺,等.微波辅助萃取-气相色谱法测定农用地膜中的邻苯二甲酸酯类增塑剂[J].食品工业科技,2014,35(1): 289-294.
[10] 刘杰,郁宏燕,鲍立杰,等.液相色谱-串联质谱法测定饮料中16种邻苯二甲酸酯[J].食品科学,2012,33(18): 211-215)
[11] 孙欣,齐莉,秦廷亭,等.QuEChERS-气相色谱-三重四极杆质谱法检测黄瓜中的19种邻苯二甲酸酯[J].色谱,2014,32(11):1 260-1 265.
[12] 宫俊杰,孙欣,王明林,等.改进QuEChERS方法结合气相色谱串联质谱检测黄瓜中的邻苯二甲酸酯类[J].食品安全质量检测学报,2016,7(1): 338-344.
[13] 张明明,刘玉兰,马宇翔,等.固相萃取-气相色谱-质谱法测定食用油中7种邻苯二甲酸酯类塑化剂[J].中国油脂,2015,40(2): 56-60.
[14] GB 31604.30-2016 邻苯二甲酸酯的测定和迁移量的测定[S].
[15] GB/T 21911-2008 食品中邻苯二甲酸酯的测定[S].
[16] 杨旭,汤佳峰,巢文军.基质效应对有机磷农药测定的影响及其解决方法[J].分析测试学报,2009,28(12): 1 368-1 372.
宁夏一国家重点实验室获批建设
科技部不久前再次发布公告称,批准建设宁夏回族自治区人民政府省部共建煤炭高效利用与绿色化工国家重点实验室。宁夏回族自治区人民政府将每年为实验室提供不低于1 000万元的实验室建设、日常运行、开放课题设立和人才引进培养专项经费。依托单位宁夏大学为实验室建设提供实验用房、科研仪器设施、科研经费等必要的基础条件,并在人才引进和人才培养等方面给予重点支持。
(林)
Determination of 15 Kinds of Phthalate Esters in Soil by Using Solid Phase Extraction-Gas Chromatography-Tandem Mass Spectrometry
Gong Junjie1, Sun Xin2, Wang Minglin2
(1. Longda Foodstuff Group Co., Ltd., Yantai 265231, China;2. College of Food Science and Engineering, Shandong Agricultural University, Taian 271018, China)
A method for the determination of 15 phthalate esters in soil by solid phase extraction and gas chromatography tandem mass spectrometry was developed. The samples were extracted with acetone and petroleum ether.The supernatant was concentrated and cleaned up on a Florisil solid phase extraction column. The eluent was collected and then analyzed by gas chromatography tandem mass spectrometry. The calibration curve was linear in the range of 20-2 000 ng/g (r2> 0.999 0) and the detection limits (S/N=3) were 0.12-0.61 ng/g. The recoveries of 15 phthalates at 20, 50 and 200 ng/g ranged from 78.9% to 101.8% with RSDs of 0.19%-8.34%(n=5). The method is accurate,sensitive and suitable for the analysis of phthalic acid esters in soil.
phthalate esters; solid phase extraction; gas chromatography-tandem mass spectrometry; soil
O657.7
:A
:1008-6145(2017)02-0052-05
10.3969/j.issn.1008-6145.2017.02.014
联系人:孙欣;E-mail: xsun@sdau.edu.cn
2017-01-12

